"Хімічні зернятка" (для педагогів та учнів 7-го класу)
На допомогу вчителю хімії та учням 7 класу. Можна використати для роботи на уроках чи для домашніх завдань.
А.В. Сичак
Контролюючий зошит знань учнів з хімії
«Хімічні зернятка» учня 7 класу
Олексицької гімназії
__________________________

2023 – 2024 н.р.
Від автора
 Хімія в дитячій уяві була рівноцінна магії: колбочки, баночки, мензурки, штативи, різнокольорові порошки та рідини, вогник, дим із пробірки й обов’язково «бабах!». Усе яскраве, цікаве й таємниче. Приготування їжі – перший хімічний процес, хімія – магія, вчинена людиною для свого
Хімія в дитячій уяві була рівноцінна магії: колбочки, баночки, мензурки, штативи, різнокольорові порошки та рідини, вогник, дим із пробірки й обов’язково «бабах!». Усе яскраве, цікаве й таємниче. Приготування їжі – перший хімічний процес, хімія – магія, вчинена людиною для свого
подальшого розвитку.
Ми звикли чути: «Не їж, цього, воно ж шкідливе! Це ж хімія! Не чіпай пляшку на полиці! Це ж хімія! Не одягай цього, воно ж – хімія!». Тому давайте разом вивчати і з’ясовувати коли хімія шкідлива, а коли корисна.
Прагнення до самостійності, яке притаманне підліткам, має стати основою проведення уроків із застосуванням зошитів, що дадуть можливість самостійно опановувати все нові і нові знання та формувати навики самостійного розв’язування задач та їх оформлення, особливо у 7 класі.
Даний зошит учні зможуть використовувати не тільки на уроці під керівництвом учителя, але й удома за завданнями педагога чи самостійно набувати хімічні знання та перевіряти свої уміння й навички оформляти та розв’язувати задачі з хімії, систематизувати усі свої знання.
Зошит розрахований на учнів різного рівня навчальних досягнень та різного типу характеру. Його використання допоможе зекономити час на уроці та вдома, дасть також можливість самостійно завершити усі завдання. Щоб за менший проміжок часу школярі розв’язали більшу кількість завдань, а завдання із малюнками розвивали їх візуальну пам'ять та вчили за допомогою простих малюнків трактувати хімічні явища природи, та зробити легшим сприйняття навколишнього світу та розуміти «побутову» хімію.
Усім семикласникам бажаю стати ефективними природодослідниками і в подальшому зробити свої наукові відкриття, стати раціоналізаторами та всесвітньо відомими! Пам’ятати, що хімія приносить користь тільки при правильному її використанні. Бо хімія буває дуже шкідливою!
§ 1. Хімія – природнича наука. Речовини
1. Складіть коротке оповідання про предмет вичення хімії на прикладі відомих вам речовин з побуту. _________________________________ ____________________________________________________________
____________________________________________________________
____________________________________________________________ ____________________________________________________________ ____________________________________________________________
____________________________________________________________
2. Що таке хімія? ____________________________________________
3. Наведіть приклади, коли хімія корисна. ________________________
____________________________________________________________
____________________________________________________________
4. Наведіть приклади, коли хімія є шкідливою. ____________________
____________________________________________________________
____________________________________________________________
§ 2. Короткі відомості з історії хімії
1. Де була започаткована хімія як наука? _________________________
2. Від якого слова походить назва хімія у Єгипті? В Україні?
____________________________________________________________
____________________________________________________________
3. Які чотири періоди розвитку хімії відомі людству? _____________
____________________________________________________________
§ 3. Правила поведінки у кабінеті хімії
1. Запишіть у робочий зошит правила поведінки у хімічному кабінеті (стор.18-19 підручника).
2. Запишіть обладнання кабінету хімії. ___________________________ ____________________________________________________________
____________________________________________________________
3. Запишіть лабораторний посуд кабінету хімії. __________________ ____________________________________________________________
____________________________________________________________
4. Чим можна знешкодити кислоту? ____________________________
5. Чим можна знешкодити луг? ________________________________
§ 4. Фізичні тіла. Матеріали. Речовини
1. Наведіть приклади: а) природних речовин – __________________
б) штучних речовин – _____________________________________
2. Підкресліть назви фізичних тіл однією лінією, а речовини – двома лініями: бензин, цвях, краплина води, дерев’яна лінійка, аркуш паперу, скло, колба, каблучка, вода, золото, пластмаса, льодяна бурулька, крейда, залізо, мідь, пробірка.
3. Підкресліть назви фізичних тіл (однією лінією) і речовин (двома лініями): термометр, срібло, деревина, стілець, торф, вуглекислий газ, алюмінієвий дріт, графіт, питна сода, ртуть, вапняк, крига, зошит, крапля роси, парта, ручка.
4. Наведіть приклади предметів, які можна виготовити з наведених речовин: а) срібло – _______________________________________, б) залізо – ________________________________________________,
в) пластмаса – ____________________________________________.
5. Підкресліть сучасні матеріали: глина, капрон, вовна, кістка, каучук, залізо.
6. Підкресліть традиційні матеріали: поліетилен, бронза, камінь, алюміній, залізо.
§ 5. Чисті речовини. Суміші та пособи їх розділення
1. Опишіть фізичні властивості речовин:
а) крейди _________________________________________________
б) води ___________________________________________________
в) питної соди ____________________________________________
г) цукру __________________________________________________
2. За якими фізичними властивостями можна розпізнати:
а) харчову соду та пісок – __________________________________
б) сірку й залізні ошурки – __________________________________
в) нашатирного спирту та води – ____________________________ 3. Підкресліть фізичні властивості, притаманні залізу (за стандартних умов): тверде, рідке, має магнітні властивості, електропровідне, сріблясто-білого кольору.
4. Підкресліть назви чистих речовин (одна лінія) та сумішей (дві лінії): мінеральна вода, молоко, повітря, залізо, грунт, сметана, вуглекислий газ, кисень, цукор, граніт, нафта, кефір, мідь, дистильвана вода, кухонна сіль, оцет, попіл, цукровий сироп, крейда, золото.
5. Підкресліть ряд, в якому записано лише чисті речовини?
а) кисень, повітря, вуглекислий газ;
б) дистильована вода, водень, цукор;
в) вода, мідь, кухонна сіль;
г) граніт, азот, питна сода.
6. Запропонуйте способи розділення сумішей:
а) пісок і тирса – _________________________________________
б) залізо і сода – _________________________________________
в) сіль + вода + крейда – __________________________________
г) рослинна олія + вода + сіль – ____________________________ ________________________________________________________ ґ ) залізний порошок + вода + пісок – _______________________ ________________________________________________________ д) тирса + вода + спирт – __________________________________ ________________________________________________________
7. Продумайте експеримент із розділення суміші цукру, піску, залізних ошурок і деревної тирси. Складіть його план: _________ _________________________________________________________
_________________________________________________________
_________________________________________________________
8. Запропонуйте план розділення суміші кухонної солі, мідних ошурок, сірки та подрібненого пінопласту. ___________________
_________________________________________________________ _________________________________________________________ _________________________________________________________
§ 6. Атоми. Хімічні елементи
1. Напишіть назви хімічних елементів:
Cl – _______, N – ___________, Fe – ___________,
O – ___________, Al – _____________, H – _____________, Ca – _____________, Zn – ________, Cu – __________, S – _____________, К – _____________, І – __________.
2. З’єднайте лініями символ хімічного елемента та його назву:
1. О а) Калій;
2. К б) Ферум;
3. Са в) Кальцій;
4. Fe г) Оксиген.
3. Що таке «атом»? __________________________________________ 4. Заповніть таблицю, використовуючи таблицю хімічних елементів:
|
|
|
|
|
|
|
|
|
Хлор |
|
|
|
|
|
|
Бор |
|
|
|
|
|
Н |
|
|
|
|
|
|
O |
|
|
|
|
|
|
Li |
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|
|
|
17 |
|
|
§ 7. Відносна атомна маса хімічного елемента
1. Яка відносна атомна маса Гідрогену – _______;
Оксигену – _______; Цинку – _______; Золота – _______.
2. Вставте інформацію про хімічні елементи:
|
Символ елемента |
Назва |
Порядковий номер |
Відносна атомна маса Ar |
|
К |
|
|
|
|
Mg |
|
|
|
|
In |
|
|
|
|
|
Купрум |
|
|
|
|
Хром |
|
|
|
|
Ферум |
|
|
|
|
|
6 |
|
|
|
|
20 |
|
|
|
|
2 |
|
|
|
|
|
16 |
|
|
|
|
197 |
|
|
|
|
209 |
§ 8. Періодична система хімічних елементів
1. Заповніть таблицю:
|
|
|
|
|
|
|
|
|
|
|
|
Манган |
|
|
|
|
|
|
|
|
|
Калій |
|
|
|
|
|
|
|
|
Са |
|
|
|
|
|
|
|
|
|
Zn |
|
|
|
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
4 |
І |
|
|
|
2. Користуючись наведеним нижче переліком речовин, заповніть таблицю, O, Sn, Si, Al, Br, Na, F, H, Pb, K, Na, Cl, Cu:
|
Метали |
Не метали |
|
|
|
§ 9. Прості та складні речовини
1. Виберіть формули простих речовин (підкресліть ряд):
а) N2, Cl2, O2, O3, Al;
б) Cu, H2O, CaO, H2SO4;
в) H2O, MgO, Cu, H3PO4;
г) HCl, H2O, H2SO4, NaOH.
2. З переліку речовин випишіть підкресліть формули простих (одна лінія) та складних речовин (дві лінії): Fe, CuO, CO2, H2, Fe, CaC2, KCl, N2.
3. Користуючись наведеним нижче переліком речовин (O2, Sn,
C6H12O6, Si, Al, Br2, ZnS, Na, Al2(SO4)3, F2, H2O2, H2, Pb, V2O5) заповніть таблицю:
|
Прості речовини |
Складні речовини |
|
|
Метали |
Не метали |
|
|
|
|
|
§ 10. Хімічні формули речовин
1. Що означають вирази? 3Al – _______________________,
8O3 – _______________________, 6CO2 – _____________________,
4N2 – _______________________, C – ________________________,
6F2 – _______________________, SiO2 – ______________________, 2H – ____________________, 2H2 – __________________________.
2. Напишіть формули речовин, до складу яких входять:
а) три атоми Калію, один атом Фосфору, чотири атоми Оксигену – ________________. б) два атоми Натрію, один атом Силіцію, три атоми Оксигену – ________________. в) чотири атоми Гідрогену, два атоми Фосфору, сім атомів Оксигену – ________________.
3. Опишіть якісний і кількісний склад молекули за хімічною формулою: Al2O3 – ________________________________________; Al2(SO4)3 – _______________________________________________;
H3PO4 – _________________________________________________; С12H22O11 – _______________________________________________.
4. Записати у вигляді хімічних формул:
- 3 атоми Гідрогену – _____________________;
- 4 молекули Н2О – _____________________;
- 5 молекул кисню – _____________________;
- 3 атоми Оксисену – _____________________;
- 10 молекул вуглекислого газу – _____________________; - 2 атоми сірки – _____________________.
5. Що означають вирази?
3Al – _____________________________________
8O3 – _____________________________________
6CO2 – ____________________________________
4N2 – _____________________________________
6F2 – _____________________________________
SiO2 – ____________________________________
6. Напишіть формулу речовини, до складу якої входять чотири атоми Гідрогену, два атоми Фосфору, сім атомів Оксигену – __________ .
7. Опишіть якісний і кількісний склад молекули за хімічною формулою: FeOH(NO3)2 – _____________________________________
__________________________________________________________
NH4H2PO4 – ______________________________________________ ___________________________________________________________
8. Виберіть формули простих та складних речовин:
а) 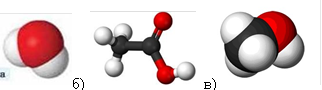 Прості – __________
Прості – __________
г)  Складні – __________
Складні – __________
9. Опишіть якісний та кількісний склад формул речовин:
а) 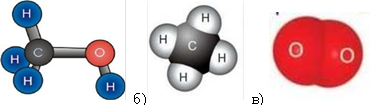
а) ________________________________________________________;
б) ________________________________________________________;
в) ________________________________________________________.
§ 11. Валентність хімічних елементів
1. Визначте валентність кожного елемента у формулах бінарних сполук (у робочому зошиті):
а) FeBr3, Mg3N2, Mn2O7, SnO2, CuО, Cu2О, Cl2O7, Na2S, CH4, SnO;
б) AlCl3, HCl, CCl4, CO2, CaCl2, SiH4, PbO, Na3N, BaO, Ca3P2, SO3, FeCl3, NaI, CaS, HF, Cu2O.
2. Скласти формули бінарних сполук із такими елементами (у робочому зошиті): Натрій, Кальцій, Алюміній, Ферум (ІІ), Ферум (ІІІ), Купрум (ІІ), Купрум(І), Фосфор (ІІІ), Фосфор (V).
а) оксидів – сполук, до складу яких входить Оксиген;
б) сульфідів – сполук, до складу яких входить Сульфур, ураховуючи, що Сульфур у них має валентність ІІ;
в) хлоридів – сполук, до яких входить Хлору, якщо Хлор має в них валентність І.
3. Підкресліть металічний елемент, який у сполуках з Оксигеном проявляє найбільшу валентність: WO3, NiO, F2O, Al2O3, V2O5.
4. Підкресліть не металічний елемент, який у сполуках з Оксигеном проявляє найменшу валентність: NO, Br2O7, NO2, K2O, Cl2O3.
5. Визначте сполуку, в якій Хлор проявляє вищу валентність: HCl, HClO, HClO2, HClO3, HClO4.
6. Знаючи валентності хімічних елементів, напишіть формули їхніх сполук:
III II IV I I II VI II
а) Fe O , C H , Na S , S O ;
II II IV I III II IV II
б) Mg O , Si H , B O , S O ;
II II I I II I VIII II
в) C O , K Cl , Pb I , Os O ;
III II I III I II IV II
г) Al S , Na P , Ag O , Sn O ;
III I III II I I IV II
д) Al Cl , B O , H I , C O .
7. Виходячи з визначення валентності як кількості хімічних зв’язків визначте валентність елементів за графічними формулами. Запишіть молекулярні формули речовин:
а) 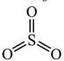 б) Са ═ О в)
б) Са ═ О в) ![]()
___________ ___________ _____________________
§ 12. Відносна молекулярна маса. Масова частка елемента у складній речовині
1. Обчисліть відносні молекулярні (формульні) маси речовин: O2, N2, O3, H2O2, H2SO4, CaF2, SiO2, H2CO3, Na2SO4,Mg(H2PO4)2, Al2(SO4), KAl(SO4)2, C6H12O6.
2. Відносна молекулярна маса сполуки Хлору з Оксигеном становить 183. Відомо, що в молекулі речовини міститься 7 атомів Оксигену.
Знайдіть її формулу.
3. Відносна формульна маса сполуки елемента Х із Флуором удвічі більша за відносну атомну масу Фосфору. Знайдіть елемент Х і напишіть формулу сполуки.
4. Обчисліть та вкажіть відношення мас атомів Гідрогену, Сульфуру і Оксигену в речовині, формула якої H2SO4.
5. Відносна молекулярна маса речовини, формула якої R2O5, дорівнює 142. Визначте елемент, який сховався в цій формулі під буквою R.
6. Складіть формулу сполуки та обчисліть її відносну молекулярну масу: а) склад – два атоми Нітрогену та п’ять атомів Оксигену; б) склад – два атоми Алюмінію та три атоми Сульфуру;
в) склад – два атоми Гідрогену, один атом Сульфуру та чотири атоми Оксигену.
7. Обчисліть масові частки усіх хімічних елементів у речовинах: Cl2O7, Mg3N2, Cu2S, Na2O, Ag3PO4, KOH, Fe2(SO4)3, Cu2(OH)2CO3, C6H12O6.
8. Обчисліть, у якій речовині більший вміст металу:
а) PbO2 чи Pb3P2;
б) Fe2O3 чи FeF2;
в) K2SO4 чи KNO3;
г) Cu(NO3)2 чи CuCl2.
9. Обчисліть масу Мангану, який можна добути із 20 т руди, що містить 14% манган (ІV) оксиду (MnO2).
10. Встановіть хімічну формулу речовини, якщо відомо масові частки елементів:
а) Al – 53%, O – 47%; б) S – 40%, O – 60%;
в) Na – 59%, S – 41%; г) N – 26%, O – 74%;
д) K – 85%, Si – 15%; е) Mg – 13%, Br – 8%;
є) Ba – 35%, I – 65%; ж) Ca – 40%, C – 12%, O – 48%;
з) К – 39,7%, Mn – 27,9%, O – 32,4%;
и) Ag – 77%, P – 7%, O – 15%;
§ 13. Фізичні та хімічні явища. Хімічні реакції
1. Підкресліть однією лінією фізичні явища і двома лініями хімічні явища: випаровування води; танення криги; обвуглення скалки; скисання молока; іржавіння цвяха; горіння вугілля; вибух динаміту; підгоріння їжі на сковороді; горіння сірника; бродіння виноградного соку; згіркнення масла; пожовтіння листя на деревах; горіння спирту; подрібнення шматка крейди; утворення хмар; плавлення шматка олова; гасіння вапна; кристалізація солі.
2. Вкажіть ознаки протікання хімічних явищ, які зображені:
 а) в)
а) в)
е)
з)  й) к)
й) к)
3. Розставте коефіцієнти у схемах:
а) K + O2 = K2O; б) Na + Cl2 = NaCl; в) KClO3 = KCl + O2;
г) Li+ H2O = LiOH + H2; д) Al + H2SO4 = Al2(SO4)3 + H2;
е) Na2O + H2O = NaOH; є) SiO2 + HF = SiF4 + H2O.
§ 14. Хімічні властивості речовин
1. Проведіть вдома спостереження за дослідами і опишіть, що ви спостерігатимете: а) залийте заіржавілий цвях оцтом і залиште його на деякий час; б) залийте подрібнену крейду оцтом і залиште її на деякий час; в) залийте заіржавілий цвях кока-колою і залиште його на деякий час; г) насипте у ложку трохи цукру, крапніть туди трохи води і нагрійте ложку на вогні; д) змішайте пів склянки молока і кілька ложок оцту; е) вкиньте до чаю скибочку лимону; є) змішайте воду, соду і оцет.
2. Опишіть, що спостерігатимете під час горіння свічки.
3. Що ви спостерігатимете, якщо у воду вкинути кілька шматочків негашеного вапна?
4. Розставте коефіцієнти у схемах і вкажіть їх суму:
а) Al2O3 + Fe = Fe2O3 + Al; сума коефіцієнтів – _____;
б) Pb(NO3)2 = PbO + NO2 + O2; сума коефіцієнтів – _____;
в) N2 + H2 = NH3; сума коефіцієнтів – _____;
5. Обчисліть масову частку Купруму в купрум (ІІ) оксиді.
6. Складіть рівняння реакцій за схемами. Вкажіть суму коефіцієнтів.
а) Fe + O2 = Fe3O4 сума коефіцієнтів – _____;
б) Ag2O = Ag + O2 сума коефіцієнтів – _____;
в) H2 + N2 = NH3 сума коефіцієнтів – _____;
г) Cr2O3 + HCl = CrCl3 + H2O сума коефіцієнтів – _____;
д) KOH + H3PO4 = K3PO4 + H2O сума коефіцієнтів – _____.
7. Складіть хімічну формулу речовини BaxSyOz, якщо відомо їх масові частки елементів у сполуці: w(Ba) = 59 %, w(S) = 14 %, w(О) = 27 %.
8. До складу речовини входить: Гідроген – 6 %, Сульфур – 94 %. Складіть хімічну формулу сполуки.
9. Виведіть хімічну формулу метану, якщо масова частка Карбону становить 75 % і Гідроген.
§ 15. Повітря. Кисень. Оксиген
1. Запишіть усю інформацію про Оксиген, користуючись періодичною таблицею хімічних елементів: символ (позначення) – ______; порядковий номер – ______; відносна атомна маса – ______; кількість електронів у атомі – ______; кількість протонів у ядрі – ______; заряд ядра – ______; період – ______; ряд – ______; група – ______; підгрупа – __________________; валентність – ______.
2. Запишіть хімічну формулу кисню – _____. 3. Обчисліть відносну молекулярну (формульну) масу кисню:
____________________________________________________________
4. Запишіть склад повітря за об’ємом: кисень – ____%; азот – ____%; карбон – ____%; благородні гази – ____%.
5. Обчисліть масову частку Оксигену у цинк оксиді (ZnO).
____________________________________________________________ 6. Обчисліть масову частку Оксигену у глюкозі (C6H12O6).
____________________________________________________________
____________________________________________________________
7. Розставте коефіцієнти у реакціях:
а) HgO = Hg + O2
б) KNO3 = KNO2 + O2
в) H2O2 = О2 + Н2O
§ 16. Закон збереження маси речовин. Хімічні рівняння
1. Розставте коефіцієнти: Сa + O2 = CaO; Ва + O2 = ВaO;
Р + O2 = Р2O5; N2 + O2 = NO;
2. Перевірте розрахунком дію закону збереження маси речовини на прикладі хімічних рівнянь: а) 4Li + O2 = 2Li2O, ___________________; б) 2HgO = 2Hg + O2, _________________________________________;
в) 3Fe + 2O2 = Fe3O4, ________________________________________.
§ 17. Добування кисню 1. Що таке каталізатори? Каталізатори – це _____________________
___________________________________________________________ 2. Розставте коефіцієнти у реакціях. Кисень добувають у лабораторії:
а) KMnO4 = K2MnO4 + MnO2 + O2 сума коефіцієнтів - ______;
б) HgO = Hg + O2 сума коефіцієнтів - ______;
в) KNO3 = KNO2 + O2 сума коефіцієнтів - ______;
г) H2O2 = О2 + Н2O сума коефіцієнтів - ______.
3. Кисень добувають у промисловості: H2O = H2 + O2. Урівняйте коефіцієнти.
§ 18. Хімічні властивості кисню. Оксиди
1. Що таке горіння? _________________________________________
___________________________________________________________
2. Що таке реакція розкладу? _________________________________
___________________________________________________________ 3. Що таке реакція сполучення? _______________________________
___________________________________________________________
4. Що таке оксиди? __________________________________________
____________________________________________________________
5. Напишіть рівняння реакцій між: а) калієм і киснем; б) фосфором і киснем; в) залізом і киснем; г) цинком і киснем; д) алюмінієм і киснем; е) сіркою і киснем; є) азотом і киснем.
§ 19. Взаємодія кисню зі складними речовинами
1. Перетворіть схеми реакцій на хімічні рівняння:
а) PH3 + O2 = ____________ д) Н2S + О2 = ____________
б) СS2 + О2 = ____________ е) SO2 + O2 = ____________
в) C12H22O11 + O2 = __________ є) CuS + O2 = ____________
г) ZnS + O2 = ____________
2. Усі органічні речовини, що містять Карбон і Гідроген, при окисненні утворюють карбон (IV) оксид СО2 і воду Н2О. Напишіть рівняння реакцій горіння речовин, що мають такі формули: C2H2, C4H8, C6H6, CH4, C6H12.
§ 20. Колообіг Оксигену у природі
1. Допишіть рівняння реакції горіння і розставте коефіцієнти:
а) C + O2 = д) Fe + O2 =
б) H2 + O2 = е) Cu + O2 =
в) S + O2 = є) P + O2 =
г) Mg + O2 = ж) Al + O2 =
2. Допишіть формули простих речовин у схемах реакцій і складіть хімічні рівняння:
а) … + … = CaO;
б) … + … = As2O3;
в) … + … = Li2O;
г) … + … = NO.
3. Яка роль кисню у вашому житті?
4. В організмі людини масою 70 кг міститься 43,4 кг Оксигену. Який відсотковий вміст Оксигену в організмі людини?
§ 21. Маркування небезпечних речовин
1. Замалюйте у зошиті мал.77, мал.78 (стор. 144-145 вашого підручника) і підпишіть їх.
2. Що ви розумієте під терміном «небезпечні речовини»?
3. Уважно розгляньте етикетку будь якої мінеральної води і запишіть, яку важливу інформацію з неї ви отримали.
§ 22. Вода
1. Визначте масове відношення хімічних елементів у воді.
2. Обчисліть масові частки елементів у воді.
3. Напишіть рівняння хімічних реакцій, серед продуктів яких вода.
4. За допомогою пластиліну двох кольорів зробити дві молекули води.
5. Підготувати короткі повідомлення:
а) вода в народній творчості (прислів’я, приказки, тощо);
б) цікаве про воду.
§ 23. Розчин і його компоненти
1. Назвіть рідини, які добре розчинні у воді______________________
2. Наведіть приклади розчинів, які трапляються в повсякденному житті_____________________________________________________
3. Яка вода в природі є найчистішою? _________________________
4. Яку речовину назвете розчинником, а яку – розчиненою речовиною, якщо компонентами розчину є:
а) розплавлені мідь масою 3 г і золото масою 7 г; _______________
б) етиловий спирт масою 10 г і ацетон масою 25 г; _____________
в) вода масою 30 г і оцтова кислота масою 70 г; ________________
г) розплавлені алюміній масою 4 г і олово масою 12 г; ___________
д) етиловий спирт масою 96 г і вода масою 4 г; ________________
5. Обчисліть масу розчину (в грамах), для приготування якого використали:
а) 200 мл води і 0,05 кг солі;
б) 2 кг калій хлориду KCl і 1 л води;
в) 0,07 л води і 2 г барій хлориду BaCl2;
г) 300 см3 води і 60 г цукру;
д) 0,04 дм3 води і 0,1 кг хлороводню HCl.
6. Обчисліть масову частку розчиненої речовини у розчинах, одержаних розчиненням:
а) 20 г калій хлориду KCl у 200 г води;
б) 5 г кухонної солі NaCl у 80 мл води;
в) 0,2 т цукру у 1 м3 води;
г) 60 г купрум (ІІ) сульфату CuSO4 у 300 мл води;
д) 0,5 кг калій гідроксиду KOH у 400 г води.
7. Обчисліть масу розчиненої речовини та води, необхідних для приготування:
а) 300 г розчину з масовою часткою солі 13%;
б) 250 г розчину з масовою часткою оцтової кислоти 6%;
в) 150 г розчину з масовою часткою цукру 25%;
г) 160 г розчину з масовою часткою калій нітрату KNO3 15%;
д) 340 г розчину з масовою часткою натрій сульфату Na2SO4 10%. 8. До 200 г розчину з масовою часткою солі 15% додали 40 г кристалічної солі. Визначте масову частку солі в утвореному розчині.
9. Лаборант приготував 120 г розчину, в якому масова частка солі становить 6%. Скільки води потрібно додати до цього розчину, щоб отримати розчин з масовою часткою солі 4%.
10. До 300 г розчину калій сульфату з масовою часткою солі 20% додали 100 г води. Обчисліть масову частку солі в одержаному розчині.
11. Злили 50 г розчину з масовою часткою розчиненої речовини 2% і 150 г розчину з масовою часткою 4%. Обчисліть масову частку розчиненої речовини в новоутвореному розчині.
12. Обчисліть відношення мас розчинника і розчиненої речовини у таких розчинах:
а) 160 г розчину солі з масовою часткою солі 0,125;
б) 210 г розчину цукру з масовою часткою цукру 14,3%;
в) 300 г розчину калій нітрату з масовою часткою солі 8%;
г) 350 г розчину натрій хлориду з масовою часткою солі 0,53.
§ 24. Взаємодія води з оксидами. Гідрати оксидів (кислоти і основи)
1. Допишіть схеми реакцій і складіть хімічні рівняння. Серед продуктів укажіть кислоти та основи:
а) Li2О + Н2О → … е) Na2O + Н2О →…
б) N2O5 + Н2О → … є) I2O5 + Н2О → …
в) Р2О5 + Н2О → … ж) CO2 + Н2О → …
г) ВаО + Н2О → … з) SO2 + Н2О → …
д) Сl2O7 + Н2О → … и) SrO + Н2О → …
2. Обчисліть відносні молекулярні маси кислот: сульфатної, нітратної, карбонатної. Обчисліть масову частку Оксигену в цих кислотах.
3. Хлор утворює кілька кислот: HCl, HClO, HClO2, HClO3. Обчисліть відносні молекулярні маси кислот. Доведіть розрахунками, у якій кислоті масова частка Хлору є найбільшою.
4. Яку масу натрій гідроксиду потрібно розчинити в 3 л води, що виготовити розчин із масовою часткою 0,2?
5. Напишіть рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення. Укажіть типи реакцій: а) KNO3 → O2 → Na2O → NaOH;
б) KClO3 → O2 → BaO → Ba(OH)2;
в) S → SO2 → H2SO3;
г) KMnO4 → O2 →P → P2O5 → H3PO4.
6. Складіть формулу гідрату оксиду (основи) ВаxОyНz, якщо відомі масові частки його компонентів: w(Ba) = 80%, w(O) = 19%, w(H) = 1%.
7. Складіть формулу гідрату оксиду (кислоти) HxSyOz, якщо відомі масові частки його компонентів: w(H) = 2%, w(S) = 33%, w(O) = 65%.
Ти – просто молодець, успішно дійшовши до цієї сторінки зошита!
Бажаю бути добрим природодослідником та впевненим юним хіміком! Адже вершини знань підкоряються тільки наполегливим!


про публікацію авторської розробки
Додати розробку
