Хімічний склад клітини
*Для коректного відображення файлу, завантажте його на свій пристрій у форматі PDF
Підготовка до ЗНО/НМТ з біології. Тема 1.2 "Хімічний склад клітини". У конспекті подано особливості хімічного складу клітин, хімічні елементи та неорганічні сполуки, що входять до складу клітин, класифікацію біополімерів та їх будову (вуглеводи, ліпіди, білки, нуклеїнові кислоти, біологічно активні речовини). Також показано розв'язування задач і вправ з молекулярної біології на білки і нуклеїнові кислоти
 Розділ 1. Вступ. Хімічний склад, структура і функціонування клітин. Реалізація спадкової інформації
Розділ 1. Вступ. Хімічний склад, структура і функціонування клітин. Реалізація спадкової інформації
Тема 1.2. Хімічний склад клітини
Опорні конспекти
За програмою ЗНО/НМТ з біології
Зміст
Заняття №1. Єдність хімічного складу – фундаментальна властивість живого. Хімічні елементи. Неорганічні речовини
Заняття №2. Органічні речовини. Біополімери. Вуглеводи. Ліпіди
Заняття №3. Білки. Ферменти
Заняття №4. Нуклеїнові кислоти. АТФ
Практикум. Розв’язування елементарних ![]() задач і вправ з молекулярної біології
задач і вправ з молекулярної біології
Заняття №5. Біологічно активні речовини (оглядово)
Заняття №1. Єдність хімічного складу – фундаментальна властивість живого. Хімічні елементи. Неорганічні речовини
1. Особливості хімічного складу живого. Хімічні елементи
1) Усі біологічні системи мають більш-менш однаковий хімічний склад.
Єдність хімічного складу є фундаментальною властивістю живого
|
Хімічний склад живого |
|
|
|
Хімічні елементи |
Органічні речовини |
Неорганічні речовини |
|
Органогени, макроелементи, мікроелементи, ультрамікроелементи |
Біополімери та малі органічні молекули |
Оксиди, кислоти, основи, солі |
2. Класифікація хімічних елементів за їхнім вмістом в організмах
1) Біоелементи – це хімічні елементи, які в певній кількості входять до складу біологічних систем, проявляють певні властивості та виконують специфічні функції
|
|
Біоелементи |
|
|
|
Органогени |
Макроелементи |
Мікроелементи |
Ультрамікроелементи |
|
до 98% |
до 2% |
до 0,1% |
до 0,000001% |
|
Карбон, Оксиген, Гідроген, Нітроген |
Магній, Ферум, Калій, Кальцій, Сульфур, Натрій, Хлор, Фосфор |
Йод, Цинк, Купрум, Флуор, Манган, Кобальт, Бром |
Плюмбум, Аргентум, Аурум, Меркурій, Платина |
2) Органогени – це неметалічні елементи, які мають малі розміри та невелику молекулярну масу. Вони є основою життя, без них біологічні системи існувати не можуть
• Карбон входить до складу молекул усіх органічних речовин
• Оксиген входить до складу води (Н₂О) та органічних речовин, забезпечує реакції окиснення
• Гідроген входить до складу води (Н₂О) і органічних речовин, забезпечує реакції відновлення
• Нітроген входить до складу білків, нуклеїнових кислот, АТФ, БАР (ферментів і вітамінів)
3) Макроелементи
• Магній входить до складу хлорофілу, бере участь у фотосинтезі, синтезі АТФ, ДНК і РНК, передачі нервових імпульсів та скороченні м’язів
• Ферум входить до складу гемоглобіну, міоглобіну, ферментів дихання і фотосинтезу
• Калій бере участь в регуляції роботи серця (зменшує ЧСС і силу скорочень), забезпечує транспорт речовин всередину клітини під дією калій-натрієвого насосу
• Кальцій входить до складу кісток і надає їм твердості, бере участь в регуляції роботи серця (збільшує ЧСС і силу скорочень), забезпечує збудження м’язів і зсідання крові
• Натрій бере участь у регуляції водно-сольового балансу, забезпечує транспорт речовин з клітини під дією калій-натрієвого насосу
• Хлор входить до складу шлункового соку, бере участь у регуляції водно-сольового балансу
• Фосфор входить до складу кісток, білків, нуклеїнових кислот і АТФ
Макроелементи мають високу здатність утворювати йони
|
Йони макроелементів (катіон – позитивно заряджена частинка, аніон – негативно заряджена!) |
|
|
Назва |
Біологічне значення |
|
Na⁺ |
Бере участь у регуляції водно-сольового балансу, забезпечує транспорт речовин з клітини під дією калій-натрієвого насосу |
|
K⁺ |
Бере участь в регуляції роботи серця, забезпечує транспорт речовин всередину клітини під дією калій-натрієвого насосу |
|
Cl⁻ |
Входить до складу шлункового соку, бере участь в регуляції водно-сольового балансу |
|
Ca²⁺ |
Забезпечує зсідання крові та збудження м’язів, входить до складу кісток, бере участь у регуляції роботи серця |
|
Mg²⁺ |
Бере участь у фотосинтезі, синтезі АТФ і нуклеїнових кислот, скороченні м’язів та проведенні нервових імпульсів, входить до складу хлорофілу |
4) Мікроелементи
• Йод входить до складу гормонів щитоподібної залози (тироксину і трийодтироніну)
• Цинк входить до складу близько 400 ферментів, впливає на швидкість передачі нервових імпульсів
• Купрум входить до складу гемоціаніну молюсків, ферментів дихання і фотосинтезу
• Флуор входить до складу емалі зубів і кісток
• Кобальт входить до складу вітаміну В12, який регулює кровотворення
5) Ультрамікроелементи – до сьогодні їх біологічна роль є мало дослідженою, зазвичай вони потрапляють до організму випадково або разом з іншими речовинами
3. Наслідки недостатнього або надлишкового надходження в організм людини хімічних елементів та способи усунення їх нестачі
1) Біоелементоз (мікроелементоз) – це тимчасове або тривале порушення біоелементного складу організму, яке виникає внаслідок нестачі, надлишку чи дисбалансу хімічних елементів, та призводить до пригнічення життєдіяльності
2) Біолементози бувають природними ендогенними (спричинені вродженими вадами розвитку або обумовлені спадковістю: хвороба Вільсона–Коновалова – призводить до надлишкового накопичення Купруму), природними екзогенними (їх ще називають ендемічними хворобами), техногенними (характерні для людей, які працюють на небезпечних підприємствах або живуть неподалік від них) і ятрогенними (виникають через тривале лікування препаратами, що містять мікроелементи: аргіноз)
3) Ендемічні захворювання – це хвороби, які постійно наявні в певному регіоні через відповідні соціальні, природні або екологічні умови
|
Наслідки нестачі та надлишку в організмі людини деяких біоелементів |
||
|
Елемент |
Нестача |
Надлишок |
|
Йод |
Ендемічний зоб (супроводжується збільшенням щитоподібної залози), у дітей – креатинізм (відставання в розумовому і фізичному розвитку) |
Йодизм (супроводжується порушенням серцевого ритму, підвищеною пітливістю, дратівливістю, гіперактивністю, паралічами і порушенням сну) |
|
Флуор |
Руйнування емалі зубів, остеопороз (призводить до підвищення крихкості кісток) |
Флюороз (призводить до утворення плям на емалі зубів та зниження її твердості) |
|
Ферум |
Анемія (знижений вміст гемоглобіну в крові, основні симптоми – блідість шкіряних покривів, запаморочення, швидка втомлюваність) |
Гемохроматоз – спадково обумовлене захворювання, яке призводить до надмірного всмоктування Феруму в кров зі шлунково-кишкового тракту |
|
Елемент |
Нестача |
Надлишок |
|
Кальцій |
Гіпокальціємія (основні симптоми – остеопороз, крихкість нігтів, порушення серцевого ритму, м’язові судоми, зниження тонусу м’язів, порушення зсідання крові) |
Гіперкальціємія (основні симптоми – сечокам’яна хвороба, порушення серцевого ритму, головний біль, зневоднення, виразкова хвороба |
|
Калій |
Гіпокаліємія – може призвести до смерті (основні симптоми – важкі порушення серцевого ритму аж до зупинки серця, зниження тонусу скелетних м’язів, гостра кишкова непрохідність і затримка сечі) |
Гіперкаліємія – може призвести до смерті (основні симптоми – порушення серцевого ритму аж до зупинки серця, зменшення серцевого викиду, зниження тонусу скелетних м’язів) |
4) Одним із способів усунення нестачі біоелементів є корекція харчування
|
|
Харчові продукти, що містять біоелементи |
|
Елемент |
Продукт |
|
Йод |
Морські водорості, грецький горіх, морепродукти |
|
Флуор |
Курячі яйця, крупи, молоко, морепродукти, шпинат |
|
Ферум |
Печінка, нирки, морепродукти, горіхи, бобові, спаржа |
|
Кальцій |
Молоко, сир, риба, горіхи, бобові, зелені овочі |
|
Калій |
Зелені листові овочі, цитрусові, банани, картопля |
5) Для лікування зубів використовують фторвмісні зубні пасти
2. Неорганічні речовини. Вода
|
Неорганічні речовини в біологічних системах |
|
|
Прості |
Складні |
|
1. Неметали: Кисень (О₂), Озон (О₃), Водень (Н₂), Азот (N₂) |
1. Оксиди: вуглекислий газ (CO₂), вода (H₂O), пероксид водню (H₂O₂), сульфур(VІ) оксид (SO₃), азот(V) оксид (N₂O₅) |
|
2. Кислоти: ортофосфатна (Н₃РО₄), азотна (НNO₃), хлоридна (HCl), сульфатна (H₂SO₄), сульфітна (H₂CO₃) |
|
|
2. Метали: Кальцій (Ca), Ферум (Fe), Купрум (Cu), Цинк (Zn), Магній (Mg) |
3. Основи: гідроксид натрію (NaOH), гідроксид кальцію (Ca(OH)₂), ферум(ІІІ) гідроксид (Fe(OH)₃) |
|
4. Солі: нітрати, карбонати, ортофосфати, сульфати, хлориди, силікати |
|
1) 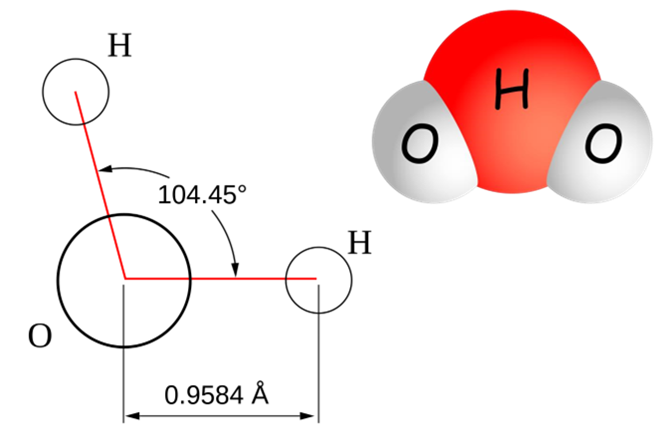 Вода – це неорганічна речовина, яка складається з двох атомів Гідрогену та одного атома Оксигену
Вода – це неорганічна речовина, яка складається з двох атомів Гідрогену та одного атома Оксигену
2) Кількість води в різних біологічних системах є різною. Найбільше води містять медузи (до 98%), найменше – комахи (40-50%) та лишайники (5-7%). Організм дорослої людини складається з води на 65-70%, її мозок містить 85% води, кров – 83%, кістки – 22%, жирова тканина – 10%
3) Зв’язана вода (4-5%) перебуває у зв’язках з йонами та речовинами. Вільна вода (95-96%) є універсальним розчинником
4) Вода має унікальні фізичні та хімічні властивості, які визначають її надзвичайно важливу роль в існуванні біологічних систем. Без води життя неможливе
|
Властивості води (молекулярна формула: Н₂О, Mr = 18) |
|
|
Фізичні |
Хімічні |
|
1. Може перебувати в трьох агрегатних станах: рідкому, твердому (крига) та газоподібному (пара) 2. Висока теплоємність 3. Низька теплопровідність 4. Великий поверхневий натяг 5. Висока пружність 6. У рідкому стані – текучість 7. Густина – є максимальною за температури +4℃ і становить 1 г/см³. Зі зниженням температури густина зменшується 8. Температура кипіння: +100℃, замерзання: 0℃ 9. За н. у. немає запаху, кольору і смаку |
1. Амфотерність (проявляє і кислотні, і основні властивості) 2. Здатність взаємодіяти з великою кількістю речовин 3. Бере участь в реакціях гідролізу (розкладання) 4. Здатність дисоціювати на йони (Н₂О ⇋ Н⁺ + ОН⁻) |
5) Незважаючи на те, що молекула води є електронейтральною, заряд у ній розподілений нерівномірно – атом Оксигену заряджений негативно (2δ-), атоми Гідрогену заряджені позитивно (δ+). Тому вода – це диполь
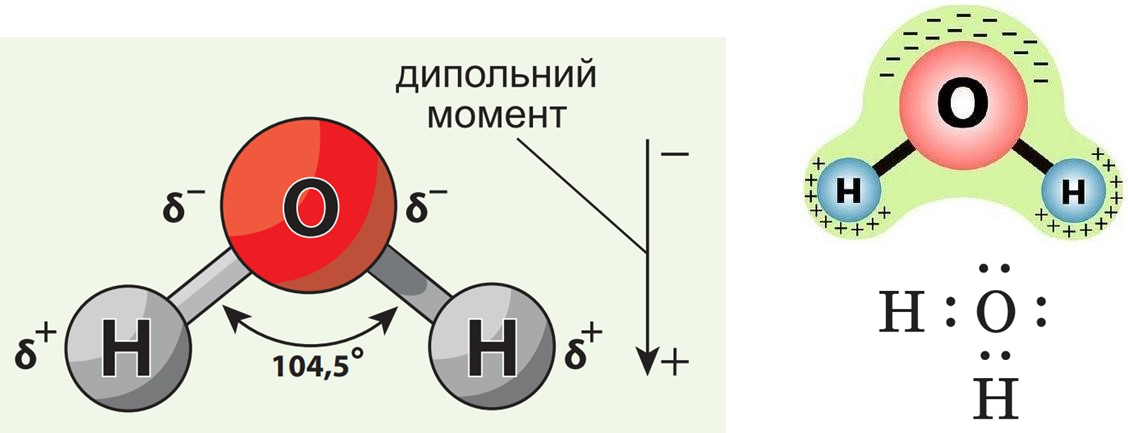
Електронна формула води
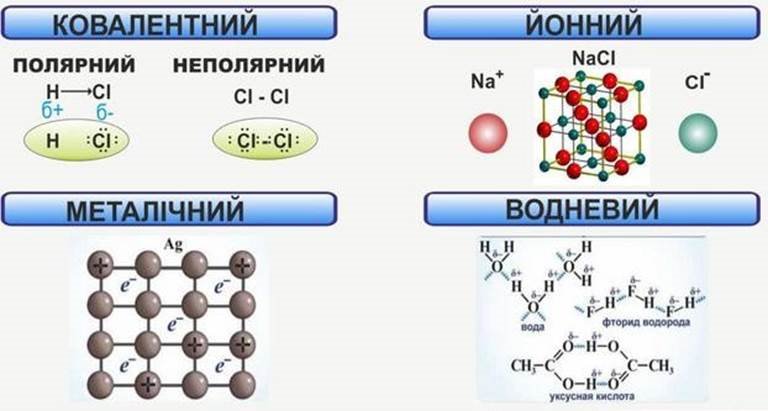
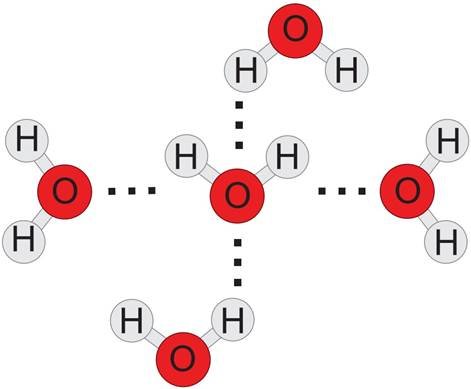
6) Водневі зв’язки – це зв’язки, що виникають між негативно зарядженим атомом
Оксигену однієї молекули та позитивно зарядженим атомом Гідрогену іншої молекули. Замість Оксигену може бути Нітроген, Флуор або Фосфор. Умовно водневий зв’язок позначають так: Н ![]() О. Водневий зв’язок значно слабший за ковалентний
О. Водневий зв’язок значно слабший за ковалентний
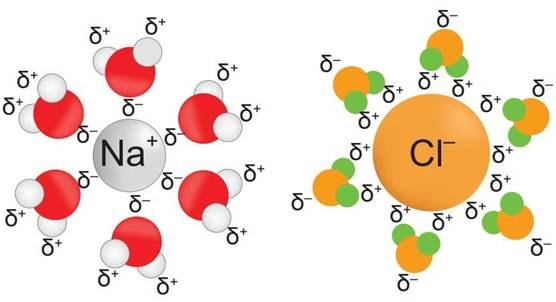
 Розташування молекул води навколо катіона і аніона
Розташування молекул води навколо катіона і аніона
Водневий зв’язок
|
Хімічні зв’язки |
|
|
|
Взаємозв’язок між фізико-хімічними властивостями і біологічною роллю води |
|
|
Біологічна роль води |
Фізико-хімічні властивості |
|
1. Універсальний розчинник |
Полярність молекул, здатність до гідратації (може приєднуватися до інших речовин) |
|
2. Реагент (бере участь у біохімічних реакціях) |
Амфотерність, окисно-відновні властивості, здатність дисоціювати на йони (розкладися на менші частинки; Н₂О ⇋ Н⁺ + ОН⁻) |
|
3. Терморегуляторна функція (забезпечує рівномірний розподіл тепла і терморегуляцію) |
Висока питома теплоємність і питома теплота випаровування |
|
4. Механічна функція (забезпечує пружний стан клітини – тургор) |
У рідкому стані – текучість і нестискуваність |
|
Взаємозв’язок між фізико-хімічними властивостями і біологічною роллю води |
|
|
Біологічна роль води |
Фізико-хімічні властивості |
|
5. Транспортна функція (переміщення пилку і гамет; утворює рідини внутрішнього середовища – кров, лімфу, міжклітинну речовину) |
Великий поверхневий натяг, у рідкому стані – текучість |
|
6. Захисна функція (входить до складу ферментів, вітамінів, слизу, змащувальних речовин) |
Великий поверхневий натяг, висока пружність, у рідкому стані – текучість |
|
7. Середовище існування (багато організмів мешкає у водному середовищі та пристосовані до нього) |
За нормальних умов – відсутність смаку, запаху та кольору, температура кипіння: +100℃, температура замерзання: 0℃ |
7) 
Гідрофільні сполуки – це полярні речовини, які здатні добре розчинятися у воді. До них належать моно- і дисахариди, амінокислоти, нуклеїнові кислоти, кристалічні солі тощо
8) Гідрофобні сполуки – це неполярні речовини, які не можуть розчинятися у воді. До них можна віднести нерозчинні мінеральні солі, ліпіди, полісахариди, деякі білки тощо
Заняття №2. Органічні речовини. Біополімери. Вуглеводи. Ліпіди
1. Біополімери: поняття про їхню будову та конформацію
1) Біополімери (макромолекули) – це високомолекулярні органічні сполуки, що входять до складу біологічних систем, виконують специфічні функції та складаються з великої кількості мономерів. Біополімери становлять близько 25% маси клітини
2) Малі молекули – це органічні сполуки, що мають відносно невелику молекулярну масу, містять у своєму складі, зазвичай, до 30 атомів Карбону та функціональну групу (СООН – карбоксильну, ОН – гідроксильну, NH₂ – аміногрупу, CОН – альдегідну тощо). Малі молекули становлять до 5% маси клітини. До них можна віднести БАР (вітаміни, гормони, ферменти, нейромедіатори), енергетичні молекули (АТФ, ГТФ) та мономери
3) Мономери – це малі молекули, що є ланками в ланцюгах біополімерів
Мономерами полісахаридів є моносахариди,
ліпідів – жирні кислоти і спирти, білків – амінокислоти, нуклеїнових кислот – нуклеотиди Органічні речовини в біологічних системах
Малі молекули Біополімери
 (макромолекули) Мономери активні речовиниБіологічно Енергетичні молекули
(макромолекули) Мономери активні речовиниБіологічно Енергетичні молекули
1. Вуглеводи 1. Моносахариди Гормони АТФ (аденозин-
трифосфорна
2. Ліпіди 2. Жирні кислоти і спирти Вітаміни кислота)
3. Білки 3. Амінокислоти Ферменти АДФ, ГТФ та
інші вільні
4. Нуклеїнові кислоти 4. Нуклеотиди Нейромедіатори нуклеотиди
|
Мономер |
Мономер |
Мономер |
Мономер |
Мономер |
Мономер |
Мономер |
Мономер |
Схематична будова біополімера
4) Біополімери утворюються під час реакцій полімеризації та матричного синтезу з мономерів, які поєднуються різними хімічними зв’язками. Розпад біополімерів відбувається завдяки руйнуванню зв’язків між мономерами, яке відбувається в ході реакцій гідролізу
Водневі зв’язки – це зв’язки, що виникають між негативно зарядженим атомом (Оксигеном, Нітрогеном, Флуором чи Фосфором) однієї молекули та позитивно зарядженим атомом Гідрогену іншої молекули
Йонні зв’язки – це зв’язки, що виникають між позитивно і негативно зарядженими йонами
Гідрофобні взаємодії – це неполярні взаємодії між групами макромолекул, які не несуть електричного заряду і не розчиняються у воді. Їх зближення зумовлено характером взаємодії гідрофобних груп (CH₃ – алкільної і С₂Н₅ – етильної) з водою. Гідрофобні взаємодії є слабшими за водневі та йонні зв’язки, проте завдяки ним виникають складні структури біополімерів
Макроергічні зв’язки – це зв’язки, багаті на енергію, що містяться в макроергічних сполуках
(макроергах) – АТФ, АДФ (аденозиндифосфатна к-та), ГТФ тощо. Позначаються знаком ![]() (тильда)
(тильда)
5) Конформація (просторова організація) – це певне розташування макромолекул в просторі, яке досягається завдяки специфічній взаємодії між їхніми окремими ділянками
|
Види конформації біополімерів |
|
|
Лінійні біополімери |
Розгалужені біополімери |
|
білки, нуклеїнові кислоти, целюлоза |
глікоген |
|
|
|
2. Вуглеводи
1) Вуглеводи – це органічні сполуки, до складу яких входять атоми Карбону, Гідрогену та
Оксигену. Вміст вуглеводів у тваринних клітинах є значно меншим (1-5%), ніж в рослинних (70-90%), оскільки рослини є автотрофними організмами
|
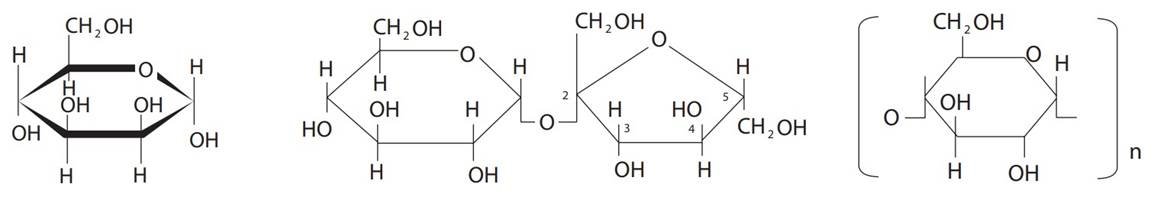
|
Структурні формула деяких вуглеводів |
|
|
Глюкоза |
Сахароза |
Крохмаль |
|
|
|
|
|
Вуглеводи |
|
|
|
Прості |
Складні |
|
|
Моносахариди |
Олігосахариди (дисахариди) |
Полісахариди |
|
СₙН₂ₙОₙ |
С12H22O11 |
(С₆Н₁₀О₅)ₙ |
|
• Містять від 3 до 10 атомів Карбону • Залежно від кількості атомів Карбону поділяються на триози, тетрози, пентози, гексози тощо |
• Містять від 2 до 10 залишків моносахаридів, що з’єднані глікозидним зв’язком |
• Складаються з великої кількості залишків моносахаридів |
|
• Пентози (С₅Н₁₀О₅) 1. Рибоза 2. Дезоксирибоза • Гексози (С₆Н₁₂О₆) 1. Глюкоза 2. Фруктоза |
• Сахароза – буряковий цукор (глюкоза + фруктоза + глікозидний зв’язок) • Лактоза – молочний цукор (глюкоза + галактоза + глікозидний зв’язок) |
• Крохмаль • Целюлоза (клітковина) • Хітин (до його складу входить ще Нітроген) • Глікоген |
2) Моносахариди і олігосахариди – мають приємний солодкий смак, добре розчиняються у воді та кристалізуються. Полісахариди – несолодкі, не здатні до кристалізації, можуть бути гідрофобними (целюлоза) та гідрофільними (глікоген)
3) Складні вуглеводи (оліго- і полісахариди) здатні взаємодіяти з іншими органічними сполуками – білками та ліпідами з утворенням комплексів (глікопротеїни, гліколіпіди)
4) Вуглеводи здатні до кисневого та безкисневого розщеплення, яке супроводжується утворенням АТФ. Продуктами повного їх розщеплення є вуглекислий газ та вода
5) Полісахариди поділяються на дві групи:
• Гомополісахариди (утворені залишками одного виду мономерів)
• Гетерополісахариди (утворені залишками кількох видів мономерів і їх похідними)
|
Функції вуглеводів |
|
|
1. Структурна та захисна функція |
Рибоза бере участь в утворенні РНК, дезоксирибоза – в утворенні ДНК. Целюлоза є основою клітинної стінки рослинної клітини, з хітину побудований екзоскелет членистоногих та клітинна стінка грибної клітини |
|
2. Енергетична функція |
Глюкоза та фруктоза є основним джерелом енергії. При окисненні одного граму глюкози утворюється 17,6 кДж енергії (1 г = 17,6 кДж енергії) |
|
3. Резервна функція |
Крохмаль є резервним полісахаридом рослин, глікоген – резервний полісахарид тварин і грибів |
|
4. Поживна функція |
Лактоза входить до складу молока ссавців, яким харчуються малята |
3. Ліпіди
1) Ліпіди – це гідрофобні (нерозчинні у воді) неполярні органічні сполуки, що мають різний хімічний склад. Ліпіди розчиняються лише в неполярних розчинниках, наприклад, хлороформі, ацетоні, ефірі, бензені. Вміст ліпідів в клітині складає 5-15%
2) До складу усіх ліпідів входять жирні кислоти та спирти
Жирні кислоти – це карбонові кислоти, що входять до складу ліпідів. Вони містять від 4 до 24 атомів Карбону (зазвичай кількість атомів парна) та є одноосновними (мають лише одну карбоксильну групу СООН). Розрізняють насичені (не мають подвійних зв’язків) та ненасичені (мають один або кілька подвійних зв’язків) жирні кислоти
|
|
Жирні кислоти |
|
|
Види |
Насичені |
Ненасичені |
|
Загальна формула |
CₙH₂ₙ₊₁СООН |
CₙH₂ₙ₋₁СООН |
|
Характеристика |
Не мають подвійних зв’язків (=) |
Мають подвійні зв’язки |
|
Деякі представники |
Масляна, пальмітинова, стеаринова |
Ліноленова, лінолева, олеїнова |

Структурна формула пальмітинової кислоти (С₁₅Н₃₁СООН) Карбоксильна група
 *На кутах розташовуються атоми Карбону
*На кутах розташовуються атоми Карбону
Структурна формула олеїнової кислоти (С₁₇Н₃₃СООН)
3) Молекули ліпідів можуть містити залишки сульфітної або ортофосфатної кислоти.
Ліпіди здатні взаємодіяти з вуглеводами і білками з утворенням складних комплексів
(гліколіпіди, ліпопротеїни, що є складовими клітинних мембран)
|
|
Ліпіди |
|
|||
|
Прості |
Складні |
Жироподібні речовини (ліпоїди) |
|||
|
Жири |
Воски |
Фосфоліпіди |
Гліколіпіди |
Жиророзчинні вітаміни (K, E, D, A) |
Стероїди |
|
• Тваринні |
• Тваринні |
||||
|
• Рослинні |
• Рослинні |
||||
Жири (ацилгліцероли) – це гідрофобні сполуки, до складу яких входять жирні кислоти і триатомний спирт гліцерол (гліцерин). Розрізняють рослинні (складаються переважно з ненасичених жирних кислот та здебільшого мають рідкий агрегатний стан) і тваринні (складаються переважно з насичених жирних кислот та здебільшого мають твердий агрегатний стан) жири. Утворення жирів відбувається завдяки реакції естерифікації

Рослинні жири (олії) Тваринні жири (сала)
Воски (цериди) – це гідрофобні сполуки, що складаються з жирних кислот та одноатомних спиртів. Воски, як і жири поділяються на рослинні (кутин, суберин) і тваринні (ланолін, бджолиний віск, спермацет)

Бджолиний віск Ланолін (виробляється шляхом
виварювання шерсті вівці)
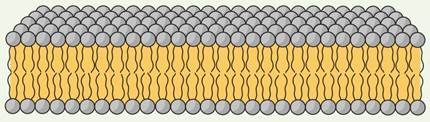
Складні ліпіди утворюються шляхом взаємодії з іншими сполуками – білками, вуглеводами, кислотами. Зазвичай вони входять до складу клітинних мембран
Фосфоліпіди складаються з жирних кислот, багатоатомних спиртів та залишків ортофосфатної кислоти.
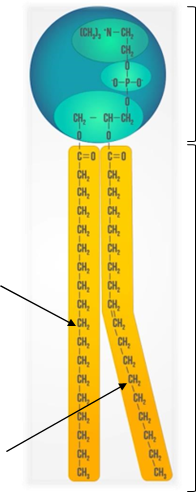
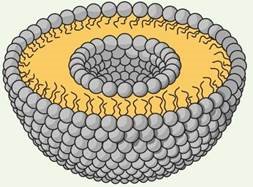
![]() Фосфоліпіди мають гідрофільну Гідрофільна головка головку і гідрофобні хвости, завдяки чому виявлять амфіфільні властивості
Фосфоліпіди мають гідрофільну Гідрофільна головка головку і гідрофобні хвости, завдяки чому виявлять амфіфільні властивості
Амфіфільні властивості
Насичена жирна кислота
Гідрофобні хвости
Ненасичена жирна кислота
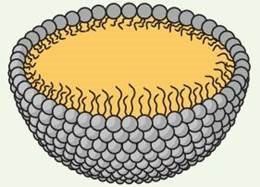
|
|
Структури, утворені з фосфоліпідів |
|
|
Міцела |
Ліпосома |
Біліпідний шар |
|
|
|
|
7) Стероїди – це гідрофобні речовини, що мають високу біологічну активність. До них належать холестерин, жовчні кислоти, стероїдні гормони: кортикостероїди і статеві гормони (чоловічі – андрогени, жіночі – естрогени) тощо
|
Функції ліпідів |
|
|
1. Структурна і захисна |
Складні ліпіди (фосфоліпіди, гліколіпіди, ліпопротеїни) входять до складу клітинних мембран. В організмах тварин жири є основою підшкірно-жирової клітковини та оточують внутрішні органи |
|
2. Енергетична |
При окисненні одного граму жира вивільнюється 38,9 кДж енергії (1 г = 38,9 кДж енергії) |
|
3. Резервна |
Жири можуть накопичуватися у клітині та використовуватися в подальшому як джерело енергії |
|
4. Регуляторна |
Стероїдні гормони здійснюють регуляцію фізіологічних процесів |
|
5. Водоутворювальна |
При окиснені одного граму жира утворюється 1,1 г води (1 г = 1,1 г води), тобто жири є джерелом метаболічної води |
|
6. Теплоізоляційна |
Жири мають погану теплопровідність, через що запобігають втраті тепла та відіграють роль у процесах терморегуляції |
Заняття №3. Білки. Ферменти
1. Особливості будови білків
1) Білки – це високомолекулярні нітрогенвмісні органічні сполуки, мономерами яких є амінокислоти
2) Амінокислоти – це малі молекули, які складаються з радикала, аміногрупи (NH₂) і карбоксильної групи (СООН). Кожна амінокислота має унікальний радикал, що відрізняє її від інших. Під час взаємодії аміногрупи однієї амінокислоти з карбоксильною групою іншої утворюється пептидний зв’язок
Карбоксильна група
3) 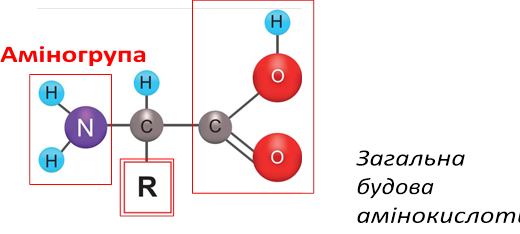 До складу білків входить 20 амінокислот, які розташовуються в певній послідовності
До складу білків входить 20 амінокислот, які розташовуються в певній послідовності
 Радикал
Радикал
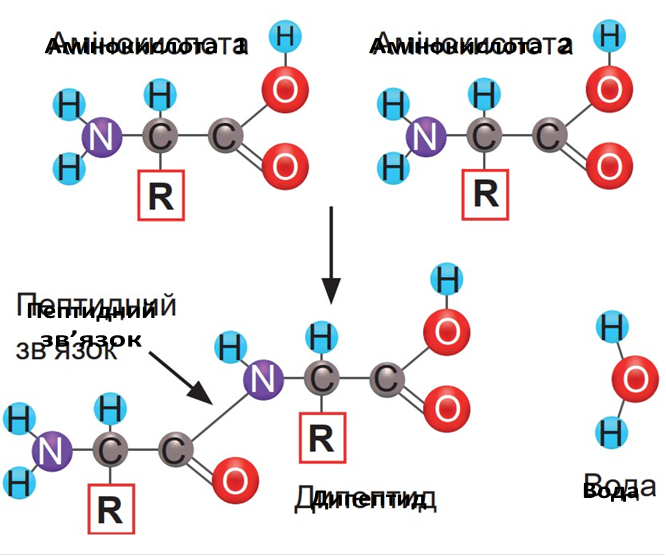
 Пептидний зв’язок
Пептидний зв’язок

2. Рівні структурної організації (конформації) білків. Класифікація білків
1) Білки мають чотири рівні структурної організації. Первинна структура є найпростішою, її мають усі білки. Четвертинна структура – найскладніша. Створення, стабілізація і підтримання певної структури забезпечується хімічними зв’язками
2) 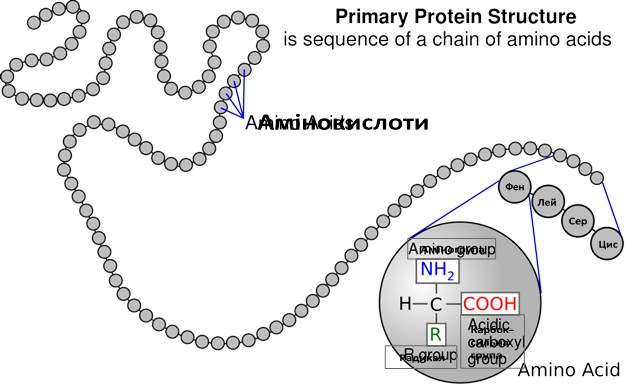 Первинна структура – амінокислоти, з’єднані між собою пептидними і дисульфідними зв’язками у ланцюг.
Первинна структура – амінокислоти, з’єднані між собою пептидними і дисульфідними зв’язками у ланцюг.
Кодується відповідним геном
3) Вторинна структура – має форму спіралі (α-спіраль) або складчастого листка (β-структура). α-Спіраль утворюється при скручуванні поліпептидного ланцюга. β-Структура складається із зигзагоподібно розгорнутих поліпептидних ланцюгів, що розташовані поряд. Вторинна структура білка забезпечується здебільшого водневими зв’язками
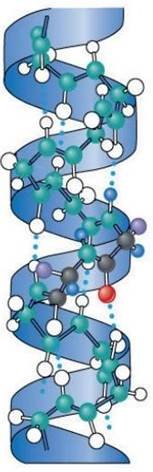
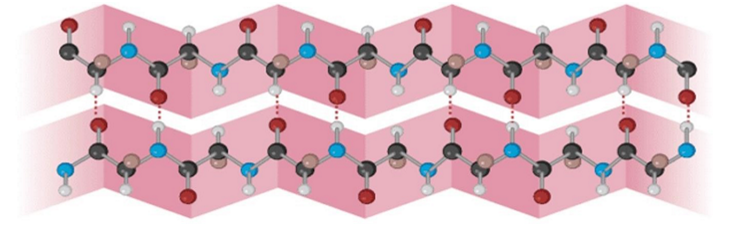 β-Структура
β-Структура
α-Спіраль
4) Третинна структура (глобула) – укладання в тривимірному просторі вторинної структури. В утворенні та стабілізації третинної структури беруть участь дисульфідні, водневі та йонні
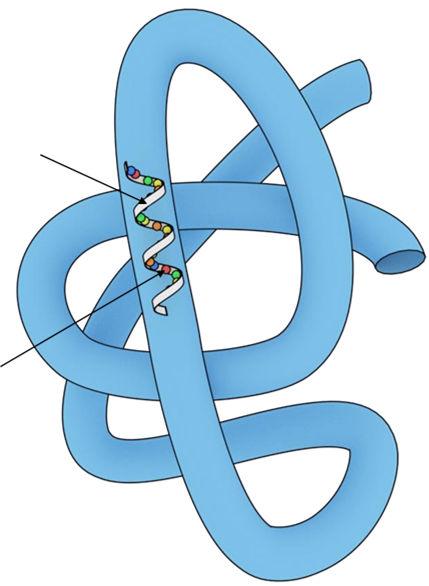 зв’язки, гідрофобні взаємодії α-Спіраль
зв’язки, гідрофобні взаємодії α-Спіраль
Амінокислота
5) Четвертинна структура – об’єднання кількох поліпептидних ланцюгів з утворенням єдиного білкового комплексу. В утворенні та стабілізації четвертинної структури беруть участь дисульфідні, водневі та йонні зв’язки, гідрофобні взаємодії
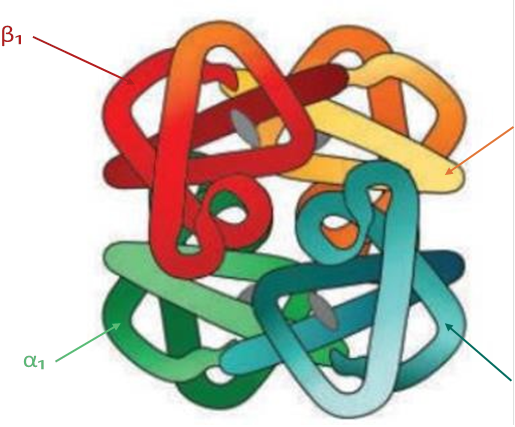 β₂
β₂
Молекула гемоглобіну складається з чотирьох субодиниць (поліпептидних ланцюгів) – двох α і двох β
α₂
|
Білки |
|||
|
За будовою |
За хімічним складом |
||
|
Глобулярні |
Фібрилярні |
Прості |
Складні |
|
• Мають третинну або четвертинну структуру, еліпсоподібну або кулясту форму • Розчинні у воді • Легко утворюють колоїдні суспензії • Ферменти, антитіла, білкові гормони, гемоглобін |
• Мають вторинну структуру та видовжену форму • Утворюють волокна (фібрили) • Нерозчинні у воді • Колаген, міозин, кератин |
• Складаються лише з амінокислот • Альбуміни, глобуліни, гістони |
• До складу, крім амінокислот, входить небілковий компонент – залишок іншої сполуки • Глікопротеїни (вуглевод) • Нуклеопротеїни (нуклеїнові кислоти) • Фосфопротеїни (ортофосфатна кислота) • Ліпопротеїни (ліпіди) |
3. Денатурація. Ренатурація. Деструкція
1) Денатурація – це процес руйнування усіх структур білка, крім первинної під дією певного агресивного чинника. До таких чинників можна віднести високі температури, вплив кислот, лугів, важких металів, йонізуючого і ультрафіолетового випромінювання. Внаслідок денатурації білок втрачає свою природну структуру, і відповідно, не може далі виконувати свої біологічні функції
2) Ренатурація – це відновлення природної структури і функцій білка, що відбувається за умови нетривалої дії агресивного чинника та збереження первинної структури
3) Деструкція – це руйнування усіх структур білка, включно з первинною.
На відмінну від денатурації є необоротним процесом
|
Денатурація і Ренатурація |
|
Білок → Вплив агресивного чинника → Денатурація → Руйнування усіх структур, крім первинної → Первинна структура → Припинення дії агресивного фактора → Ренатурація → Відновлення природної структури → Білок |
4. Ферменти – біологічно активні речовини
1) Ферменти (ензими) – це біологічно активні речовини, зазвичай білкової природи, які відіграють роль каталізаторів біохімічних реакцій. Ферментами також можуть бути молекули РНК – їх називають рибозимами
2) Усі ферменти складаються з активного центру, до якого приєднується молекула субстрату. Деякі містять ще алостеричний центр – він регулює активність фермента, знижуючи або підвищуючи її, та змінює його конформацію
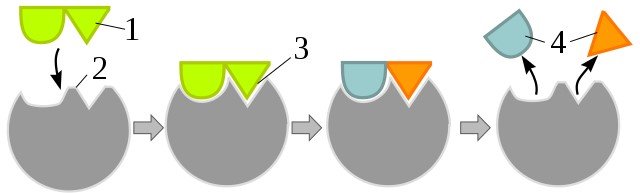
![]() Принцип дії фермента. 1 – речовина АВ – субстрат, 2 – активний (субстратний) центр фермента, 3 – фермент і субстрат підходять один до одного, як ключ до замка (гіпотеза ключ-замок, 1890 р., Еміль Фішер), 4 – речовина АВ розщепилася на дві окремі – А і В
Принцип дії фермента. 1 – речовина АВ – субстрат, 2 – активний (субстратний) центр фермента, 3 – фермент і субстрат підходять один до одного, як ключ до замка (гіпотеза ключ-замок, 1890 р., Еміль Фішер), 4 – речовина АВ розщепилася на дві окремі – А і В 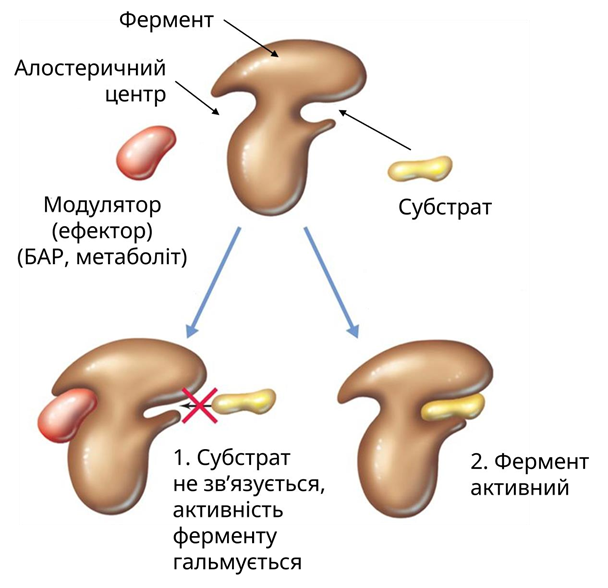 комплекс 3) Властивості ферментів:
комплекс 3) Властивості ферментів:
1. ![]() Висока біологічна активність – на велику кількість субстрату використовується мала кількість ферментів. Суттєво прискорюють біохімічні реакції в клітинах
Висока біологічна активність – на велику кількість субстрату використовується мала кількість ферментів. Суттєво прискорюють біохімічні реакції в клітинах
2. Ферменти ніколи не входять до складу кінцевих продуктів
3. Специфічність – кожний клас ферментів каталізує свій тип реакцій
4. Активність ферментів напряму залежить від умов середовища – температури
|
(оптимальна: +37…+40°С; є термолабільними), тиску, рН, концентрації субстрату і ферментів 5. Невитратність – прискорюють біохімічні реакції і при цьому не витрачаються |
Ферменти є глобулярними білками, відповідно, мають третинну або четвертинну структуру |
|
Класифікація ферментів |
|
|
За хімічним складом |
За типом реакції, що каталізують |
|
Прості (однокомпонентні) |
1 клас: Оксиредуктази – каталізують окисно-відновні реакції |
|
2 клас: Трансферази – каталізують реакції перенесення хімічних груп між молекулами |
|
|
3 клас: Гідролази – каталізують реакції гідролізу (розкладання речовин під дією води) |
|
|
Складні (двокомпонентні) |
4 клас: Ліази – каталізують реакції розщеплення зв’язків між атомами Карбону, Нітрогену, Оксигену і Сульфуру негідролітичним шляхом |
|
5 клас: Ізомерази – каталізують реакції ізомеризації субстратів |
|
|
6 клас: Лігази (Синтетази) – каталізують реакції синтезу біомолекул |
|
|
Метаболізм (обмін речовин)
|
4) Прості ферменти складаються лише з амінокислот, тому називаються однокомпонентними.
До них можна віднести амілази, ліпази та протеази, що є представниками класу гідролаз
Складні ферменти складаються з білкової (апофермента) та небілкової (кофактора) частини, тобто є двокомпонентними. Активним центром складного фермента є кофактор
|
Складні ферменти (холоферменти) |
|
|
Білкова частина (амінокислоти) апофермент |
Небілкова частина (коферменти, простетичні групи, йони металів) кофактор |
1. Кофермент (коензим) – це молекула небілкової природи, яка вільно зв’язується з ферментом нековалентними зв’язками та впливає на його каталітичну активність. Більшість коферментів є вітамінами або їх похідними
2. Простетична група – це молекула небілкової природи, яка міцно зв’язана з білковою частиною ферменту ковалентними зв’язками та не може бути відділена від неї
3. Йони металів – K⁺, Fe²⁺, Cu²⁺, Mg²⁺, Ca²⁺ та інші
|
Основні функції білків |
|
|
1. Структурна |
Білки утворюють велику кількість структур (ліпопротеїни і глікопротеїни входять до складу клітинних мембран, колаген є складовою хрящової тканини, з кератину складаються нігті, волосся, пір’я, з еластину – зв’язки |
|
2. Каталітична |
Ферменти відіграють роль каталізаторів біохімічних реакцій |
|
3. Транспортна |
У хребетних тварин гемоглобін входить до складу еритроцитів, транспортує кисень та вуглекислий газ. Гемоціанін забезпечує транспорт кисню у молюсків та деяких членистоногих |
|
4. Рухова |
|
|
Основні функції білків |
|
|
5. Енергетична |
При розщеплені одного граму білка утворюється 17,2 кДж енергії (1 г = 17,2 кДж енергії) |
|
6. Регуляторна |
Багато гормонів мають білково-пептидну природу, наприклад, інсулін, глюкагон, вазопресин, соматотропін, пролактин |
|
7. Захисна |
Антитіла утворюються у відповідь на вплив антигенів (будь-яких чужорідних тіл і речовин). Фібрин забезпечує утворення тромбу, який перешкоджає крововтраті |
|
8. Сигнальна |
Родопсин входить до складу паличок ока, що забезпечують сутінковий зір. Йодопсин входить до складу колбочок ока, які забезпечують колірний зір |
Заняття №4. Нуклеїнові кислоти. АТФ
 1. Особливості будови нуклеїнових кислот
1. Особливості будови нуклеїнових кислот
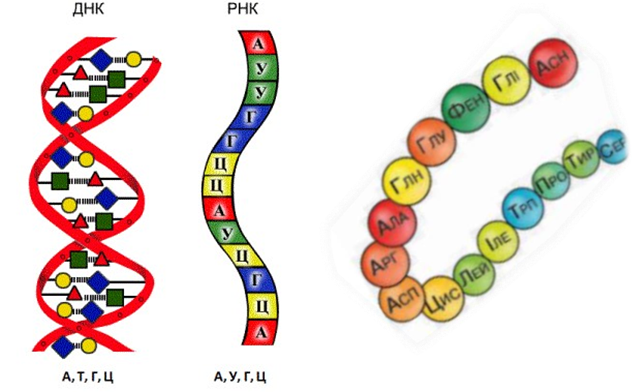
1) Нуклеїнові кислоти – це високомолекулярні органічні сполуки, мономерами яких є нуклеотиди
|
Нуклеїнові кислоти |
|
|
Дезоксирибонуклеїнова кислота (ДНК) |
Рибонуклеїнова кислота (РНК) |
|
|
|
2) Нуклеотиди – це трикомпонентні органічні сполуки, молекули яких побудовані з нітратної
(азотистої) основи, моносахариду пентози та залишків ортофосфатної кислоти (Н₃РО₄)
|
Нітратні (нітрогенвмісні) основи |
|
|
Пуринові Аденін (А), Гуанін (Г) |
Піримідинові Цитозин (Ц), Тимін (Т), Урацил (У) |
![]()
![]() Будова ДНК:
Будова ДНК:
1. Нітратні основи:
• Аденін
• Тимін
• Гуанін
• Цитозин
2. Дезоксирибоза
3. Залишок ортофосфатної кислотиБудова РНК:
1. Нітратні основи:
• Аденін
• Урацил
• Гуанін
• Цитозин
2. Рибоза
3. Залишок ортофосфатної кислоти
NB! До складу ДНК ніколи не входить урацил, до складу РНК – тимін
|
Нуклеотиди: Аденін + пентоза + залишок ортофосфатної кислоти = аденіловий нуклеотид Тимін + пентоза + залишок ортофосфатної кислоти = тимідиловий нуклеотид Гуанін + пентоза + залишок ортофосфатної кислоти = гуаніловий нуклеотид Цитозин + пентоза + залишок ортофосфатної кислоти = цитидиловий нуклеотид Урацил + пентоза + залишок ортофосфатної кислоти = уридиловий нуклеотид 1 нуклеотид = 1 залишок пентози |
![]()
![]() 3) Нуклеотиди добре розчиняються у воді, виявляють одночасно кислотні (завдяки ортофосфатній кислоті) та основні (завдяки нітратним основам) властивості
3) Нуклеотиди добре розчиняються у воді, виявляють одночасно кислотні (завдяки ортофосфатній кислоті) та основні (завдяки нітратним основам) властивості
Узагальнена будова нуклеотиду
2. Дезоксирибонуклеїнова кислота (ДНК)
1) Просторова структура ДНК була описана Френсісом Кріком та Джеймсом Уотсоном у 1953 році. ДНК є дволанцюговою молекулою, що має вигляд правозакрученої спіралі. Відстань між нуклеотидами становить 0,34 нм, крок спіралі – 3,4 нм, її діаметр – 2 мм
 2) Нуклеїнові кислоти мають три рівні структурної організації
2) Нуклеїнові кислоти мають три рівні структурної організації
• Первинна структура ДНК представлена певною послідовністю нуклеотидів у двох ланцюгах. Залишки дезоксирибози і ортофосфатної кислоти розташовані на периферії двох ланцюгів, а нітратні основи – усередині
• Вторинна структура ДНК – утворення правозакрученої спіралі, що має сталі характеристики. Стабілізується водневими зв’язками між нуклеотидами
• Третинна структура ДНК – сильна спіралізація вторинної структури та її намотування на білки-гістони, утворення суперспіралі. В результаті цього процесу виникають хромосоми. Забезпечується компактизація спадкового матеріалу
![]() ДНК
ДНК
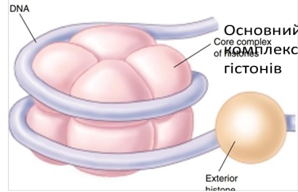 Зовнішній гістон
Зовнішній гістон
Процес утворення суперспіралі 3) Принцип комплементарності (Правило Чаргафа):
А = Т
Г = Ц
А + Т = Г + Ц Кількість аденілових нуклеотидів дорівнює кількості тимідилових
Кількість гуанілових нуклеотидів дорівнює кількості цитидилових
Між аденіловими і тимідиловими нуклеотидами виникає 2 водневих зв’язки (А = Т) Між гуаніловими і цитидиловими нуклеотидами виникає 3 водневих зв’язки (Г ![]() Ц) Приклад:
Ц) Приклад:
|
Ланцюг 1 |
АТТ – АГЦ – АГЦ – ТТТ –ТЦГ – ГАТ – ГАГ – ЦАЦ || || || || ||| ||| || ||| ||| || || || || ||| ||| ||| || || ||| || ||| ||| || ||| |
|
Ланцюг 2 |
ТАА – ТЦГ – ТЦГ – ААА – АГЦ –ЦТА – ЦАЦ –ГАГ |
Кількість водневих зв’язків = 6 + 8 + 8 + 6 + 8 + 7 + 8 + 8 = 59
![]() Фосфодиефірні зв’язки
Фосфодиефірні зв’язки
Фосфодиефірні зв’язки формують і стабілізують первинну структуру ДНК, водневі – вторинну і третинну
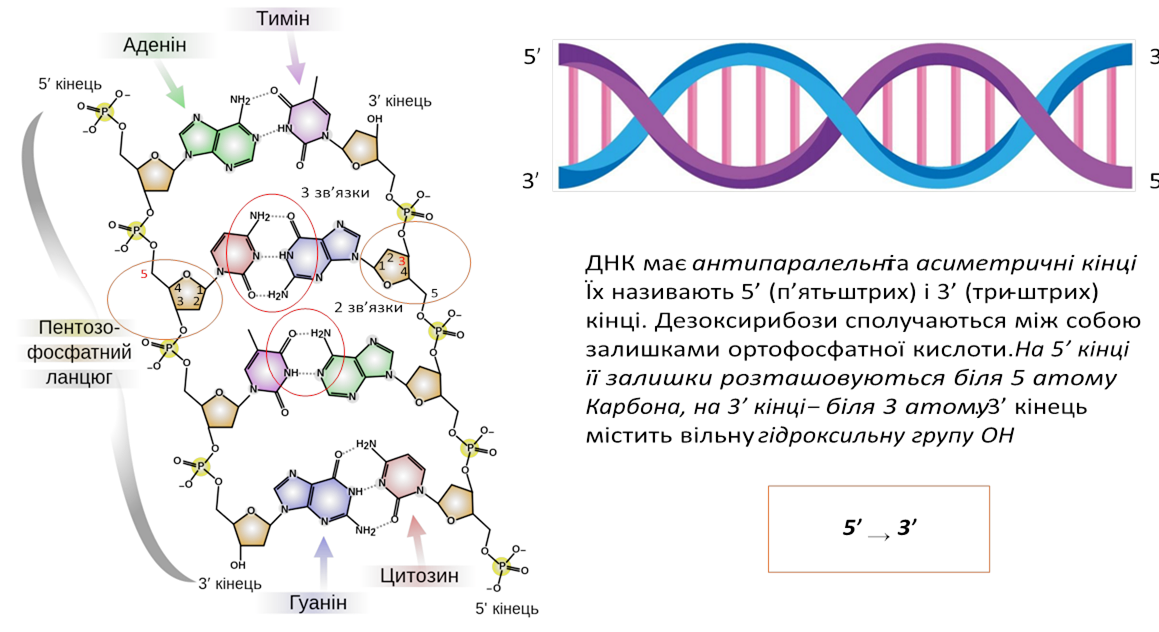
4) Властивості ДНК:
1. ![]() Реплікація – це процес самоподвоєння ДНК, який забезпечує точне копіювання спадкової інформації. Відбувається в три етапи – ініціація, елонгація, термінація
Реплікація – це процес самоподвоєння ДНК, який забезпечує точне копіювання спадкової інформації. Відбувається в три етапи – ініціація, елонгація, термінація
2. ![]() Репарація – це процес виявлення та виправлення пошкоджень ДНК 3. Денатурація
Репарація – це процес виявлення та виправлення пошкоджень ДНК 3. Денатурація
4. Ренатурація 5. Деструкція
6. Транскрипція – це один з етапів реалізації спадкової інформації, в ході якого відбувається синтез РНК на матриці ДНК за принципом комплементарності:
![]() А = У
А = У
Г = Ц
Приклад:
|
ДНК: |
АТТ – ЦГЦ – АТГ – ЦГЦ – АЦГ – ГАЦ – ЦАГ |
|
РНК: |
УАА – ГЦГ – УАЦ – ГЦГ – УГЦ – ЦУГ – ГУЦ |
3. Гени
1) ДНК забезпечує збереження, передачу та реалізацію спадкової інформації, тобто виконує інформаційну функцію
2) Ген – це ділянка молекули ДНК, яка кодує інформацію про первинну структуру білка або РНК. Ген є одиницею спадковості, що відповідає за формування певної ознаки
1. Ген займає певне місце в хромосомі – локус
2. Кожний ген має унікальну нуклеотидну послідовність
3. Розрізняють алельні (розташовуються в однакових локусах гомологічних хромосом, відповідають за формування різних станів однієї ознаки) та неалельні (розташовуються в різних локусах гомологічних хромосом або негомологічних хромосомах, відповідають за формування різних ознак) гени
4. Гени бувають структурними (кодують інформацію про первинну структуру білка або РНК) і регуляторними (спрямовують і регулюють діяльність структурних); конститутивними (постійно активні, ніколи не змінюють свою активність) та неконститутивними (активуються за потреби, постійно змінюють свою активність) 5. В еукаріотів гени мають мозаїчну будову: чергуються екзони (гени, що несуть певну інформацію) та інтрони (беззмістовні гени), що убезпечує спадкову інформацію від ушкодження
6. Генотип – сукупність усіх генів організму (є унікальним). Фенотип – сукупність усіх ознак організму. Геном – сукупність усієї спадкової інформації (притаманний певному виду) 7. Генам притаманні різні види взаємодії, які базуються на певних біохімічних механізмах
|
транскрипція трансляція ДНК |
|
Експресія генів – це процес використання інформації, закодованої в генах для синтезу функціональних продуктів – білків чи РНК. Складається з двох послідовних процесів: транскрипції і трансляції |
4. Рибонуклеїнова кислота (РНК)
1) РНК є одноланцюговою молекулою • Первинна структура РНК – • Вторинна і третинна структура РНК
послідовність нуклеотидів, що з’єднані виникає внаслідок компактизації первинної між собою фосфодиефірними зв’язками структури. З’являються ділянки, що мають
двоспіральну будову з дотриманням принципу
3’ комплементарності (А = У, Г = Ц)
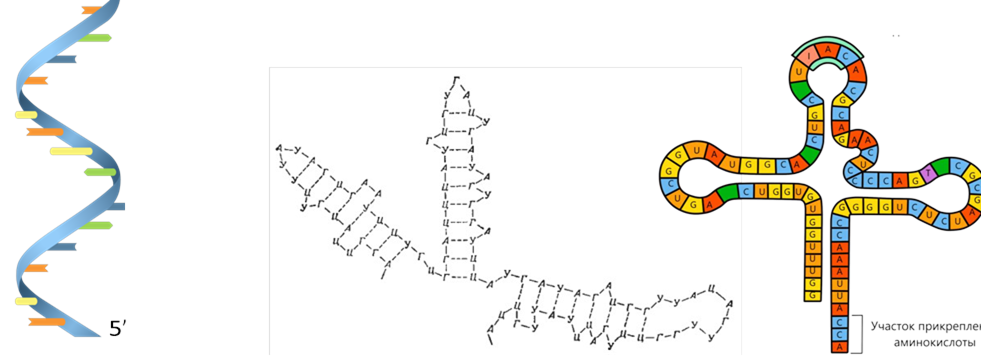
|
|
РНК |
|
|
матрична (мРНК) |
транспортна (тРНК) |
рибосомальна (рРНК) |
|
близько 5% |
близько 10% |
близько 85% |
|
• Інша назва: інформаційна РНК • Має великі розміри, складається з 300-30 000 нуклеотидів • Виконує інформаційну функцію – переносить інформацію про первинну структуру білка до рибосом |
• Має малі розміри, складається з 70-90 нуклеотидів • Виконує транспортну функцію – приєднує і переносить до рибосом амінокислоти, з яких в подальшому буде синтезуватися білок |
• Має великі розміри, складається з 3000-5000 нуклеотидів • Виконує структурну функцію – бере участь в утворенні рибосом |
![]()
![]()
![]()
5. Аденозинтрифосфатна кислота (АТФ). Роль АТФ в енергозабезпеченні
1) В живій природі існує велика кількість вільних нуклеотидів. Вони містять нітратну основу, пентозу та від одного до трьох залишків ортофосфатної кислоти. Серед вільних нуклеотидів найбільшого значення має АТФ
2) Аденозинтрифосфатна кислота (АТФ) – це органічна сполука, що належить до вільних нуклеотидів, складається з аденіну, рибози і трьох залишків ортофосфатної кислоти
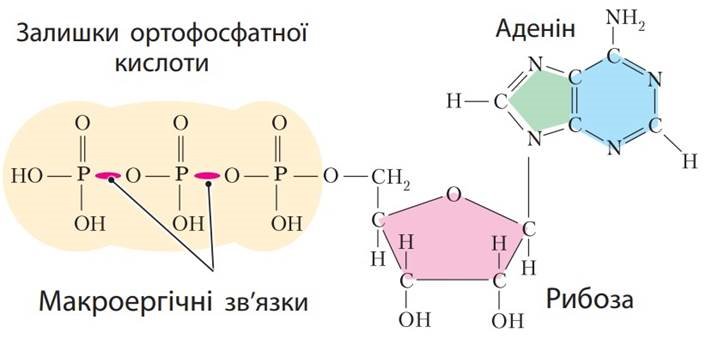
3) АТФ виконує енергетичну функцію – вона є хімічним акумулятором енергії в клітині. Саме АТФ забезпечує енергією більшість процесів життєдіяльності
4) В молекулі АТФ знаходиться два макроергічних зв’язки
• Під час гідролітичного відщеплення фосфатної групи від АТФ вивільняється
40 кДж енергії та утворюється АДФ (аденозиндифосфатна кислота)
• Якщо від молекули АТФ відщеплюється дві фосфатні групи вивільняється
80 кДж енергії і утворюється АМФ (аденозинмонофосфатна кислота)
5) АТФ утворюється за рахунок енергії, що виділяється під час окиснення речовин. У гетеротрофів цей процес відбувається в мітохондріях, в автотрофів – в мітохондріях і хлоропластах. Енергія акумулюється у макроергічних зв’язках. АМФ не містить таких зв’язків, АДФ – містить 1 макроергічний зв’язок, АТФ – 2 зв’язки
|
АМФ |
акумуляція 40 кДж енергії
вивільнення 80 кДж енергії |
~ АДФ |
акумуляція 80 кДж енергії
вивільнення 40 кДж енергії |
~~ АТФ |
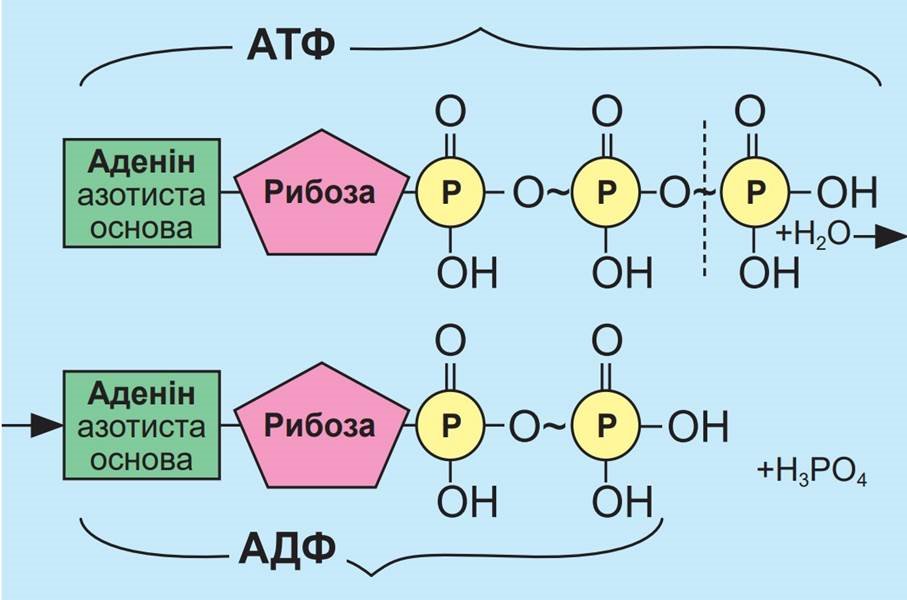
![]() Серед вільних нуклеотидів є макроергічні сполуки, тобто ті, що містять у своєму складі макроергічні (високоенергетичні) зв’язки та виконують енергетичну функцію. Це:
Серед вільних нуклеотидів є макроергічні сполуки, тобто ті, що містять у своєму складі макроергічні (високоенергетичні) зв’язки та виконують енергетичну функцію. Це:
• АТФ (2 зв’язки)
• АДФ (1 зв’язок)
• цАМФ
• ГТФ
• УТФ
Практикум
Розв’язування елементарних вправ і задач з молекулярної біології
1. Сталі величини, які необхідно пам’ятати
|
Білки Відносна молекулярна маса Mr білків вимірюється в Дальтонах (Да) або атомних одиницях маси (а. о. м.) Mr однієї амінокислоти = 100 Да або а. о. м. Довжина L білків вимірюється в нанометрах (нм) L однієї амінокислоти = 0,35 нм |
• Білки – це високомолекулярні нітрогенвмісні органічні сполуки, мономерами яких є амінокислоти
• Білки мають чотири рівні структурної організації. Первинна структура є найпростішою, її мають усі білки. Четвертинна структура – найскладніша
Практикум
Розв’язування елементарних вправ і задач з молекулярної біології
1. Сталі величини, які необхідно пам’ятати
|
Нуклеїнові кислоти Довжина одного нуклеотиду = 0,34 нм Молекулярна маса одного нуклеотиду = 345 а. о. м. ДНК Відстань між нуклеотидами = 0,34 нм. Крок спіралі = 3,4 нм. На один виток спіралі припадає 10 нуклеотидів. Діаметр спіралі = 2 мм |
|
Принцип комплементарності (Правило Чаргафа): ДНК: А = Т Г = Ц А + Т = Г + Ц З ДНК на РНК (транскрипція): А = У Г = Ц *В ДНК відсутня N-вмісна основа урацил *В РНК відсутня N-вмісна основа тимін |
• Нуклеїнові кислоти – це високомолекулярні органічні сполуки, мономерами яких є
нуклеотиди. Розрізняють дезоксирибонуклеїнову
(ДНК) та рибонуклеїнову (РНК) кислоту
Задача 1. Умова. Молекулярна маса ферменту пепсину 35 500 Да. Яка довжина первинної структури цього білка?
Визначаємо кількість амінокислот, що входять до складу білка:
𝑀𝑟 (білка)
𝑛 ![]() амінокислот =
амінокислот =
![]() 𝑀𝑟 (амінокислоти)
𝑀𝑟 (амінокислоти)
35 500 Да
![]()
![]() 𝑛
𝑛 ![]() амінокислот = = 355
амінокислот = = 355
100 Да
Знаючи довжину однієї амінокислоти, визначаємо довжину білка
![]()
![]() 𝐿 білка = 𝐿
𝐿 білка = 𝐿 ![]() амінокислоти
амінокислоти![]() ∙ 𝑛
∙ 𝑛 ![]() амінокислот
амінокислот![]()
𝐿білка= 355 ∙ 0,35 = 124,25 нм
Відповідь: L (пепсину) = 124,25 нм
Задача 2. Умова. Знайдіть молекулярну масу і довжину первинної структури білка лізоциму, якщо відомо, що до його складу входить 129 амінокислотних залишків
Визначаємо молекулярну масу білка, знаючи молекулярну масу однієї амінокислоти і кількість амінокислот, що входять до складу білка
![]()
![]() 𝑀𝑟 білка = 𝑛
𝑀𝑟 білка = 𝑛 ![]() амінокислот
амінокислот![]() ∙ 𝑀𝑟
∙ 𝑀𝑟 ![]() амінокислоти
амінокислоти![]()
![]() 𝑀𝑟білка= 129 ∙ 100 Да = 12 900 Да
𝑀𝑟білка= 129 ∙ 100 Да = 12 900 Да
Визначаємо довжину білка, знаючи кількість амінокислот, що входять до його складу та довжину однієї амінокислоти
![]()
![]() 𝐿 білка = 𝑛
𝐿 білка = 𝑛 ![]() амінокислот
амінокислот![]() ∙ 𝐿 (амінокислоти)
∙ 𝐿 (амінокислоти)
𝐿білка= 129 ∙ 0,35 нм = 45,15 нм
Відповідь: Mr (лізоциму) = 12 900 Да
L (лізоциму) = 45,15 нм
Задача 3. Умова. Молекулярна маса гемоглобіну дорівнює 68 660 Да. Всього до складу субодиниць гемоглобіну входить 602 амінокислоти. Визначте молекулярну масу гема
Гемоглобін – білок, який має четвертинну структуру.
До його складу входить білкова (глобін) та небілкова
(гем) частина. Гем містить йони Феруму (Fe²⁺) Визначаємо молекулярну масу білкової частини, маючи відповідні дані
![]()
![]()
![]() 𝑀𝑟 білкової частини = 𝑛
𝑀𝑟 білкової частини = 𝑛 ![]() амінокислот
амінокислот![]() ∙ 𝑀𝑟
∙ 𝑀𝑟 ![]() амінок − ти
амінок − ти![]()
𝑀𝑟білкової частини= 602 ∙ 100 = 60 220 Да
Знаходимо різницю. Це і є маса гему
![]()
![]() 𝑀𝑟 гема = 𝑀𝑟
𝑀𝑟 гема = 𝑀𝑟 ![]() білка
білка![]() − 𝑀𝑟 (білкової частини)
− 𝑀𝑟 (білкової частини)
𝑀𝑟гема= 68 660 − 60 220 = 8460 Да
Відповідь: Mr (гема) = 8460 Да
Задача 4. Умова. Гемоглобін крові людини містить 0,34% заліза. Вирахуйте мінімальну масу молекули гемоглобіну (молекулярну масу білка можна визначити за формулою: Ь = 100 ∙ а/b, де М – молекулярна маса білка, а – атомна або молекулярна маса компонентів, b – відсотковий склад компонента)
Гемоглобін – білок, який має четвертинну структуру.
До його складу входить білкова (глобін) та небілкова
(гем) частина. Гем містить йони Феруму (Fe²⁺)
![]() Застосовуємо формулу, що зазначена в умові задачі
Застосовуємо формулу, що зазначена в умові задачі
![]() 𝑎 ∙ 100
𝑎 ∙ 100
𝑀𝑟 ![]() білка
білка
𝑏
𝑀𝑟 ![]() білка
білка![]()
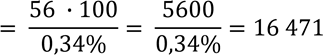 Да
Да
Відповідь: мінімальна маса гемоглобіну = 16471 Да
Задача 5. Умова. Карбоангідраза – це фермент, за допомогою якого відбувається утворення вуглекислого газу в процесах тканинного дихання. Молекули фермента містять 0,23% цинку. Визначте молекулярну масу карбоангідрази
Застосовуємо формулу з попередньої задачі
![]() 𝑎 ∙ 100
𝑎 ∙ 100
𝑀𝑟 ![]() білка
білка
![]() 𝑏
𝑏
𝑀𝑟 ![]() білка
білка![]()
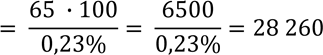 Да
Да
Відповідь: молекулярна маса ферменту карбоангідрази = 28 260 Да
Задача 6. Умова. Родопсин (зоровий пігмент сітківки ока) складається з білкової частини опсину і небілкової ліпідної частини ретиналю (вітамін А). Визначте молекулярну масу ретиналю, якщо відомо, що молекулярна маса родопсину – 32 414 Да, а довжина первинної структури молекули опсину становить 102,2 нм
Родопсин складається з білкової і небілкової частини. Щоб визначити молекулярну масу ретиналю, необхідно знайти молекулярну масу опсину і вирахувати різницю. В умові надано довжину амінокислот, тобто білкової частини. Знаходимо кількість амінокислот, що утворюють родопсин
𝐿 (амінокислот)
𝑛 ![]() амінокислот =
амінокислот =
![]() 𝐿 (однієї амінокислоти)
𝐿 (однієї амінокислоти)
![]() 102,2 нм
102,2 нм
![]() 𝑛
𝑛 ![]() амінокислот = = 292
амінокислот = = 292
0,35 нм)
Тепер можна визначити молекулярну масу опсину. Кількість амінокислот множимо на молекулярну масу однієї кислоти
![]()
![]() 𝑀𝑟 білкової частини = 𝑛
𝑀𝑟 білкової частини = 𝑛 ![]() амінокислот
амінокислот![]() ∙ 𝑀𝑟
∙ 𝑀𝑟 ![]() однієї амінокислоти
однієї амінокислоти![]()
𝑀𝑟білкової частини= 292 ∙ 100 Да = 29 200 Да
Рахуємо різницю. Це і є молекулярна маса ретиналю
![]()
![]() 𝑀𝑟 небілкової частини = 𝑀𝑟
𝑀𝑟 небілкової частини = 𝑀𝑟 ![]() білка
білка![]() − 𝑀𝑟
− 𝑀𝑟 ![]() білкової частини
білкової частини![]()
𝑀𝑟небілкової частини= 29 200 Да − 32 414 Да = 3214 Да
Задача 7. Умова. У фрагментів одного ланцюга молекули ДНК нуклеотиди розміщені у такій послідовності: ТТГ-АГЦ-АЦГ-ГТА-ААТ-ЦГА. Побудуйте схему дволанцюгової ДНК. Визначте довжину і масу цього фрагменту За принципом комплементарності:
ДНК: Ланцюг 1 ТТГ – АГЦ – АЦГ – ГТА – ААТ – ЦГА
Ланцюг 2 ААЦ – ТЦГ – ТГЦ – ЦАТ – ТТА – ГЦТ
Визначаємо довжину фрагмента. Потрібно пам’ятати, що ДНК – це дволанцюгова молекула, тому загальну кількість нуклеотидів завжди треба ділити на 2
![]() 𝑛 нуклеотидів
𝑛 нуклеотидів
![]() 𝐿
𝐿 ![]() ДНК = ∙ L одного нуклеотиду
ДНК = ∙ L одного нуклеотиду![]() 𝐿
𝐿 ![]() ДНК
ДНК![]() нм
нм
2
Для визначення молекулярної маси фрагменту ДНК необхідно загальну кількість нуклеотидів помножити на молекулярну масу одного нуклеотиду
𝑀𝑟 ![]() ДНК
ДНК![]() = 𝑛
= 𝑛 ![]() нуклеотидів
нуклеотидів![]() ∙ 𝑀𝑟
∙ 𝑀𝑟 ![]() одного нуклеотиду
одного нуклеотиду![]() 𝑀𝑟
𝑀𝑟 ![]() ДНК
ДНК![]() = 36 ∙ 345 = 12 420 Да
= 36 ∙ 345 = 12 420 Да
Відповідь: L (ДНК) = 6,12 нм. Mr (ДНК) = 12 420 Да
Задача 8. Умова. Фрагмент молекули РНК вівці складається
![]() РНК – одноланцюгова молекула
РНК – одноланцюгова молекула
𝐿 ![]() РНК
РНК![]() = 𝑛
= 𝑛 ![]() нуклеотидів
нуклеотидів![]() ∙ 𝐿
∙ 𝐿 ![]() одного нуклеотиду
одного нуклеотиду![]()
𝐿 ![]() РНК
РНК![]() = 37 ∙ 0,34 = 12,58 нм
= 37 ∙ 0,34 = 12,58 нм
Відповідь: L (РНК) = 12,58 нм
Задача 9. Умова. Яка довжина молекули фрагмента ДНК,
ДНК – дволанцюгова молекула, тому загальну кількість нуклеотидів треба поділити на 2
![]() 𝑛 нуклеотидів
𝑛 нуклеотидів
![]() 𝐿
𝐿 ![]() ДНК = ∙ L одного нуклеотиду
ДНК = ∙ L одного нуклеотиду![]()
2
𝐿 ![]() ДНК
ДНК![]()
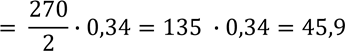 нм
нм
Відповідь: L (ДНК) = 45,9 нм
Задача 10. Умова. Фрагмент одного з ланцюгів ДНК має такий нуклеотидний склад:
1) АТГ-ГАЦ-АЦГ-ТГА; 2) ТАГ-АГЦ-ЦТА-АГА-ГТЦ; 3) АТГ-ТАА-ЦГА-ЦЦГ-АТА-ГТА. Визначте: а) послідовність нуклеотидів у другому ланцюзі ДНК; б) довжину ділянки ДНК
Для першого фрагмента
АТГ – ГАЦ – АЦГ – ТГА
ТАЦ – ЦТГ – ТГЦ – АЦТ
𝐿 ![]() ДНК
ДНК![]()
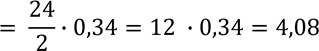 нм
нм
![]() Для другого фрагмента
Для другого фрагмента
ТАГ – АГЦ – ЦТА – АГА – ГТЦ АТЦ – ТЦГ – ГТА – ТЦТ – ЦАГ
𝐿 ![]() ДНК
ДНК![]()
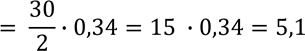 нм
нм
Для третього фрагмента
АТГ – ТАА – ЦГА – ЦЦГ – АТА – ГТА
ТАЦ – АТТ – ГЦТ – ГГЦ – ТАТ – ЦАТ
𝐿 ![]() ДНК
ДНК![]()
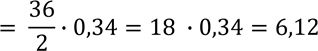 нм
нм
Задача 11. Умова. Фрагмент молекули ДНК містить 560 тимідилових нуклеотидів, що становить 28% від загальної кількості. Визначте: а) скільки в цьому фрагментів аденілових, гуанілових і цитидилових нуклеотидів; б) розмір даного фрагмента
За принципом комплементарності:
n (А) = 560, ω = 28% n (Т) = 560, ω = 28%
Щоб визначити кількість гуанілових і цитидилових нуклеотидів потрібно скласти пропорцію:
![]() 560 – 28%
560 – 28%
х – 100% х 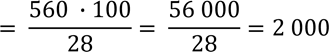
Отже, загальна кількість нуклеотидів = 2000. Тому:
2000 − ![]() 560 + 560
560 + 560![]() = 880 100% −
= 880 100% − ![]() 28% + 28%
28% + 28%![]() = 44% n (Г) = 440, ω = 22% n (Ц) = 440, ω = 22%
= 44% n (Г) = 440, ω = 22% n (Ц) = 440, ω = 22%
𝐿 ![]() ДНК
ДНК![]()
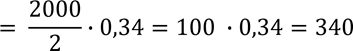 нм
нм
Задача 12. Умова. У молекулі ДНК з відносною масою 69 000 Да на частку аденілових нуклеотидів припадає 8 625 Да. Визначте кількість нуклеотидів кожного виду
Визначаємо кількість нуклеотидів в молекулі ДНК
𝑀𝑟 (ДНК)
𝑛 ![]() нуклеотидів =
нуклеотидів =
![]() 𝑀𝑟 (одного нуклеотиду)
𝑀𝑟 (одного нуклеотиду)
![]() 𝑛
𝑛 ![]() нуклеотидів
нуклеотидів![]() =
= 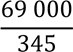 = 200
= 200
Визначаємо кількість аденілових і тимідилових нуклеотидів
![]() 𝑛 А, Т =
𝑛 А, Т = ![]() = 25 n (А) = 25
= 25 n (А) = 25
345 n (Т) = 25
Визначаємо кількість гуанілових і цитидилових нуклеотидів
![]() 𝑛 Г, Ц = 200 −
𝑛 Г, Ц = 200 − ![]() 25 + 25
25 + 25![]() = 200 − 50 = 150 n (Г) = 75 n (Ц) = 75
= 200 − 50 = 150 n (Г) = 75 n (Ц) = 75
Задача 13. Умова. Хімічний аналіз показав, що мРНК має 30% аденіну, 18% гуаніну, 20% урацилу. Який нуклеотидний склад відповідної ділянки дволанцюгової ДНК?
В молекулі РНК міститься чотири типи нуклеотидів: аденілові, урацилові, гуанілові та цитидилові. В умові не надано масову частку цитидилових нуклеотидів. Знайдемо її. Пам’ятаємо, що РНК – одноланцюгова молекула
![]()
![]() ω Ц = 100% − ω А + ω Г + ω
ω Ц = 100% − ω А + ω Г + ω ![]()
![]() ω Ц = 100% − 30% + 18% + 20% = 100% − 68% = 32%
ω Ц = 100% − 30% + 18% + 20% = 100% − 68% = 32%
ω (Ц) = 32%
![]() Тепер визначаємо хімічний склад ДНК. Пам’ятаємо, що це – дволанцюгова молекула, замість уридилових нуклеотидів містяться тимідилові. За принципом комплементарності:
Тепер визначаємо хімічний склад ДНК. Пам’ятаємо, що це – дволанцюгова молекула, замість уридилових нуклеотидів містяться тимідилові. За принципом комплементарності:
![]()
![]() ω А, Т = ω А + ω (У) ω А, Т = 30% + 20% = 50%
ω А, Т = ω А + ω (У) ω А, Т = 30% + 20% = 50%
ω (А) = 25% ω (Т) = 25%
![]() ω Г, Ц = 100% − 50% = 50%
ω Г, Ц = 100% − 50% = 50%
ω (Г) = 25% ω (Ц) = 25% Відповідь: хімічний склад відповідної ділянки ДНК:
ω (А) = 25%, ω (Т) = 25%, ω (Г) = 25%, ω (Ц) = 25%
Задача 14. Умова. Фрагмент молекули ДНК містить 440 гуанілових нуклеотидів, що становить
22% від загальної кількості нуклеотидів. Визначте довжину і масу цього фрагмента ДНК
За принципом комплементарності: n (Г) = 440, ω (Г) = 22% n (Ц) = 440, ω (Ц) = 22%
Щоб визначити загальну кількість нуклеотидів у даному фрагменті ДНК, складемо пропорцію:
440 = 22% 440 ∙ 100 44 000 х = 100% х ![]()
![]() Визначаємо кількість і масову частку аденілових і тимідилових нуклеотидів
Визначаємо кількість і масову частку аденілових і тимідилових нуклеотидів
![]()
![]()
![]()
![]()
![]() 𝑛 А, Т = 2000 − (𝑛 Г + 𝑛 Ц ) 𝑛 А, Т = 2000 −440 + 440 = 2000 − 880 = 1120 ω А, Т = 100% − (ω (Г) + ω (Ц)) ω А, Т = 100% −22% + 22% = 100% − 44% = 56% n (А) = 560, ω (А) = 28% n (Т) = 560, ω (Т) = 28%
𝑛 А, Т = 2000 − (𝑛 Г + 𝑛 Ц ) 𝑛 А, Т = 2000 −440 + 440 = 2000 − 880 = 1120 ω А, Т = 100% − (ω (Г) + ω (Ц)) ω А, Т = 100% −22% + 22% = 100% − 44% = 56% n (А) = 560, ω (А) = 28% n (Т) = 560, ω (Т) = 28%
Знаючи кількість нуклеотидів, визначаємо довжину фрагмента
![]() 𝑙 ДНК = 𝑛 нуклеотидів
𝑙 ДНК = 𝑛 нуклеотидів![]() ∙ 𝐿 (одного нуклеотиду)
∙ 𝐿 (одного нуклеотиду)
𝑙 ДНК = 2000 ∙ 0,34 = 680 нм
Знаючи кількість нуклеотидів, визначаємо молекулярну масу фрагмента
![]()
![]() 𝑀𝑟 ДНК = 𝑛 нуклеотидів ∙ 𝑀𝑟 одного нуклеотиду
𝑀𝑟 ДНК = 𝑛 нуклеотидів ∙ 𝑀𝑟 одного нуклеотиду![]() = 2000 ∙ 345 = 690 000 Да
= 2000 ∙ 345 = 690 000 Да
Задача 15, з НМТ-2024. Умова. В молекулі РНК було 120 аденілових, 100 гуанілових, 80 цитидилових та 60 уридилових нуклеотидів. Вкажіть кількість рибози в цій РНК
![]() На один нуклеотид припадає один залишок пентози (в даному випадку – рибози). Отже, потрібно просто визначити загальну кількість нуклеотидів у фрагменті РНК
На один нуклеотид припадає один залишок пентози (в даному випадку – рибози). Отже, потрібно просто визначити загальну кількість нуклеотидів у фрагменті РНК
![]()
![]()
![]()
![]()
![]() 𝑛нуклеотидів= 𝑛 А + 𝑛 Г + 𝑛 Ц + 𝑛 (У)
𝑛нуклеотидів= 𝑛 А + 𝑛 Г + 𝑛 Ц + 𝑛 (У)
𝑛нуклеотидів= 120 + 100 + 80 + 60 = 360
𝑛 рибози![]() = 𝑛 (нуклеотидів)
= 𝑛 (нуклеотидів)
Відповідь: в цій РНК міститься 360 молекул рибози
Задача 16. Умова. Амінокислота метіонін кодується триплетом АУГ, амінокислота триптофан – триплетом УГГ. Визначте кількість гуанілових нуклеотидів у ділянці молекули ДНК, яка кодує поліпептид, що складається зі ста залишків триптофану і ста залишків метіоніну
1 амінокислота кодується трьома нуклеотидами.
![]() 100 амінокислот = 300 нуклеотидів, 200 амінокислот = 600 нуклеотидів. Білок складається з двох амінокислот: метіоніну (кодується триплетом АУГ) і триптофану (кодується триплетом УГГ). Половину двох триплетів займає гуанін. Відповідно, щоб дізнатися кількість гуанілових нуклеотидів, потрібно просто поділити загальну кількість нуклеотидів на 2
100 амінокислот = 300 нуклеотидів, 200 амінокислот = 600 нуклеотидів. Білок складається з двох амінокислот: метіоніну (кодується триплетом АУГ) і триптофану (кодується триплетом УГГ). Половину двох триплетів займає гуанін. Відповідно, щоб дізнатися кількість гуанілових нуклеотидів, потрібно просто поділити загальну кількість нуклеотидів на 2
![]() 𝑛 Г =
𝑛 Г = ![]() = 300
= 300
Відповідь: n (Г) = 300
Заняття №5. Біологічно активні речовини (оглядово)
1. Загальні особливості
1) Біологічно активні речовини – це група органічних та неорганічних сполук, що мають різний хімічний склад, містяться в організмі у невеликих кількостях та впливають на процеси його життєдіяльності
|
Біологічно активні речовини |
|
|
Ферменти |
Медіатори |
|
Вітаміни |
Фітогормони |
|
Гормони |
Алкалоїди |
|
Нейрогормони |
Антибіотики |
1. Ферменти – це високомолекулярні БАР, зазвичай білкової природи, які відіграють роль каталізаторів біохімічних реакцій. Поділяються на 6 класів
2. Вітаміни – це низькомолекулярні БАР, які надходять до організму з харчовими продуктами або синтезуються безпосередньо в ньому. Розрізняють водорозчинні та жиророзчинні вітаміни
3. Гормони – це високомолекулярні БАР, які синтезуються залозами внутрішньої та змішаної секреції, здійснюють гуморальну регуляцію фізіологічних процесів, впливають на процеси росту, розвитку, обміну речовин тощо


про публікацію авторської розробки
Додати розробку