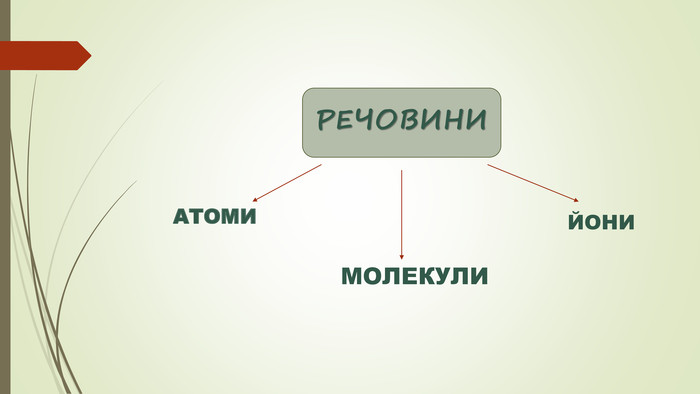
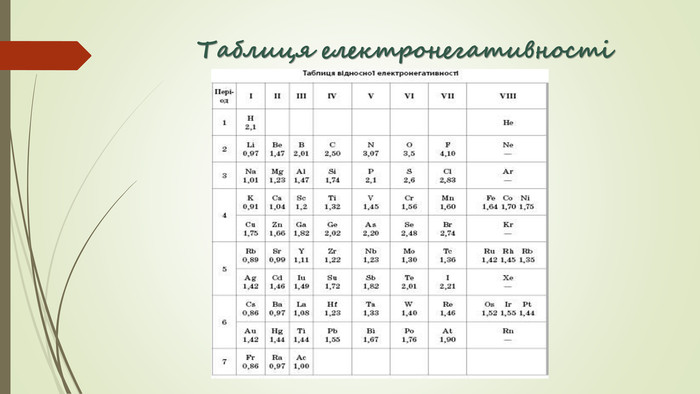
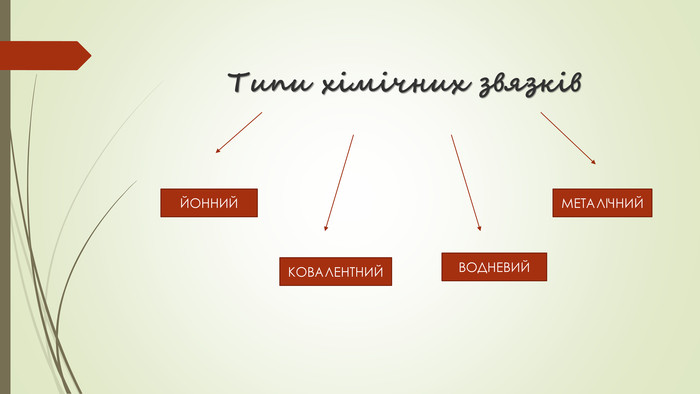
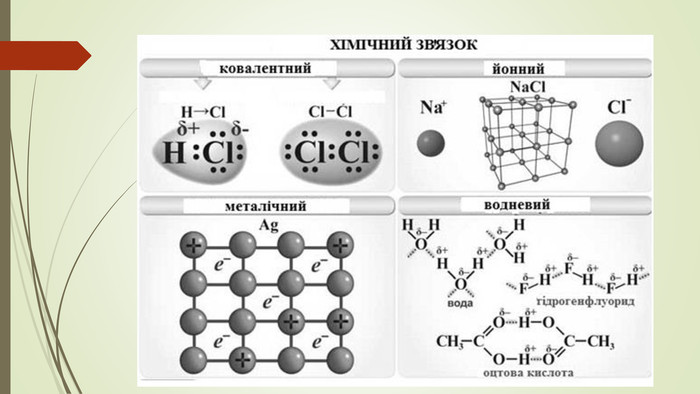
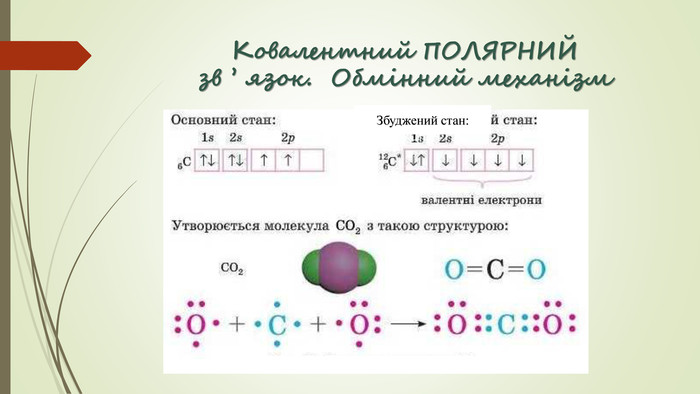
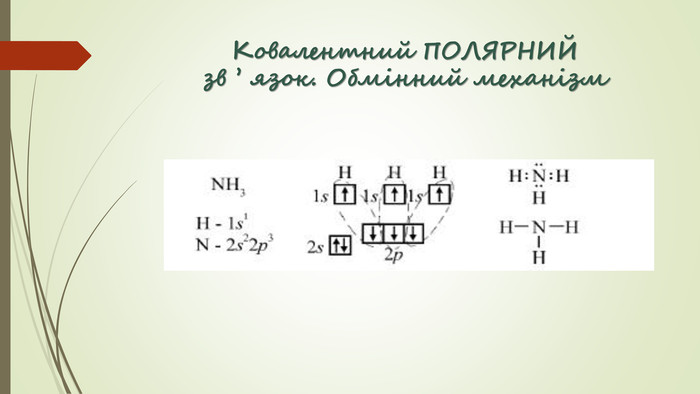
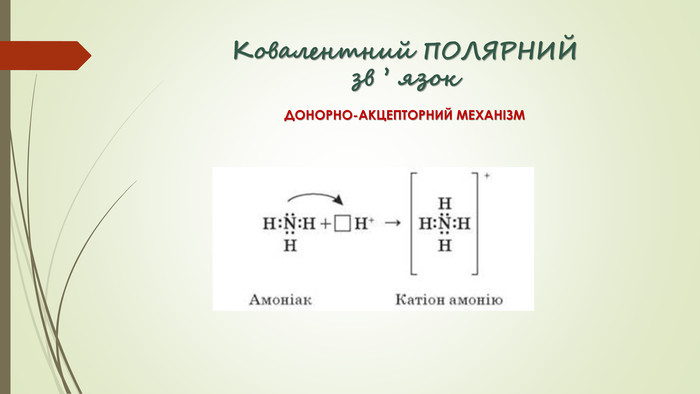
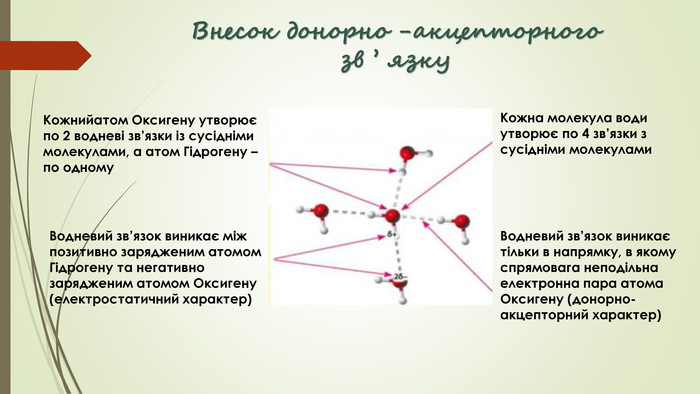
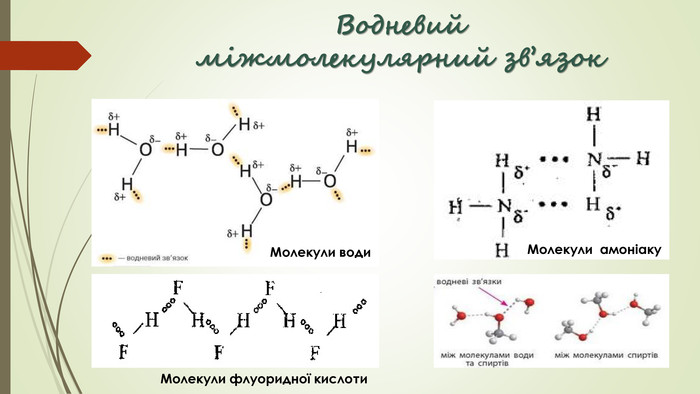
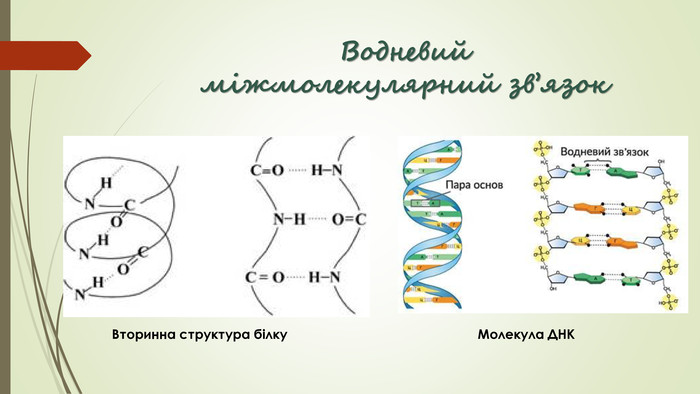
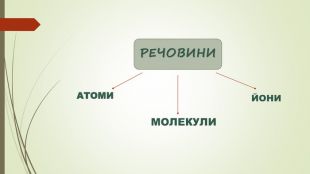
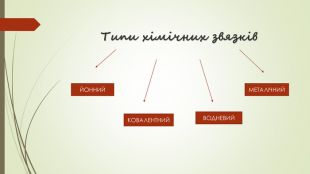
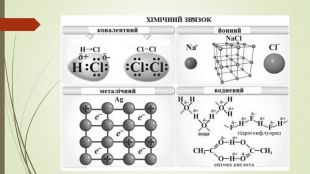
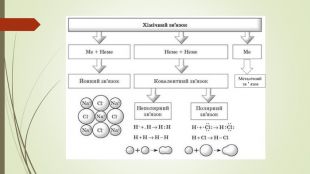
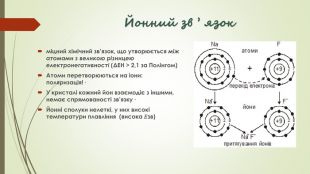
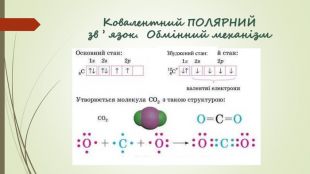
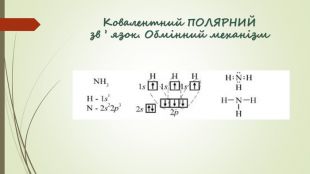
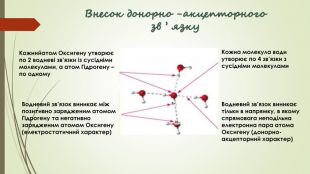
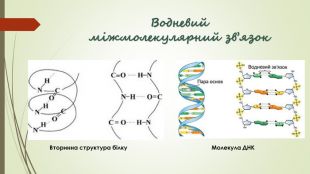
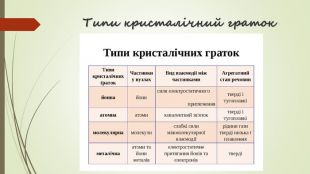
Хімічний зв'язок. Будова речовини
Про матеріал
Матеріал презентації можна використовувати для вивчення теми "Хімічний зв'язок. Будова речовини, "Органічні речовини", "Метали", "Неметали", під час уроків повторення та для підготовки до ЗНО. Містить тести ЗНО попередніх років з цієї теми. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку