Презентація "Періодична система - офіційна шпаргалка до ЗНО"
Про матеріал
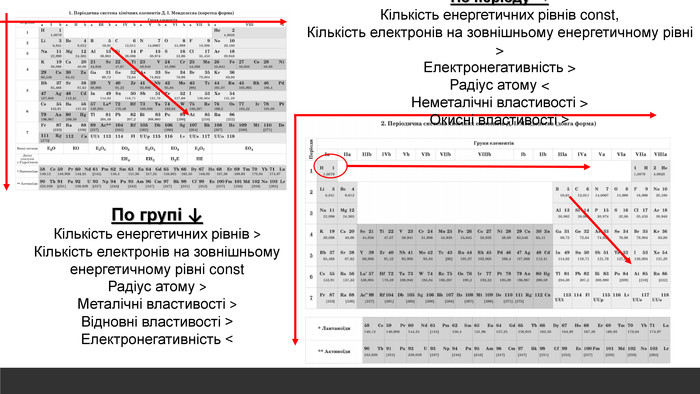
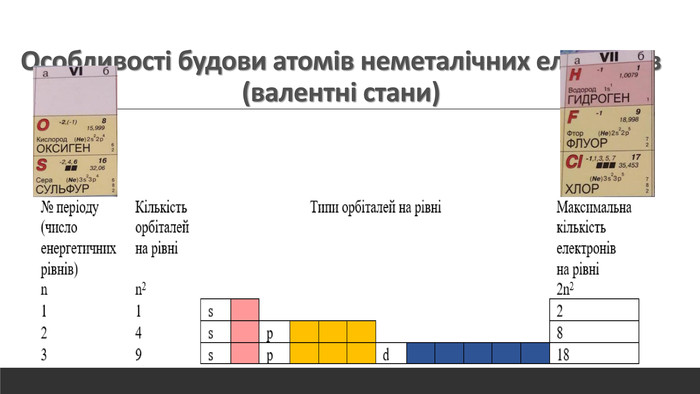
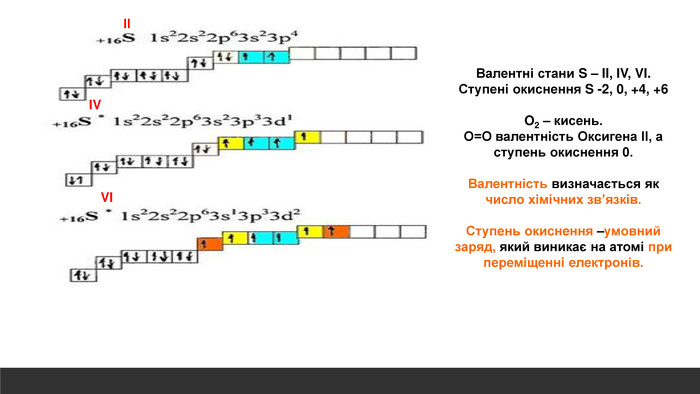
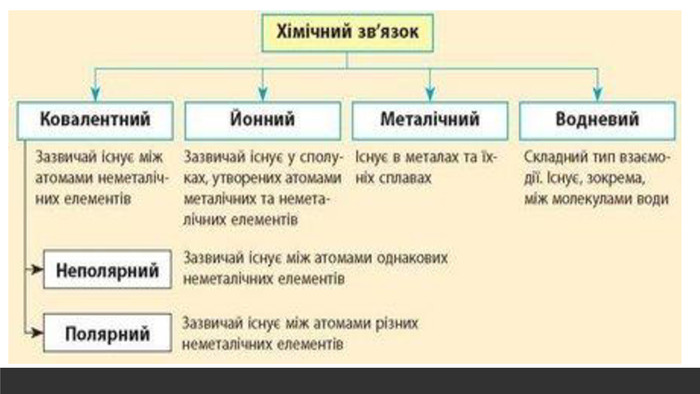
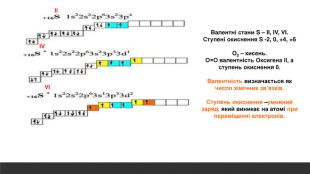
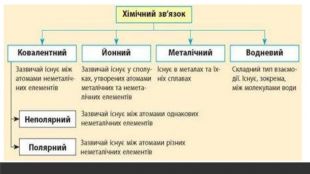
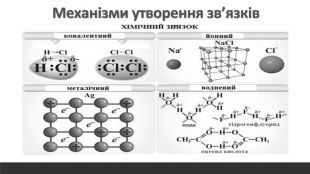
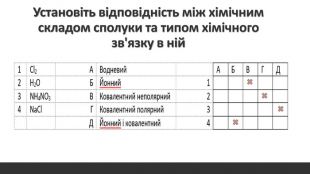
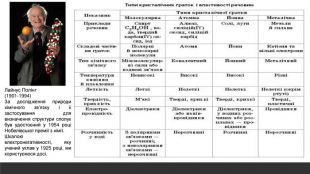
Розглядається узагальнення знань про Періодичну систему хімічних елементів Д.І. Менделєєва. Запропанований матеріал можна використовувати як для підготовки до ЗНО, та і у 8 класі при вивченні теми "Періодичний закон і періодична система хімічних елементів. Будова атома" Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку