Інтегрований урок з теми "Електроліз"
1
Методична розробка « Іноваційні підходи при викладанні хімії на прикладі інтегрованого заняття з теми «Електроліз» розроблена на основі досвіду роботи та знайомить з використанням інноваційних технологій навчання, а саме інформаційно-комунікаційної технології та проектної діяльності студентів при вивченні хімії.
Методична розробка має практичну спрямованість і може використовуватись викладачами хімії навчальних закладів 1-2 рівнів акредитації.
ЗМІСТ
Передмова 3
Вступ 5
Навчально-методична картка 8
Теоретичний матеріал 15
Висновки 20
Список використаної літератури 22
Додатки 23
Передмова
Для сучасної освіти України є важливим запровадження системних змін, оновлень у змісті, формах, методах освіти, зокрема загальної середньої. Інноваційна діяльність набирає значної сили і значення, про що йдеться у відповідних нормативно-правових документах, зокрема в Законах України «Про освіту», «Про загальноосвітній навчальний заклад», «Про інноваційну діяльність», у Положенні Міністерства освіти і науки України «Про порядок здійснення інноваційної діяльності в системі освіти України».
Використання нових педагогічних технологій у навчально-виховному процесі дозволяє викладачам реалізувати свої педагогічні ідеї, а студентам дає можливість самостійно вибирати освітню траєкторію - послідовність і темп вивчення тем, систему тренувальних завдань і задач, способи контролю знань. Так реалізується найважливіша вимога сучасної освіти - вироблення в суб'єктів освітнього процесу індивідуального стилю діяльності, культури самовизначення, відбувається їхній особистісний розвиток.
Головним питанням сьогодення в системі нової освіти є опанування студентами вмінь і навичок саморозвитку особистості, що значною мірою досягається шляхом впровадження інноваційних технологій організації процесу навчання.
При цьому можуть і повинні бути використані особистісно-зорієнтовані інноваційні педагогічні технології. Ефективність їх використання значною мірою залежить від того, як реалізується творчий потенціал особистості учня. Тому повинні змінитися пріоритети в діяльності вчителя. Від пояснювально-ілюстративного методу, від трансляції готового навчального змісту, від просвітительства студентів викладач повинен перейти до нових особистісно-зорієнтованих методів, у яких посилено творчо - діяльнісний компонент. Це зумовлює появу освітніх інновацій, покликаних істотно змінити освітній процес.
Перехід сучасного суспільства до інформаційної епохи свого розвитку висуває перед освітою одне з головних завдань - формування основ інформаційної культури майбутнього фахівця. Реалізація цього завдання неможлива без включення інформаційного компонента в систему хімічної освіти.
У сучасних умовах потрібно підготувати студентів до швидкого сприйняття й обробки інформації, яка надходить, успішно її відображати і використовувати. Кінцевим результатом впровадження інформаційних технологій у процесі навчання хімії, є оволодіння учнями комп'ютером як засобом пізнання процесів і явищ, що відбуваються в природі і застосовуються у практичній діяльності.
Вступ
Інтегроване заняття- це заняття яке проводиться з метою розкриття загальних закономірностей законів, ідей, теорій відображених у різних науках і відповідних їм навчальних предметах. Його проведення забезпечує формування у студентів цілісної системи уявлень про діалектико-матеріалістичні закони пізнання навколишнього світу в їх взаємозвязку та взаємозумовленості, сприяє роглибленню та розширенню знань студентів, діапазону їх практичного застосування до процесів та явищ оточучої дійсності.
Завдання викладача полягало у :
- визначенні змісту та обсягу навчального матеріалу відповідно до поставлених цілій та завдань інтегрованого заняття;
- вибір форм і методів реалізації навчального матеріалу;
- виділення об’єктивно існуючих зв’язків між базовими знаннями, які можна інтегрувати;
Електроліз – це сукупність процесів, що протікають у розчині або розплаві електроліту, при пропусканні через нього електричного струму. Електроліз є одним з найважливіших напрямків в електрохімії.
Актуальність електролізу пояснюється тим, що багато речовини отримують саме цим способом. Наприклад, такі метали як нікель, натрій, чистий водень та інші, отримують тільки з допомогою цього методу. Крім того, з його допомогою електролізу відносно легко можна отримати чисті метали, масова частка елемента в яких прагнути до ста відсотків. В промисловості алюміній і мідь в більшості випадків отримують саме електролізом. Перевага цього способу у відносній дешевизні і простоті. Однак щоб виробництво було найбільш вигідним: з найменшими витратами електроенергії і з найбільшим виходом продукції, необхідно враховувати різні фактори, що впливають на кількість і якість продуктів електролізу (сила струму, густина струму, температура електроліту, матеріал електродів і ін).
На сьогоднішній день великою популярністю користуються різні предмети, покриті дорогоцінними металами. (позолочені або посріблені речі).
До того ж металеві вироби покривають шаром іншого металу електролітичним способом з метою захистити його від корозії.
Таким чином, дослідження електрохімічних процесів, визначення факторів, що впливають на них, встановлення нових способів використання процесів електролізу в промислових умовах зберегло свою актуальність і затребуваність в наші дні.
У роботі були визначені наступні завдання:
- ознайомлення з теоретичними основами електролітичних процесів;
- визначення впливу різних факторів на якісний і кількісний склад продуктів електролізу;
- експериментально визначення впливу якісного складу вихідного електроліту на склад продуктів електролізу.
При реалізації завдань даного уроку доцільно:
-проводити заняття на здвоєному уроці;
- залучити до підготовки дослідів в допомогу шкільному лаборанту лаборантів учнів;
- провести бесіду з техніки безпеки при виконанні лабораторного експерименту;
- забезпечити кожну мікрогруппу роздатковим матеріалом (тексти завдань, періодичні системи хімічних елементів Менделєєва Д. І., таблиці електрохімічних еквівалентів речовин, електрохімічний ряд напруг металів);
- отриману за урок підсумкову оцінку поставити учням у журнал і по фізиці і хімії;
- задачі для самостійного розв'язання учні вибирають за рівнем труднощі.
НАВЧАЛЬНО – МЕТОДИЧНА КАРТКА
План заняття
Дисципліна: |
Неорганічна хімія |
Тема заняття: |
Електроліз |
Вид заняття: |
Інтегроване заняття |
|
Навчальна:.
- корегування та поглиблення знаннь з теми «Електроліз» через експеримент та рішення задач |
|
Розвиваюча - розвиток знаннь і уміннь, навичок студентів і творчого застосування їх на практиці; - формування наукового світогляду, самостійного мислення. - формування уявлення студентів про застосування набутих знань на практиці; -формування навиків хімічного мислення, логіки а також сприяння вихованню гармонічно розвинутою особистості. -формування навичків техніки виконання експерименту, вміння вирішувати розрахункові задачі, составляти рівняння хімічних реакцій, які проходять при електролізі розчинів та розплавів електролітів.
|
|
Виховна -виховання самостійності, організованості,формування умінь працювати в групі, -розвиток творчих здібностей,логичного мислення, уваги, пам’яті |
|
Забезпечуючи: технологія виробництва кулінарної продукції, товарознавство харчових продуктів |
|
Забезпечені: основи стандартизації і контроль якості продукції, технологія виробництва кулінарної продукції,товарознавство харчових продуктів. |
Забезпечення заняття
А. Наочні посібники |
Таблиці «Отримання алюмінію в промисловості» |
Б. Роздавальний матеріал: |
Розчин купрума хлориду, картки с завданням, текстами задач. |
В. Технічні засоби навчання: |
Комп’ютер, медіапроектор, кодоскоп,мультімедіа презентація, прибор для проведення електролізу, лабораторні амперметри ключі, реостати, з’єднувальні проводи,
|
Г. Навчальні місця кабінет № |
21 |
|
|
|
|
Література : 1.Габриєлян О.С. Загальна хімія, підручник для 11 класів загальноосвітніх закладів з поглибленим вивченням хімії, М. Просвіта, 2006. 2.Касянов В.А. Фізика, 11 клас, Підручник для загальноосвітніх закладів,-М. Дрофа,2007. 3.Римкевич А.П. Фізика. Задачник, 10-11 кл., Посібник для загальноосвітніх учбових закладів,-М.,Дрофа,2004.
|
|
|
|
|
|
|
|
 Зміст заняття
Зміст заняття
|
№ елемента |
Елементи заняття, навчальні питання, форми і методи навчання |
Зауваження |
|
1 |
2 |
3 |
|
I |
Організація групи: Викладач хімії. Здравствуйте, на минулому занятті ми теоретично розглянули процеси, що відбуваються при електролізі. Сьогодні продовжимо вивчення теми «Електроліз», практично застосовуючи знанняЗакріпимо вміння: складати рівняння хімічних реакцій процесів, що проходять при електролізі розплавів і розчинів електролітів; проводити розрахунки по реакціях і з допомогою законів Фарадея; практично проводити електроліз розчину. Будьте уважні, активні, організовані. За практичне заняття ви отримаєте підсумкову оцінку, основними показниками якості вашої роботи будуть чіткість і глибина відповідей, акуратність виконання експерименту, правильне рішення завдань, виконання домашнього завдання |
1-2хв. слайд 1 додаток №1 |
|
II |
Мотивація навчальної діяльності, повідомлення теми, цілі та задачі заняття . Повідомлення теми, цілі та задачі заняття. Розкривається значення цієї теми в подальшій роботі студентів. |
бесіда 3-4хв слайд 2 слайд 3 |
|
III |
Актуалізація опорних знань. 1. Які реакції називаються окисно – відновними? 2.Щотаке окиснення? 3.Щотаке відновлення? 4.Щотаке електроліт? 5.Що відбувається з речовинами електролітами в при розчиненні або розплавлюванні? 6.Що таке електролітична дисоціація?
|
10-12хв. слайд4 |
|
IV |
Вивчення нового матеріалу: 1. 1.1.Електоліз з точки зору хімії 1.2.Електроліз з точки зору фізики 2 .Дослідницький етап. Лабораторний експеримент Викладач фізики: Для вас приготований розчин хлориду міді. Виконайте наступне завдання: пропустіть електричний струм через розчин хлориду міді і визначте, як зміниться маса міді (судити за показаннями амперметра), що виділилася на катоді за один і той же невеликий проміжок часу, при зміні умов, зазначених у картках-завданнях Увага: 1. На початок досліду електроди повинні бути занурені в розчин наполовину. 2. Зробити звіт по формі: а) запис рівняння реакції; б) схема досліду; в) отриманий результат. (Перед перевіркою виконаного кожною групою студентів лабораторного експерименту викладач фізики на одній з досвідчених установок (на першій парті, наприклад) змінює полюса підключення джерела струму до вугільних електродів, попередньо показавши катод всім учням, звернувши увагу на його характерну забарвлення По черзі запитує результат, отриманий кожною групою при виконанні експерименту. Потім включає кодоскоп, і учні порівнюють свої результати з записами на плівці кодоскопа, записують загальний висновок у зошит: маса речовини, що виділяється на електродах залежить від напруги, концентрації розчину, температури, відстані між електродами, площі електродів. Викладач хімії: Ви експериментально підтвердили, що за допомогою електролізу можна отримувати різні речовини, зокрема, мідь. В промисловості електролізом отримують і інші метали, наприклад алюміній. Далі йде повідомлення учня про отримання алюмінія в промисловості . Демонстраційний експеримент Викладач фізики: подивимося на результат нашого експерименту по заміні полярності вугільних електродів. (Вимикає установку і дістає електрод, який був покритий міддю. Студенти переконуються, що електрод став чистим). Формулюється висновок: мідь, осіла на катоді, прореагувала, коли він став анодом. Питання: Що відбудеться, якщо анод буде з міді? Вчитель хімії: Тоді процеси для розчину хлориду міді (II) будуть наступними . Учні записують все в зошит. Вчитель повідомляє, що електроліз з розчинним анодом застосовують для очищення металів. Цей спосіб називається електролітичним рафінуванням . 3. Рішення завдань. (10 хвилин) Викладач хімії: переходимо до наступної частини заняття – вирішення завдань. Викликає до дошки двох студентів, які вирішують завдання: № 1 і №2. Інші - вирішують завдання № 3 в зошиті (додаток 4 )Один з учнів розв'язує завдання № 3 на плівці кодоскопа для подальшої перевірки. Після розбору завдань-прикладів, вирішених на дошці і завдання на плівці кодоскопа, студентам пропонується виконати самостійну роботу з розв'язання задач (рівень складності завдання учень може вибрати сам |
30-35хв.
слайд 5 слайд 6
додаток 1, слайд 7,8
Додаток Слайд 9,10,11 Додаток 3
|
|
V |
Закріплення нового матеріалу. Самостійна робота. (додаток 4) |
10-15хв. Додаток 4 |
|
VI |
Домашнє завдання. Домашнє завдання. Викладачі коментують домашнє завдання. |
1-2хв.
|
|
VII |
Підбиття підсумків заняття . |
2-3хв. |
|
|
Підведення підсумків заняття (8 хвилин) Викладач фізики проводить співбесіду зі студентами з питань : -що зроблено? -що повторили? -що дізналися нового? Далі виставляється підсумкова оцінка кожного студента.
|
|
Лекція з теми «Теоретичні основи електролізу»
Вступ.
Ви ознайомилися з різними способами добування металів з руд і знаєте, що для цього використовують такі відновники, як вугілля (кокс) С, карбон (ІІ) оксид CO, водень Н2 та активні метали А1, Mg тощо (металотермія). Виявляється, що з цією метою можна використовувати й електричний струм. У цьому разі процес називається електролізом.
Давайте згадаємо, що відновити хімічний елемент–це означає надати його атомам або йонам електрони. Окиснити елемент–це означає відняти від його атомів або йонів електрони. Обидва процеси–окис-нення і відновлення –можна здійснити не лише за допомогою звичайних хімічних реакцій, а й під впливом електричного струму.
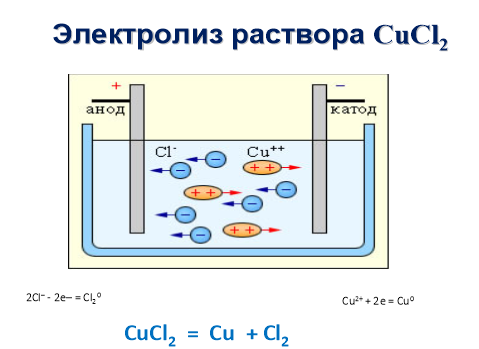
Наллємо в U-подібну трубку розчин купрум (ІІ) хлориду CuCl2, зануримо у кожне коліно вугляний електрод і з'єднаємо обидва електроди металевими провідниками з джерелом постійного струму (акумулятором). Електрод, сполучений з негативним полюсом джерела струму, називається катодом, а з позитивним полюсом – анодом.Катод вкриватиметься шар за шаром червоною металічною міддю, а на аноді виділятиметься вільний хлор (виявляємо за запахом). Що ж відбулося? Під дією електричного струму купрум (II) хлорид розклався на мідь і хлор:
CuCl2 = Cu + Cl2↑
Як пояснити дію електричного струму? Що відбувається на катоді та на аноді?
Ви знаєте, що ще до вмикання струму купрум (ІІ) хлорид у розчині під впливом води дисоціює на йони купруму та йони хлору:
CuCl2 → Cu2+ + 2Сl-,
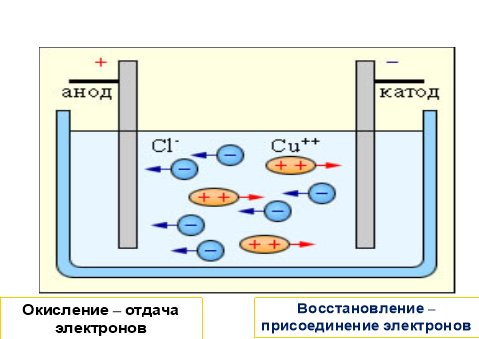
які хаотично рухаються у розчині. Після вмикання електричного струму безладний рух йонів стає спрямованим. Позитивно заряджені йони купруму Сu2+ притягуються негативно зарядженим електродом – катодом і рухаються у напрямку до нього, тому й називаються катіонами. Негативно заряджені йони хлору Сl- притягуються позитивно зарядженим електродом –анодом і рухаються до нього, тому й називаються аніонами.
Коли йони Купруму досягають катода, вони приєднують електрони (на поверхні катода надлишок електронів), тобто відновлюються і перетворюються на електронейтральні атоми Купруму:
Сu2+ + 2ē = Сu°
На поверхні катода відкладається металічна мідь.
Хлорид-іони, досягнувши анода, навпаки, віддають електрони (кожний – по одному електрону), тобто окиснюються і також перетворюються з йонів на електронейтральні атоми, які, сполучаючись попарно, утворюють молекули хлору:
2Сl- - 2ē = 2С1°; С1° + С1° = Cl2↑
Отже, ви переконалися, що
Електроліз – це окисно-відновні реакції, які відбуваються на електродах під дією постійного електричного струму під час проходження його крізь розчин (або розплав) електроліту. Він супроводжується перетворенням електричної енергії на внутрішню енергію продуктів електролізу.
У водних розчинах солей, утворених активними металами і оксигеновмісними кислотами, процес електролізу має свої особливості, оскільки в ньому бере участь вода. Проте ми такі випадки не розглядатимемо, а обмежимось вивченням процесів, які відбуваються під час електролізу розплавів електролітів.
Електроліз розплавів.Ви вже знаєте, що відновлювати метал можна і за допомогою електричного струму. Наприклад, якщо розплавити кухонну сіль NaCl, то під впливом високої температури її кристалічна решітка розщепиться на йони (так само, як і під час розчинення у воді):
NaCl → Na+ + Сl-
У розплаві йони рухаються хаотично. Якщо крізь цей розплав пропустити постійний електричний струм, то йони Натрію почнуть переміщуватися до катода, де приєднуватимуть по одному електрону, тобто відновлюватимуться:
Na+ + 1ē = Na0
Отже, катод, на якому завжди надлишок електронів, є відновником.
Під дією електричного струму йони Хлору прямують до анода.
Оскільки на аноді завжди нестача електронів, то йони хлору віддають по одному електрону, тобто окиснюються:
Сl- - 1ē = Сl 0
Атоми хлору з'єднуються попарно, і на аноді виділяється газоподібний хлор Cl2.
Отже, анод, на якому завжди нестача електронів, є окисником.
Як бачимо, усякий електроліз (і розчину електроліту, і розплаву) є окисно-відновним процесом, що відбувається під впливом електричного струму.
Чисті активні метали можна добути електролізом розплавів солей або лугів. Наприклад, якщо розплавити гідроксид натрію, то відбудеться термічна дисоціація його кристалів на йони: NaOH → Na+ + OH-
Якщо далі крізь цей розплав пропустити електричний струм, то на катоді йони натрію, приєднуючи електрони, відновлюватимуться до нейтральних атомів. Утворюватиметься металічний натрій:
Na+ + 1ē = Na°
На аноді розряджатимуться гідроксид-іони, віддаючи кожний по одному електрону і перетворюючись на нейтральні групи ОН, які в нейтральному стані існувати не можуть. Вони відразу ж розкладаються з утворенням води і кисню: 4OH- - 4 ē → 2H2O + O2 ↑
Отже, під час електролізу розплаву їдкого натру на катоді відбувається процес відновлення йонів натрію, і виділяється металічний натрій, а на аноді відбувається процес окиснення гідроксид-іонів, і виділяється кисень.
В усіх розглянутих випадках передбачалося, що електроди, за допомогою яких підводиться електричний струм, виготовлені з матеріалу, який не бере участі в реакції. Такі електроди називають інертними.
Застосування електролізу. Електроліз широко застосовується у багатьох виробництвах. Наприклад, це єдиний економічно вигідний промисловий спосіб добування активних металів (Na, К, Са, А1, Mg), а також деяких активних неметалів (Cl2, F2) і навіть окремих складних речовин –лугів NaOH, КОН і бертолетової солі КСlO3 (калій хлорат).
Електроліз використовують також для очищення металів, для вкриття одного металу іншим з метою захисту його від корозії тощо. Так здійснюють нікелювання, хромування, лудіння (вкриття оловом), оцинковування, золочення тощо.
Нарощування шару металу на поверхні виробу електролітичним способом дає змогу виготовляти найтонші зліпки і копії. Цей спосіб розробив російський учений Б.Я.Якобі у 1838 p., і називається він гальванопластикою.
Завдання для самоконтролю
1. У чому полягає суть електролізу? Поясніть на конкрет ному прикладі.
2. Як відбувається електроліз розплаву йодиду калію КІ?
3. Чому електроліз завжди є окисно-відновним процесом?
4. Які частинки переносять електричний струм у водному розчині солі, у розплаві солі та в металевих провідниках?
5. Який вплив на розчин або розплав електроліту, вміщеного в електролітичну ванну (електролізер), справляє вмикання електричного струму?
6. Що таке електроліз?
Висновок
Аналіз наукової і науково-популярної літератури свідчить про те, що процеси електролізу розчинів і розплавів цікавлять вчених і технологів в даний час, тобто дана тема не втратила своєї актуальності і практичної значущості.
Електроліз широко використовують у промисловості для виділення та очищення металів, одержання лугів, хлору, водню.
Алюміній, магній, натрій, кадмій, кальцій, берилий, титан отримують лише електролізом розплавів, т. к. потенціали їх виділення з водних ратворов більш негативні, ніж потенціал виділення водню.
Очищення міді, нікелю, свинцю проводять цілком електрохімічним методом. Виробництво фтору засноване на електролізі розплавленої суміші фториду калію і фтороводородной кислоти, хлору – при електролізі водних ратворов або розплавів хлоридів. Водень і кисень високого ступеня чистоти отримують електролізом водних розчинів лугів. Таким чином, за допомогою електролізу вдається здійснювати реакції окислення і відновлення з великим виходом і високою селективністю, які в звичайних хімічних процесах важко досяжні.
Важливою галуззю застосування електролізу є захист металів від корозії: при цьому електрохімічним методом на поверхню металевих виробів наноситься тонкий шар іншого металу (хрому, срібла, міді, нікелю, золота) стійкого до корозії.
Відмінною особливістю електролізу розчинів або розплавів електролітів є можливість протікання на електродах сукупності конкуруючих хімічних реакцій окислення і відновлення. Впливає на продукти електролізу і матеріал електродів.
При електролізі водних розчинів електролітів окислювально-відновні процеси на катоді і аноді залежать від окислювальної здатності катіонів і характеру аніони електроліту.
Процеси відновлення та окислення на катоді і аноді визначаються значеннями електродних потенціалів частинок, що приймають участь в електролітичних процесах. На катоді в першу чергу розряджаються ті частинки, потенціал яких найбільш позитивний, тоді як на аноді – частинки – потенціал котрих найбільш электроотрицателен. Крім того, при протіканні електролізу необхідно враховувати фактор електродного перенапруги – поляризацію електрода, обумовлену уповільненим перебігом певній стадії сумарного електродного процесу. В залежності від природи сповільненої стадії можна говорити про різних видах перенапруги (концентрационное, реакційний, диффцзное).
В експериментальній частині роботи нами були проведені процеси електролізу розчинів деяких солей. Отримані продукти підтверджують основні теоретичні положення процесів електролізу водних розчинів електролітів і доведений факт впливу електродних потенціалів частинок, які беруть у ньому участь, на склад кінцевих продуктів.
На підставі виконаної роботи можна зробити наступні висновки:
Дослідження процесів електролізу розчинів і розплавів електролітів не втратило своєї актуальності і в даний час, т. к. не тільки збагачує теоретичні положення про це досить складно фізико-хімічному явище, але і дозволяє визначити перспективні напрямки практичного використання цього процесу з метою отримання цільових продуктів із заданими властивостями і якостями.
Якісний склад кінцевих продуктів електролітичних процесів визначається не тільки величиною електродного потенціалу іонів, але і видом перенапруження, що виникає при цьому.
Запропонована навчально-методична розробка може бути рекомендована для використання в роботі викладачів курсу „Неорганічна хімія
Список використаної літератури
1. Бабанський Ю.К. Оптимізація навчально-виховного процесу. – М., 1982. -192с.
2. Безрукова Н.П., Козлова Л.Я., Изместьева Н.Д., Комп'ютерні технології у викладанні хімії в школі.
3. Буджак Г. Метод проектів як педагогічна технологія// Біологія і хімія в школі – 2001 -№1
4. Державна національна програма «Освіта» (Україна ХХІ століття) – К.: Райдуга -1994.
5. Інтерактивне навчання на уроках хімії / Упоряд. Г. Мальченко, О. Каретникова. – К.: Ред. загальнопед. газ., 2004. – 128 с.
6. Корсакова О.К., Трубачова С.Е. До проблеми змісту сучасної шкільної освіти // Біологія і хімія в школі. – 2002. – №6. – С. 8-11.
7. Нісімчук А.С., Падалка О.С., Шпак О.Т. Сучасні педагогічні технології. – К.: Просвіта; 2000.-368с.
8. Пометун О.І., Пироженко Л.В. Сучасний урок. Інтерактивні технології навчання: Наук. метод. посіб. – К.: Видавництво А.С.К., 2004. – 192 с.
9. Селевко Г.К. Сучасні освітні технології.-М: Народне утворення, 1998р.-255с.
10. Стратегія реформування освіти в Україні: рекомендації з освітньої політики. – К.: Вид-во «К.І.С.», 2003. – С. 25-26.
11. Химинець В.В., Інноваційна освітня діяльність. – У.: Інформаіно-видавничий центр ЗІППО, 2007. – 364с.
Додаток № 1
Картка-завдання 1:
Пропустіть електричний струм через розчин хлориду міді. Вугільні електроди повинні бути занурені приблизно на половину своєї довжини. Дослідіть, як зміниться маса міді (про це можна судити за показаннями амперметра), що виділилася на катоді за один і той же невеликий проміжок часу, якщо:
1) ви збільшите концентрацію розчину;
2) ви збільшите напруга на електродах(U1=2B, U2=4В)
Про масі виділяється міді судити за показаннями амперметра. Запишіть реакцію, результат експерименту, накресліть схему.
Картка-завдання 2:
Пропустіть електричний струм через розчин мідного купоросу. Вугільні електроди повинні бути занурені приблизно на половину своєї довжини. Дослідіть, як зміниться маса міді (про це можна судити за показаннями амперметра), що виділилася на катоді за один і той же невеликий проміжок часу, якщо:
1) ви збільшите занурену частину анода;
2) ви збільшите занурену частину катода.
Про масі виділяється міді судити за показаннями амперметра. Запишіть реакцію, результат експерименту, накресліть схему.
Картка-завдання 3:
Пропустіть електричний струм через розчин мідного купоросу. Вугільні електроди повинні бути занурені приблизно на половину своєї довжини. Дослідіть, як зміниться маса міді (про це можна судити за показаннями амперметра), що виділилася на катоді за один і той же невеликий проміжок часу, якщо:
1) ви зміните відстань між електродами.
2) ви нагреете розчин електроліту.
Про масі виділяється міді судити за показаннями амперметра. Запишіть реакцію, результат експерименту, накресліть схему.
Додаток №2
Повідомлення учня «Отримання алюмінію»
Основна частина алюмінію в природі - це оксид алюмінію, що входить до складу глинозему і бокситів. Його температура плавлення около2050оС, тому з-за енергоємності електролізу цієї речовини Аl довгий час відносили до дуже дорогих металів. В середині 19 століття він коштував у 10 разів дорожче золота. Досить сказати, що з алюмінію була зроблена і подарована брязкальце сина Наполеона III. Д. І. Менделєєву в знак визнання його заслуг у Великобританії були подаровані ваги, одна чаша яких була зроблена з золота, а інша не менш дорогого чистого алюмінію. В кінці 19 століття процес отримання цього металу було вдосконалено, і в даний час алюміній отримують електролізом розплаву оксиду алюмінію в кріоліті (Na3AlF6) з добавкою фториду кальцію. Кріоліт та фторид кальцію додають, щоб знизити температуру плавлення і зробити розплав електропровідним.
(слайд 7). Процеси, що відбуваються при електролізі:
До(-): 2 Аl3+ + 6 е- = 2 Аl
А(+): обсязі 2о2- - 4е -= О2 2 С+ О2 = 2 З 2СО + О2= 2СО2
( графітовий)
електроліз
2 Аl2O3 + 3C = 3CO2 + 4Al
Електроліз проводять в сталевих електролітичних ваннах, всередині така ванна викладена графітовими блоками, так як розплавлені фториди при високій температурі розчиняють звичайну вогнетривку футеровку. Графітові блоки разом з розплавленим алюмінієм служать катодом, а аноди з графіту змонтовані таким чином, щоб вони змогли опускатися по мірі їх згоряння. Поступово аноди замінюють новими, так як графітові електроди згорають, взаємодіючи з киснем. ( Таблиця «Отримання алюмінія в промисловості» або мультимедіа навчальний курс» 1 С: Освітня колекція. Загальна та неорганічна хімія 10-11 класи», тема «Отримання алюмінію»).
Додаток № 3
Повідомлення вчителя
Якщо в якості анода використовувати мідь, що містить домішки інших металів і неметалів, то менш активні метали не будуть окислюватись на аноді і переходити в електроліт при потенціалі розчинення міді, вони утворюють осад анодного шламу. Більш активні метали, перейшовши в розчин у вигляді іонів, не зможуть відновитися на катоді, поки в електроліті висока концентрація іонів міді. Отже, при проведенні електролізу розчину солі міді з мідним анодом, що містить домішки, на катоді буде виділятися чиста мідь. При електрохімічному рафінуванні міді струм видаляє мідь з анода і переносить її на катод, а електродні потенціали служать при цьому своєрідними фільтрами, що відділяють іони міді від домішок і на аноді, і на катоді. Крім міді, методом електрохімічного рафінування очищають цинк, кадмій, марганець, нікель і інші метали.
Додаток № 4
Завдання
1.Знайти об'єм газу, що виділився на аноді, при повному електролізі 200 г 10%-ного розчину хлориду калію . (3 л).
2.Нікелювання з допомогою електролізу металевої пластинки, що має площу поверхні 48 см2, тривало 4 год при силі струму 0,15 А. Знайдіть товщину шару нікелю, якщо валентність нікелю дорівнює 2.
3.При пропущенні постійного струму силою 6,4 А протягом 30 хвилин через розплав солі тривалентного металу на катоді виділилося 1,07 г речовини, а на аноді - близько 1,344 л газу, що має щільність по гелію 17,75.Визначте склад солі, яку піддали електролізу і напишіть рівняння проходить електролізу (Хлорид алюмінію).
4. Який об'єм газу (за н. у.) виділився на аноді при електролізі розчину хлориду міді(II) , якщо на катоді виділилося 3,2 г міді?
5. Цинковий анод масою 5 г поставлений в електролітичну ванну, через яку проходить струм силою 2 А Через деякий час анод повністю витратиться на покриття металевих виробів?
6. При електролітичному способі отримання нікелю на одиницю маси витрачається W= 10 кВт ·год/кг енергії. ( К=1,08· 10-3 кг/А·год). При якій напрузі проводиться електроліз?
7. Протягом якого часу треба проводити електроліз розплаву хлориду заліза (II) при силі струму 30 А, щоб отримати залізо, необхідне для повного взаємодії зі 100 г 30%-го розчину соляної кислоти?
8. При електролітичному способі отримання алюмінію використовуються ванни, що працюють під напругою 5 В при силі струму 40 кА. Скільки часу буде потрібно для отримання 1 тонни алюмінію, і який при цьому витрата енергії?
9. При електролізі 240 г 15%-ного розчину гідроксиду натрію на аноді виділилося 89,6 л (н. у.) кисню. Знайти масову частку речовини в розчині після закінчення реакції.
10. На заводі був підданий електролізу розчин, що містить 468 кг хлориду натрію. Отримані гази були використані для синтезу хлороводню. Утворився хлороводород розчинили у 708 л води. Розрахуйте масову частку хлороводню отриманої в соляній кислоті.
11. Магній, отриманий електролізом розплаву хлориду магнію протягом 200 хв. при силі струму 10 А, розчинили в 1,5 л 25 %-ного розчину сірчаної кислоти щільністю 1,178 г/мл Знайти концентрацію сульфату магнію в отриманому розчині.
12. Визначте масу виділилася міді при електролізі, якщо витрачено 5 кВт год електроенергії. Напруга на клемах ванни 10 Ст. ККД установки 75 %. (Відп. 0,445 кг).
13. Аеростат об'ємом 250 м3 заповнюють воднем при температурі 27оС і тиску 2 атм. Який заряд треба пропустити при електролізі через слабкий розчин сірчаної кислоти, щоб отримати потрібну кількість водню?
Презентація (слайди)
Слайд №1

Слайд №7
Слайд№ 8
Слайд№9

Слайд №10

Слайд№11

Українська інженерно-педагогічна академія
навчально-науковий професійно-педагогічний інститут
РЕЦЕНЗІЯ НА ВИПУСКНУ РОБОТУ
Білоцерковець Ірини Василівни
Викладача хімії
Курсів підвищення кваліфікації
За темою: “Інноваційні підходи
при викладанні хімії на прикладі інтегрованого заняття з теми «Електроліз”
Рецензент –
ЗМІСТ РЕЦЕНЗІЇ
Випускна робота складена БілоцерковецьІ.В. викладачем вищої категорії Маріупольського технікуму Донецького національного університету економіки і торгівлі імені Михайла Туган – Барановського.
У випускній роботі докладно відображається порядок проведення заняття з теми: “Електроліз”, відображені усі елементи заняття. Викладач визначила цілі заняття, пов’язані з формуванням та удосконаленням навичок володіння матеріалом. Викладач правильно і кваліфіковано використовує сучасні методи, прийоми і форми роботи. Цьому сприяє змістовний та інформативний навчальний матеріал, який займає провідне місце у стимулюванні студентів до професійно спрямованого спілкування у мовних ситуаціях, наближених до реального життя. Викладач створює умови для творчої колективної та самостійної діяльності, атмосферу зацікавленості у роботі кожного студента, стимулює до висловлювання думки.
В основу завданнь заняття покладено експериментальну діяльність,які розвивають прагнення до удосконалення професійних навичок, розвивають логічне мислення.
Основний матеріал подається через систему вправ та у комунікативних ситуаціях.
Випускна робота: “Інноваційні підходипри викладанні хімії на прикладі інтегрованого заняття з теми «Електроліз” може бути рекомендована викладачам для ознайомлення з методикою проведення інтегрованого заняття.
Ця робота відповідає методичним вимогам програми дисципліни „Неорганічна хімія ”.
|
Допущений до захисту |
„_____”_____________20____р. |
|
|
|
|
(підпис рецензента)
|
|
Випускна робота захищена |
„_____”_____________20____р. |
з оцінкою_____________ |
|
|
|
|
_________________ _______________________ ________________
( підпис) (прізвище, ініціали) (посада)
„____”______________2015


про публікацію авторської розробки
Додати розробку
