Ізопроцеси. газові закони
Тема: Ізопроцеси. Газові закони.
Мета:
навчальна: поглиблювати знання студентів про властивості ідеального газу, сформувати поняття ізопроцесів, газові закони для ізопроцесів; формувати вміння аналізувати навчальний матеріал, робити висновки, застосовувати знання для пояснення фізичних явищ, розв’язування задач на газові закони;
розвиваюча: розвивати критичне мислення, увагу, пам'ять, спостережливість, мовлення студентів;
виховна: виховувати інтерес до вивчення фізики, культуру записів. Тип заняття: комбіноване
Обладнання: комп’ютер, проектор, екран.
Забезпечення заняття: збірник задач, відеоматеріали, роздатковий матеріал.
Хід заняття
І. Організація студентів до заняття
На екрані спроектовано епіграф заняття
Перевірка присутніх, перевірка робочих місць.
ІІ. Перевірка домашнього завдання
Задача з збірника задач Римкевич А.П. № 488 – перевірка наявності факту виконання домашнього заняття.
ІІІ. Актуалізація і корекція опорних знань
Проводжу повторення матеріалу у формі «Асоціативний кущ» - питання
«ідеальний газ»
Проводжу фізичний диктант за питаннями:
1. Назвати макропараметри газу (температура, тиск, об’єм) та їх розмірності
2. Сполучити фізичну величину з її розмірністю (кількість речовини, молярна маса, концентрація)
3. Сполучити фізичну константу з її фізичним змістом стала Авогадро, універсальна газова стала, стала Больцмана.
4. Сполучити фізичний закон з його записом рівняння Мендєлєєва-Клапейрона, рівняння газу ідеального стану, кінетична енергія
IV. Повідомлення теми, формулювання мети та основних завдань Тема: Ізопроцеси. Газові закони. Швидкість молекул ідеального газу
Мета: поглиблювати знання студентів про властивості ідеального газу, сформувати поняття ізопроцесів, газові закони для ізопроцесів; формувати вміння аналізувати навчальний матеріал, робити висновки, застосовувати знання для пояснення фізичних явищ, розв’язування задач на газові закони.
Завдання: Ми продовжуємо вивчення фізичних властивостей ідеального газу, на сьогоднішньому занятті встановлюємо залежність між двома макроскопічними параметрами стану ідеального газу за умови, якщо не змінюється третій макропараметр та маса газу.
V. Мотивація навчальної діяльності
Ми з’ясували, що рівняння стану ідеального газу пов’язує між собою три макроскопічні параметри – тиск р, об’єм V та температуру Т, але багато процесів у природі, техніці протікає за умов (наближено), коли змінюються два макропараметри, третій залишається незмінним.
VI. Сприймання і усвідомлення нового матеріалу
ПЛАН
1) Пояснення матеріалу
1. Ізопроцеси
2. Газові закони
3. Швидкість молекул ідеального газу
2) Підсумкова бесіда
1. Ізопроцеси
Стан певної маси газу визначається трьома макроскопічними параметрами — тиском p, об’ємом V і температурою T. Однак багато процесів у газах, що відбуваються в природі або здійснюються в техніці, припустимо розглядати (приблизно) як процеси, у яких змінюються лише два з них.
Особливу роль у фізиці й техніці відіграють так звані ізопроцеси.
Ізопроцеси – це процеси, що відбуваються при незмінному значенні одного із параметрів газу (P, V, T)
Зміну тиску й об’єму газу за постійної температури називають ізотермічним процесом.
Ізотермічний (Т=соnst)
Зміна об’єму й температури газу за постійного тиску називається ізобарним процесом.
Ізобарний (Р=соnst)
Зміну тиску й температури газу за постійного об’єму називають ізохорним процесом.
Ізохорний (V=соnst)
2. Газові закони
Об’єднаний газовий закон:
P1V1 P2V2 PV , або ![]() const .
const .
T1 T2 T
Закон Бойля—Маріотта названий на честь ірландського фізика, хіміка і філософа Роберта Бойля (1627—1691), що відкрив його в 1662, а також на честь французького фізика Едма Маріотта (1620—1684), який відкрив цей закон незалежно від Бойля в 1676 році.
Закон Бойля-Маріотта: T const, або P1 V2 const
P2 V1
Для даної маси газу добуток тиску газу на його об’єм сталий, якщо температура газу не змінюється. Приклад:
При сталій температурі об’єм газу збільшився з 18м3 до 20м3, початковий тиск становив 105Па. Визначити тиск, який встановився в даній системі. (9 × 104 Па).
Закон Гей-Люссака: P const, або V1 T1 const
V2 T2
Для даної маси газу відношення об’єму газу до його температури стале, якщо тиск газу не змінюється.
Приклад:
При сталому тиску об’єм газу збільшився з 27м3 до 90м3, початкова температура становила 300 К. Визначити температуру, яка встановилася в даній системі. (1000 К).
Закон Шарля: V const, або P1 T1 const
P2 T2
Для даної маси газу відношення тиску газу до його температури стале, якщо об’єм газу не змінюється.
Приклад:
При сталому об’ємі і нормальному тиску ідеальний газ нагріли з 400 К до 500 К. Визначити тиск, який встановився в даній системі. (1,25 × 105 Па).
3. Швидкість молекул ідеального газу
Швидкість молекул:
Уже відзначалось, що молекули газів рухаються хаотично, тому можна говорити тільки про середню швидкість.
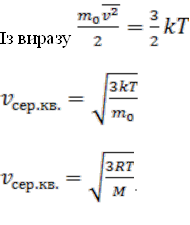 отримують формулу середньої квадратичної швидкості молекули . Для зручності домножують і ділять підкорінний вираз на NA. Тоді
отримують формулу середньої квадратичної швидкості молекули . Для зручності домножують і ділять підкорінний вираз на NA. Тоді
Задача з збірника задач Римкевич А.П. № 480
2) Підсумкова бесіда
Ізопроцеси – це процеси, що відбуваються при незмінному значенні одного із параметрів газу (P, V, T)
P1V1 P2V2
Об’єднаний газовий закон: T1 T2
|
|
Т=соnst |
|
Ізотермічний |
Закон Бойля-Маріотта P1 V2 const P2 V1 |
|
|
Р=соnst |
|
Ізобарний |
Закон Гей-Люссака V1 T1 const V2 T2 |
|
|
V=соnst |
|
Ізохорний |
Закон Шарля P1 T1 const P2 T2 |
VІI. Розв'язування задач.
Задачі з збірника задач Римкевич А.П. №522, 524, 529, 531, 532
1. За температури 294 К об’єм газу дорівнює 0,35 дм3. За якої температури об’єм тієї ж маси газу збільшиться до 0,4 дм3? Тиск газу вважайте постійним.
2. Тиск газу в балоні за 27 °С дорівнює 240 кПа. Яким стане тиск після нагріву газу до 100 °С?
3. На скільки градусів треба ізобарно нагріти газ, щоб він набув об’єму, удвічі більшого у порівнянні з об’ємом за 0 °С?
4. Об’єм газу в результаті ізобарного процесу зменшився на 10 л, а абсолютна температура знизилася в 1,2 рази. Визначте початковий об’єм газу.
5. Після збільшення абсолютної температури в 1,2 рази, об’єм газу збільшився на 0,6 л з постійним тиском. Знайдіть первинний об’єм газу.
6. При ізотермічному стисненні об’єм газу зменшився на 5 л, а тиск збільшився в 3 рази. Яким був початковий об’єм газу?
7. Тиск деякої маси ідеального газу збільшили ізотермічно вдвічі. Як при цьому змінилася густина газу?
8. Під час ізобарного нагрівання абсолютну температуру ідеального газу збільшили вдвічі. У скільки разів змінилася густина газу?
9. Об’єм бульбашки повітря в період спливання її з дна озера на поверхню вади збільшується в три рази. Яка глибина озера? Зміною температури з глибиною можна знехтувати.
VІІI.. Підсумки заняття
На цьому занятті ми ознайомилися з порняттям ізопроцесів, газовими законами закони
Оцінювання студентів ІХ. Домашнє завдання
Задача з збірника задач Римкевич А.П. № 511 (обов’язково) Задача з збірника задач № 514 (на вищу оцінку) Творче завдання:
Зобразити графіки ізотерми, ізобари, ізохори в координатах PV, PT, VT


про публікацію авторської розробки
Додати розробку
