Кількість речовини. Постійна Авогадро
План-конспект уроку фізики _________
в 10 класі
Тема. Кількість речовини. Постійна Авогадро
Мета уроку:
навчальна - ознайомити учнів з поняттям: «кількість речовини, одиниця кількості речовини, постійна Авогадро»
розвивальна – формувати в учнів вміння користуватися науково-популярною літературою та виявлення творчих здібностей при розв’язуваннні вправ;
виховна – виховати трудолюбивість, точність і чіткість при відповідях і розв’язуванні завдань та навчити дітей «бачити» фізику навколо себе
Тип уроку: вивчення нового матеріалу
План уроку
|
Контроль знань |
5 хв |
Основні положення МКТ та їх досліджені підтвердження. Що таке макроскопічні й мікроскопічні параметри? Наведіть приклади. У чому полягає основне завдання МКТ? |
|
Вивчення нового матеріалу |
ЗО хв |
Кількість речовини. Відносна молекулярна маса. Постійна Авогадро. Молярна маса |
|
Закріплення вивченого матеріалу |
10 хв |
Тренуємося розв’язувати задачі. Контрольні запитання |
Хід уроку
ІІ. Мотивація пізнавальної діяльності
ІІІ. Вивчення нового матеріалу
У минулому столітті італійський вчений Авогадро виявив дивний факт: якщо два різних гази знаходяться в посудинах з однаковим об’ємом, однаковою температурою й тиском, то в кожній посудині знаходиться одне і те ж число молекул. Зауважте, маси газів при цьому можуть відрізнятися дуже сильно: наприклад, якщо в одній посудині водень, а в іншому — кисень, маса кисню в 16 разів більше за масу водню. Це означає, що деякі, причому досить важливі, властивості тіла визначаються числом молекул у цьому тілі: число молекул виявляється навіть більш істотним, ніж маса.
^ Фізична величина, яка визначає число молекул у даному тілі, називається кількістю речовини й позначається літерою ν.
Так як маси окремих молекул відрізняються одна від одної, то однакові кількості різних речовин мають різну масу. Наприклад, 1025 молекул водню й 1025 молекул кисню вважаються однаковою кількістю речовини, хоча мають різні маси (33,45 г і 531,45 г відпоповідно). Таким чином, маса не є мірою кількості речовини. Одиницею кількості речовини є моль:
один моль — це кількість речовини, яка містить стільки ж молекул, скільки атомів вуглецю міститься в 12 г вуглецю.
Для більшості розрахунків (у тому числі під час вирішення завдань) можна прийняти, що один моль містить стільки ж молекул, скільки атомів водню міститься в 1 г водню.
2. Відносна молекулярна маса
Маси окремих молекул дуже малі. Наприклад, маса однієї молекули води близько 3 • 10-26 кг. Молекули інших речовин мають маси такого ж порядку. Так як маси молекул дуже малі, зручно використовувати в розрахунках не абсолютні значення мас, а відносні. За міжнародними стандартами маси всіх атомів і молекул порівнюють з 1/12 маси атома вуглецю. Головна причина такого вибору полягає в тому, що вуглець входить у велике число різних хімічних сполук. Однак для більшості розрахунків (у тому числі під час розв’язання задач) можна прийняти, що одна атомна одиниця маси (1 а.о.м.) дорівнює масі атома водню.
^ Масу молекули, виражену в атомних одиницях маси, називають відносною молекулярною масою. Відносна молекулярна маса позначається Мr.
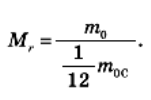 Відносна молекулярна маса Мr дорівнює відношенню маси молекули т0 даної речовини до 1/12 маси атома вуглецю тос :
Відносна молекулярна маса Мr дорівнює відношенню маси молекули т0 даної речовини до 1/12 маси атома вуглецю тос :
Аналогічно до відносної молекулярної маси визначається й відносна атомна маса, як маса атома, виражена в атомних одиницях маси. Значення відносної атомної маси для даної речовини можна знайти за допомогою таблиці Менделєєва, округливши наведене в ній значення до цілого.
Наприклад, відносні атомні маси гелію, вуглецю й кисню рівні відповідно 4, 12 і 16. Щоб визначити відносну молекулярну масу речовини, необхідно знати його хімічну формулу й відносні атомні маси атомів, що входять до складу молекули даної речовини.
Наприклад, відносна молекулярна маса води дорівнює 18, тому що відповідно до хімічної формули води (Н20), молекула води складається з двох атомів водню (з відносною атомною масою 1) і одного атома кисню (з відносною атомною масою 16).
3. Постійна Авогадро
Число N молекул, що містяться в тілі, пропорційне кількості речовини ν, що містяться в цьому тілі: N ~ ν. Коефіцієнт пропорційності називають постійної Авогадро й позначають NА.
^ Кількість молекул в одному молі називається постійною Авогадро: NА = 6,02 1023 г/моль.
Маса одного моля води, що містить NА молекул, дорівнює 18 г, а маса однієї молекули води дорівнює 18 а.о.м. Таким чином, постійна Авогадро є переказним множником між грамом і атомною одиницею маси: в одному грамі міститься атомних одиниць маси.
Так як постійна Авогадро чисельно дорівнює числу молекул в одному молі, то
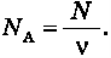
Якщо кількість речовини в даному тілі відома, то легко знайти число молекул N цьому тілі:
4. Молярна маса
^ Масу одного моля речовини називають молярної масою.
Маса т тіла пропорційна кількості речовини ν, що міститься в даному тілі. Тому відношення т/ ν характеризує речовину, з якої складається це тіло: чим «важчі» молекули речовини, тим більше це відношення.
![]()
^ Відношення маси речовини т до кількості речовини V називається молярною масою і позначається М:
Якщо взяти в цій формулі ν = 1, отримаємо, що молярна маса речовини чисельно дорівнює масі одного моля цієї речовини.
Одиницею виміру молярної маси в СІ є кг/моль, оскільки маса вимірюється в кілограмах, а кількість речовини — у молях. Наприклад, молярна маса водню дорівнює
М =2 г/моль = 2*10-3 кг/моль.
Якщо молярна маса М і кількість речовини відомі, можна знайти масу речовини:
т = ν М.
Знання постійної Авогадро дозволяє знайти масу однієї молекули. Дійсно, нехай дане тіло містить 1 моль речовини. Тоді маса тіла чисельно дорівнює М, а число молекул у ньому чисельно дорівнює Позначаючи масу однієї молекули т0, отримуємо
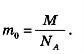
Можна сказати, що — це «місток» між макросвітом (світом оточуючих нас тіл) і мікросвітом (світом атомів і молекул). Якщо дане тіло містить ν молей речовини, то число молекул N у цьому тілі визначається виразом:
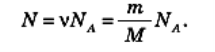
Відношення числа молекул N до об’єму V, займаному цими молекулами, називається концентрацією молекул і позначається п:
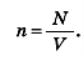
Концентрація молекул вимірюється в 1/м3.
Питання до учнів під час викладення нового матеріалу
- Чому молекулярна фізика використовує відносні величини для вимірювання маси?
- Виразіть у кг / моль молярну масу водню, кисню й вуглекислого газу.
- Яка відносна атомна маса атома водню? відносна молекулярна маса молекули водню? молекули води? молекули вуглекислого газу?
- Як можна обчислити масу молекули будь-якої речовини?
- Як знайти число молей речовини в тілі, якщо відома його маса?
- Як знайти число молей речовини в тілі, якщо відомо число частинок у ньому?
IV.ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
Тренуємося розв'язувати задачі
- Скільки молей міститься в 10 г кисню?
- Яка маса 2 молей води?
- Яка маса молекули вуглекислого газу?
-
Який об’єм займають 2 моля алюмінію?

- Маса якої молекули більша — аміаку (N113) чи азотної кислоти (НК03)?
Контрольні запитання
У чому вимірюють кількість речовини?
Скільки молекул в одному молі?
Як дізнатися відносну молекулярну масу речовини?
Як пов’язані маса молекули, молярна маса й постійна Авогадро?
Як визначити кількість молекул у даному тілі, якщо відомі маса тіла й молярна маса речовини?

Конспект.
Розв’язування задач:
р1):
- Яка молярна маса гелію? урану?
- Яка молярна маса міді? ртуті?
- Яка маса 50 моль вуглекислого газу?
- Яка маса атома літію? атома золота?
р2):
Відомо, що 1,51023 молекул газу мають масу 11г. Який це газ?
- Яку масу мають 3*1023 атомів ртуті?
- Чи вміститься в трилітровій банці 50 моль ртуті? Густина ртуті 13 600 кг/м3.
- У якому об’ємі води міститься 1018 молекул (вода знаходиться в рідкому стані)?
рЗ):
- Визначте густину кисню, якщо відомо, що в об’ємі л міститься 6*1022 його молекул.
- Скільки молекул азоту знаходиться в посудині об’ємом 7 л, якщо густина азоту 2 кг/м3?
- Яка товщина гасової плівки на поверхні води, якщо гас масою 1,6 г утворив плями площею 200 м2? Який висновок можна звідси зробити про розміри молекул? Густина гасу 800 кг/м3.
- Під час нікелювання виробу його покривають шаром нікелю товщиною 1,5 мкм. Скільки атомів нікелю міститься в покритті, якщо площа поверхні виробу дорівнює 800 см2? Густина нікелю 8 900 кг/м3.
- Д.: підготуватися до самостійної роботи «Основні положення МКТ».
1


про публікацію авторської розробки
Додати розробку
