Основне рівняння МКТ ідеального газу. Рівняння стану ідеального газу
План-конспект уроку фізики _________
в 10 класі
Тема. Основне рівняння МКТ ідеального газу. Рівняння стану ідеального газу
Мета уроку:
навчальна - з'ясувати механізм тиску ідеального газу і його залежність від мікропараметрів , одержати залежність між макроскопічними параметрами (р, V, Т), що характеризують стан газу
розвивальна – формувати в учнів вміння користуватися науково-популярною літературою та виявлення творчих здібностей при розв’язуваннні вправ;
виховна – виховати трудолюбивість, точність і чіткість при відповідях і розв’язуванні завдань та навчити дітей «бачити» фізику навколо себе
Тип уроку: вивчення нового матеріалу
План уроку
Хід уроку
ІІ. Мотивація пізнавальної діяльності
ІІІ. Вивчення нового матеріалу
1. Основне рівняння молекулярно-кінетичної теорії ідеального газу
Основне завдання молекулярно-кінетичної теорії газу полягає в тому, щоб встановити співвідношення між тиском газу і його мікроскопічними параметрами — масою молекул, їх середньою швидкістю і концентрацією. Це співвідношення називається основним рівнянням молекулярно-кінетичної теорії газу.
Оскільки тиск газу на стінку посудини зумовлений ударами молекул, тиск газу пропорційний концентрації молекул п: чим більше молекул в одиниці об’єму, тим більше ударів молекул об стінку за одиницю часу. Кожна молекула при ударі об стінку передає їй імпульс, пропорційний імпульсу молекули, рівному по модулю тп0о, де V — модуль швидкості молекули. Тому можна було б очікувати, що тиск пропорційний птпои, де и — середнє значення модуля швидкості молекул.
Однак, насправді тиск пропорційний не першому, а другому ступеню швидкості, так як, чим більша швидкість молекули, тим частіше вона б’ється об стінку посудини. І дійсно, розрахунки показують, що основне рівняння молекулярно-кінетичної теорії ідеального газу має вигляд:
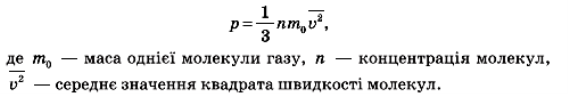
Отже, німецький физик Р. Клаузиус з’ясував, що тиск ідеального газу прямо пропорційний концентрації частинок, маси частки й середнього значення квадрата швидкості частинки.
Отримане рівняння пов’язує макроскопічну величину — тиск,— що може бути виміряна манометром, з мікроскопічними величинами, що характеризують молекули, і є ніби містком між двома світами: макроскопічним і мікроскопічним.
2. Зв'язок тиску з середньою кінетичною енергією молекули
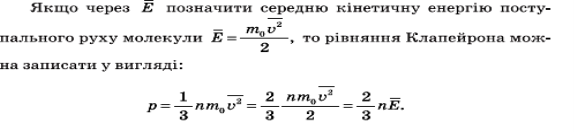
Тиск ідеального газу пропорційний добутку концентрації молекул на середню кінетичну енергію поступательного руху молекули У цій формулі концентрація часток характеризує число ударів молекул об поршень, а середня кінетична енергія молекул визначає інтенсивність одного удару.
Питання до учнів під час викладення нового матеріалу
- Який механізм виникнення тиску газу, з точки зору молеку- лярно-кінетичної теорії будови речовини?
- Чому можна вважати, що молекули в газі рухаються лише вздовж трьох взаємно перпендикулярних напрямів?
- У яких шарах атмосфери повітря зі своїми властивостями наближається до ідеального газу: біля поверхні Землі чи на далеких висотах?
3. Співвідношення Клапейрона
Величинами, що визначають стан газу, є: тискр, під яким знаходиться газ, його температура Т і об’єм V. їх називають параметрами стану. Перераховані три величини не є незалежними. Кожна з них є функцією двох інших. Рівняння, що зв’язує всі три параметри — тиск, об’єм і температуру газу для даної його маси,— називається рівнянням стану і може бути в загальному вигляді записано так:
P = f(V,T).
Це означає, що стан газу визначається тільки двома параметрами (наприклад, тиском і об’ємом, тиском і температурою або об’ємом і температурою), третій параметр, однозначно, визначається двома іншими. У першій половині 19-го століття французький фізик Клапейрон вивів співвідношення, що пов’язує ці три параметри — рівняння Клапейрона (рівняння стану для даної маси газу).
Для даної маси газу добуток тиску газу на його об’єм, поділено на абсолютну температуру газу, є величина постійна:
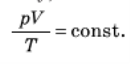
Якщо газ переводять зі стану 1 в стан 2, то параметри, які характеризують газ у кожному із станів, пов’язані виразом:
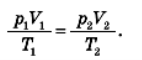
Використовуючи рівняння Клапейрона, можна довести, що всі три закони для ізопроцесів є приватними випадками цього рівняння.
Щоб переконатися в тому, що значення виразу pV/Т не завжди є постійним, наберіть повітря в щоки: одночасно збільшиться і тиск, і об’єм повітря в роті, а температура повітря залишиться практично незмінною (рівною температурі тіла). Отже, значення виразу pV/Т збільшилося. Причина в тому, що збільшилося число молекул газу.
Коли тиск і температура є постійними, об’єм газу пропорційний числу молекул N, тому значення виразу pV/Т пропорційне числу молекул N. Але чи однаковий коефіцієнт пропорційності для різних газів? Відповідь на це запитання дає закон, який був встановлений Авогадро:
^ при однакових температурі й тискові в рівних об’ємах різних газів міститься однакове число молекул.
Це означає, що 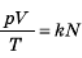 з одним і тим же коефіцієнтом пропорційності k для всіх газів. Цей коефіцієнт називають постійною Больцмана, начесть австрійського фізика, одного з творців молекулярно-кінетичної теорії.
з одним і тим же коефіцієнтом пропорційності k для всіх газів. Цей коефіцієнт називають постійною Больцмана, начесть австрійського фізика, одного з творців молекулярно-кінетичної теорії.
Вимірювання показали, що 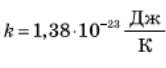
З рівняння 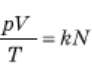 випливає, що тиск газу можна дуже просто виразити через концентрацію газу п і його абсолютну температуру. Ми отримаємо
випливає, що тиск газу можна дуже просто виразити через концентрацію газу п і його абсолютну температуру. Ми отримаємо 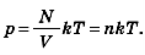
5. Рівняння Менделєєва –Клапейрона
Контрольні запитання
- Що ви розумієте під параметрами стану?
- Які параметри характеризують стан газу? Чи пов’язані вони між собою? Наведіть приклади.
- Яке співвідношення між тиском, об’ємом і температурою для даної маси газу? Як називають це співвідношення?
- Яка форма рівняння стану містить більше інформації: рівняння Клапейрона чи Менделєєва — Клапейрона?
- Чому газова постійна називається універсальною?
IV.ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
- Яким чином в основному рівнянні молекулярно-кінетичної теорії ми отримали множник 1/3?
- Чому молекула при зіткненні зі стінкою посудини діє на неї
- силою, пропорційною швидкості, а тиск пропорційно квадрату швидкості?
- Як середня кінетична енергія молекул залежить від концентрації газу та його тиску на стінки посудини?
- Що ми дізналися на уроці:
- Тиск ідеального газу прямо пропорційний концентрації часток, масі частки й середньому значенню квадрата швидкості частки.
Тренуємося розв'язувати задачі


- Чи змінюється тиск газу, розміщеного в непрохідній еластичній оболонці, якщо під час нагрівання газу від 250 К до 500 К його об’єм зріс в 1,5 рази?
- Після підвищення температури на 9 К тиск газу в закритому балоні збільшився на 3 %. Якою була початкова температура?
- У закритій посудині об’ємом 1 л міститься кисень масою 12 кг. Знайдіть його тиск за температури 20 °С.
- Рівняння Клапейрона: для даної маси газу добуток тиску газу на його об’єм, поділено на абсолютну температуру газу, є величина постійна:
- Закон Авогадро: за однакових температури й тискові в рівних об’ємах різних газів міститься однакове число молекул.
- Тиск газу можна виразити за рахунок концентрації газу і його абсолютної температури: р = пкТ.
- Модель реального газу, у якій нехтують розмірами молекул газу та їх взаємодією між зіткненнями, називають ідеальним газом.
-
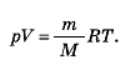 Рівняння Менделєєва — Клапейрона:
Рівняння Менделєєва — Клапейрона:
Конспект.
Розв’яжіть задачі:
р1): 1. Під час виготовлення ламп розжарювання їх балони заповнюють азотом під тиском, значно меншим за атмосферний. Чому?
2. У циліндрі під поршнем знаходиться певна маса ідеального газу. Його об’єм збільшився в 3 рази, а абсолютну температуру зменшили в 3 рази. У скільки разів змінився тиск газу?
3. У скільки разів змінився тиск ідеального газу в герметично закритому посуді, якщо його об’єм збільшили в 4 рази, а абсолютну температуру збільшили в 2 рази?
4. Газ за температури 37 °С із тиском 1,5 МПа має об’єм 10 л. Який об’єм цієї маси газу за нормальних умов?
р2):
- У паровому котлі об’ємом 2 м3 знаходиться водяна пара з температурою 200 °С і з тиском 1 МПа. Яка маса цієї пари?
- Яка маса повітря, що займає об’єм 150 л за температури 288 Кіз тиском 150 кПа?
- Як зміниться маса повітря в кімнаті, якщо в результаті несправності опалювальної системи температура в кімнаті понизиться від 20 до 7 С°? Об’єм кімнати 60 м3.
- Яка кількість речовини в газі, якщо за температури -13 °С і з тиском 500 кПа об’єм газу дорівнює ЗО л?
рЗ):
- У скільки разів густина вуглекислого газу відрізняється від густини азоту, якщо гази знаходяться в однакових умовах?
- Об’єм газу зменшили в 1,5 рази, у результаті чого абсолютна температура збільшилася на 20 %, а тиск — на 320 кПа. Яким був початковий тиск газу?
- Тиск газу під поршнем збільшився в 2 рази, об’єм зменшився в 3 рази, а абсолютна температура зменшилася на 20 %. Чи змінилася маса газу під поршнем? Якщо так, то на скільки відсотків?
- У балон об’ємом 8 л налили 10 г води. Потім балон герметично закрили й нагріли від 20 °С до 180. Вся вода випарувалася. Який тиск встановився всередині балона?
1


про публікацію авторської розробки
Додати розробку

