Класифікація хімічних реакцій
Про матеріал
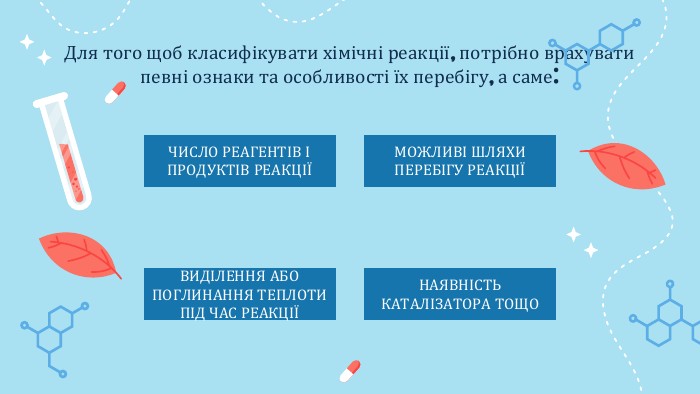
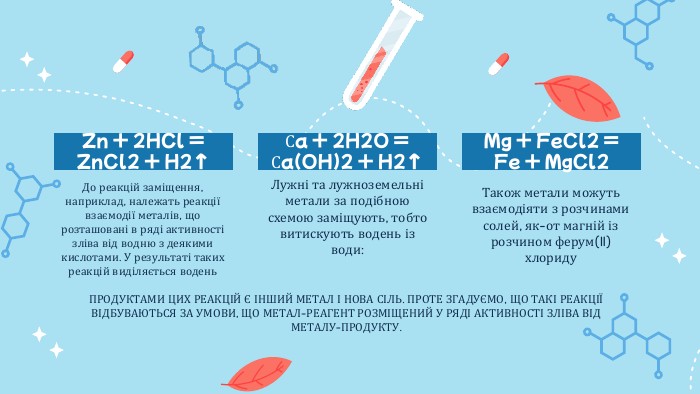
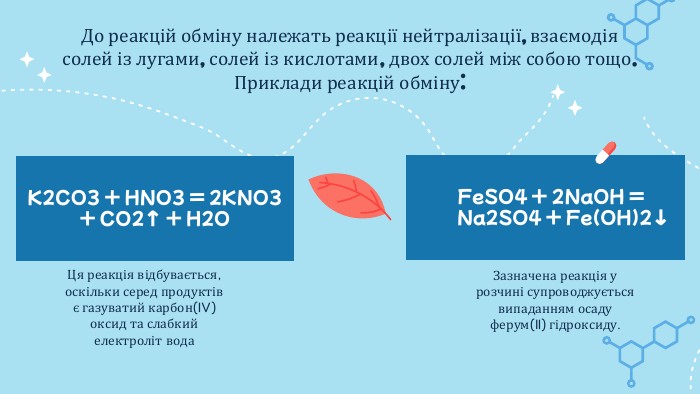
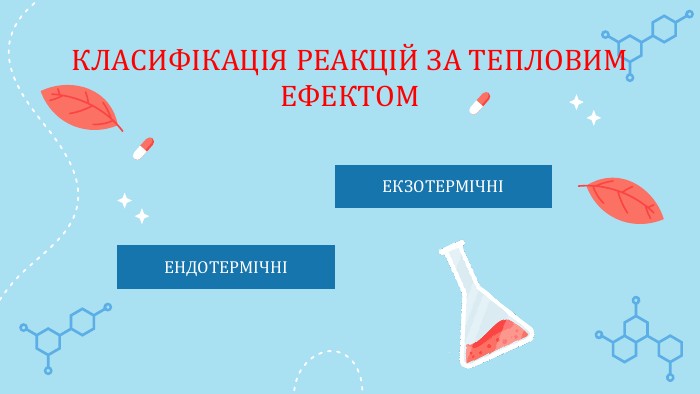
Класифікація хімічних реакцій\
Сьогодні на уроці ви зможете: поповнити свої знання про типи хімічних реакцій; пригадати випадки, коли реакції розкладу, заміщення та обміну є можливими.
Ви знаєте, що хімічні реакції можуть супроводжуватися зовнішніми ефектами — утворенням осаду чи газу, зміною кольору речовин або розчинів, виділенням теплоти тощо.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку