Комплекс вправ для 8 класу
|
Методичний комплекс різнорівневих вправ з хімії |
|
Батіг О.І., Галятовська Н.Б., Думас М.П., Деленко О.Л., Деленко С.П., Книш О.Р., Пальцева І.В., Петришак Н.Б., Харчина Л. |
|
8 КЛАС |
![]()

Батіг О.І., Галятовська Н.Б., Думас М.П., Деленко О.Л., Деленко С.П., Когут О.Р., Пальцева І.В., Петришак Н.Б., Харчина Л. – Сокаль, 2016 р.
Рецензент: Гібляк Г.В. – завметодкабінетом відділу освіти Сокальської РДА
Схвалено радою РМК (протокол № 06.2017 р.)
Даний посібник містить певний комплекс методичних різнопланових самостійних робіт для учнів 8 класу з хімії за новою програмою. Призначений для використання вчителями хімії.
© Батіг О.І., Галятовська Н.Б., Думас М.П., Деленко О.Л., Деленко С.П., Когут О.Р., Пальцева І.В., Петришак Н.Б., Харчина Л.М.
ПОЯСНЮВАЛЬНА ЗАПИСКА
Даний методичний посібник є результатом співпраці вчителів хімії Сокальського району у динамічній творчій групі протягом 2016 – 2017 навчального року та призначений для надання практичної допомоги вчителям хімії під час підготовки та проведення уроків згідно нової програми з курсу хімії для 8 класу. Програма розрахована на 70 уроків: з них 3 уроки відведено на вступ, 16 уроків – для вивчення теми «Періодичний закон і періодична система хімічних елементів. Будова атома», впродовж 11 уроків вивчатимуться теми «Хімічний зв'язок і будова речовини» та «Кількість речовини. Розрахунки за хімічними формулами», 29 уроків – тема «Основні класи неорганічних сполук». У кожній темі відведено час на представлення результатів навчальних проектів, підсумкову письмову роботу по темі та практичні роботи згідно вказаної у програмі тематики. У посібнику також передбачено 2 контрольних роботи протягом навчального року. На кожний урок, крім уроків-захистів тематичних проектів, розроблено комплекс завдань різного плану. Це і хімічні диктанти, ігри, тестові завдання, складання таблиць та схем, завдання на відповідність, різноманітні кластери та навчальні ігри. Для запланованих уроків-семінарів та уроків письмового контролю у кожній темі розроблено по 4-5 варіантів різнорівневих завдань, вказано, як їх оцінювати. У даному посібнику цього року у теми окремих уроків включено опорні схеми, додано кластери та ситуативні задачі.
Всі завдання складено за сучасними методичними вимогами із використанням різних методів навчання та форм проведення уроків. З інтерактивних методів навчання використано вправи «шифрувальник», «кольорова стрічка», гра «Вірю – не вірю», групова робота тощо. Особистісно орієнтоване навчання спонукає вчителя до використання рольових ігор, нестандартних уроків та індивідуального підходу до оцінювання учнів. На деяких уроках передбачене самооцінювання учнів, зокрема, коли вони виконують вправи на закінчення речень, вставляння пропущених у реченнях слів або виконання вправи «Хімічний диктант».
Ці завдання не обов’язково вчитель може використати на уроці усі. Вони використовуються відповідно до того, як вчитель спланує свій урок. Їх можна використати на різних етапах уроку: на етапі актуалізації опорних знань (фронтальні бесіди, індивідуальні завдання біля дошки, самостійні роботи та тестові завдання для цілого класу, за якими вчителю легко перевірити та оцінити підготовку та виконання учнями домашнього завдання), на етапі вивчення нового матеріалу (різні опорні схеми для вивчення фізичних та хімічних властивостей речовин, галузей застосування чи поширення у природі, використання різноманітних таблиць, які на уроці вчитель може дати заповнювати учням самостійно, використовуючи матеріал з підручника), на етапі закріплення знань (відтворення та усвідомлення вивченого на уроці матеріалу через використання вправ, деяких типів задач, самостійних робіт, схематичних перетворень та фронтальних бесід).
Завдання для уроків контролю складено за рівнями навченості, деякі – у формі тестового контролю, тестів. Крім залікових робіт, у конспекти уроків включені дві контрольні роботи: кожна – на один семестр. Перша контрольна робота є підсумковою у темі «Хімічний зв'язок» вкінці І семестру, друга – подається у темі «Основні класи неорганічних сполук» вкінці ІІ семестру.
Календарно-тематичне планування для 8 класу
(2 години в тиждень, 70 годин, з них 10 - резервні)
|
№ ур. |
дата |
Тема уроку |
Мета |
Державні вимоги до рівня загальноосвітньої підготовки учнів. |
|
1. |
|
Повторення найважливіших питань курсу хімії 7 класу (3 год.) Правила ТБ. Найважливіші хімічні поняття. Масові частки. |
Актуалізувати знання про основні поняття: речовина, матеріал, суміш, хімічні формули, атоми, молекули, масові частки. |
Учень/учениця: називає хімічні елементи (не менше 20-ти) за сучасною науковою українською номенклатурою, записує їхні символи; наводить приклади (формули і назви) простих (метали і неметали) і складних речовин (оксидів, основ, кислот); рівнянь реакцій: добування кисню з гідроген пероксиду; кисню з воднем, вуглецем, сіркою, магнієм, залізом, міддю, метаном, гідроген сульфідом, води з кальцій оксидом, натрій оксидом, фосфор(V) оксидом, карбон(ІV) оксидом; реакцій розкладу і сполучення; обчислює відносну молекулярну масу речовини за її формулою, масову частку елемента в складній речовині; масову частку і масу розчиненої речовини в розчині |
|
2. |
|
Валентність. |
Повторити знання про валентність. |
|
|
3. |
|
Хімічні рівняння. |
Повторити і узагальнити знання про Мг, формули, рівняння. |
|
|
4. |
|
Тема1. Періодичний закон і періодична система хімічних елементів. Будова атома (14 + 2 год). Короткі історичні відомості про спроби класифікації хімічних елементів. |
Повторити знання про елементи, наголосити про необхідність класифікації елементів |
Учень/учениця: формулює означення періодичного закону; описує структуру періодичної системи (періоди: великі й малі, групи й підгрупи (А і Б); наводить приклади ізотопів, лужних, інертних елементів, галогенів; розрізняє атомне ядро, електрони, протони, нейтрони; періоди (великі й малі), головні (А) та побічні (Б) підгрупи періодичної системи; металічні та неметалічні елементи; характеризує склад ядер (кількість протонів і нейтронів у нукліді), розподіл електронів (за енергетичними рівнями та підрівнями) в атомах перших 20 хімічних елементів; хімічний елемент (№ 1–20) за його положенням у періодичній системі, зміни радіусів атомів у періодах і підгрупах, металічних і неметалічних властивостей елементів; пояснює періодичність зміни властивостей хімічних елементів (№ 1–20); залежність характеру елементів та властивостей їхніх сполук від електронної будови атомів; аналізує інформацію, закладену в періодичній системі, та використовує її для характеристики хімічного елемента; обґрунтовує фізичну сутність періодичного закону; записує: електронні та графічні електронні формули атомів 20 хімічних елементів; використовує інформацію, закладену в періодичній системі, для класифікації елементів (металічний або неметалічний), та визначення їхньої валентності, класифікації простих речовин (метал або неметал), визначення хімічного характеру оксидів (кислотний, амфотерний, оснόвний), гідратів оксидів (кислота, амфотерний гідроксид, основа), сполук елементів з Гідрогеном; оцінює наукове значення періодичного закону; значення прийому класифікації в науці |
|
5. |
|
Поняття про лужні, інертні елементи, галогени. |
Пояснити принцип поділу елементів на природні групи, звернути увагу на їх властивості |
|
|
6.
|
|
Періодичний закон Д.І. Мендєлєєва. |
Дати формулювання ПЗ, показати ПЗ як приклад наукового підходу до пізнання навколишнього світу |
|
|
7. |
|
Структура періодичної системи хімічних елементів. |
Систематизувати знання учнів про періодичність змін властивостей, вивчити структуру ПС |
|
|
8. |
|
Будова атома. Склад атомних ядер (протони і нейтрони). |
Вивчити склад атомних ядер, повторити будову атома. |
|
|
9. |
|
Протонне число. Нуклонне число. Нуклід. |
Формувати уявлення про атоми та молекули, про будову атома Е.Резерфорда. |
|
|
10. |
|
Ізотопи. Сучасне формулювання періодичного закону. |
Дати уявлення про сучасне формулювання ПЗ та ізотопи. |
|
|
11. |
|
Самостійна робота з теми «ПС і ПЗ (І частина)». |
Контроль знань з теми |
|
|
12. |
|
Будова електронних оболонок атомів хімічних елементів 1-3 періодів і К, Са. |
Вивчити будову атома, формувати вміння визначати кількість енергетичних оболонок елементів |
|
|
13. |
|
Стан електронів в атомі. Електронні орбіта лі. |
Сформувати уявлення про хвильовий характер руху електрона, орбіталь, енергетичний рівень та підрівень |
|
|
14. |
|
Енергетичні рівні та підрівні; їх заповнення електронами в атомах елементів №1-№20. |
Сформувати уявлення про правила заповнення рівнів, навчити складати електронні конфігурації атомів |
|
|
15. |
|
Електронні та графічні електронні формули атомів. Поняття про радіус атомів. |
Сформувати уявлення про атомний радіус, електронегативність, пояснити періодичність змін |
|
|
16. |
|
Періодична система хімічних елементів з позиції теорії будови атома. |
Пояснити важливість періодичної системи для пізнання наукової картини світу |
|
|
17. |
|
Характеристика хімічних елементів №1-№20 за їх місцем у періодичній системі та будовою атома. Значення періодичного закону. |
Розглянути план-характеристику елемента за його положенням у ПС, звернути увагу на велике наукове значення ПЗ, |
|
|
18. |
|
Залікова робота з теми «Періодичний закон і періодична система хімічних елементів» |
Контроль знань з теми. |
|
|
19. |
|
Представлення результатів навчальних проектів. 1. З історії відкриття періодичної системи хімічних елементів. 2. Форми періодичної системи хімічних елементів |
Формування інформаційної компетентності. |
|
|
20. |
|
Тема 2. Хімічний зв'язок і будова речовини (9 + 2 год.) Природа хімічного зв'язку. Електронегативність елементів. |
Сформувати уявлення про природу хімічного зв’язку, вивчити поняття електронегативності. |
Учень/учениця: називає: види хімічного зв’язку, типи кристалічних ґраток; наводить приклади: сполук із ковалентним (полярним і неполярним) та йонним хімічним зв’язком, атомними, молекулярними та йонними кристалічними ґратками; розрізняє: валентність і ступінь окиснення елемента; пояснює: утворення йонного, ковалентного (полярного і неполярного) зв'язків; характеризує: особливості ковалентного та йонного зв’язків, кристалічної будови речовин з різними видами хімічного зв'язку; обґрунтовує: природу хімічних зв'язків; фізичні властивості речовин залежно від їхньої будови; прогнозує: властивості речовин залежно від виду хімічного зв'язку і типу кристалічних ґраток; визначає: ступені окиснення елементів у сполуках за їх формулами, вид хімічного зв’язку в типових випадках, полярність ковалентного зв'язку; складає: електронні формули молекул, хімічні формули бінарних сполук за ступенями окиснення елементів; використовує: поняття електронегативності для характеристики хімічних зв'язків |
|
21. |
|
Ковалентний зв'язок, його утворення. |
Показати зв'язок між будовою атома та утворенням зв’язку в молекулі |
|
|
22. |
|
Полярний і неполярний ковалентний зв'язок. |
Вивчити механізм утворення ковалентних зв’язків |
|
|
23. |
|
Електронні формули молекул. Йони. Йонний зв'язок, його утворення. |
Вивчити механізм утворення зв’язку |
|
|
24. |
|
Ступінь окиснення. Визначення ступеня окиснення за хімічною формулою сполуки. |
Порівняти СО та валентність елементів. Навчити визначати СО та складати формули за відомими СО |
|
|
25.
|
|
Складання формули сполуки за відомими ступенями окиснення елементів. |
Закріпити вміння визначати СО та складати формули за відомими СО |
|
|
26. |
|
Кристалічні гратки. Атомні, молекулярні та йонні кристали. |
Вивчити типи кристалічних ґраток, звернути увагу на йонні кристали. |
|
|
27. |
|
Залежність фізичних властивостей речовин від типів кристалічних ґраток. |
Узагальнити та систематизувати вивчене про залежність фізичних властивостей речовин від типів кристалічних ґраток. |
|
|
28. |
|
Самостійна робота з теми «Хімічний зв'язок і будова речовини» |
Контроль знань з теми. |
|
|
29. |
|
Представлення результатів навчальних проектів. 3. Залежність фізичних властивостей речовин від типів кристалічних граток. |
Формування інформаційної компетентності. |
|
|
30. |
|
Контрольна робота №1 з тем «ПЗ» і «Хімічний зв'язок» |
Контроль знань з тем. |
|
|
31. |
|
Тема 3. Кількість речовини. Розрахунки за хімічними формулами (9 + 2 год.) Кількість речовини. Моль – одиниця кількості речовини. Число Авогадро. |
Сформувати поняття про кількість речовини та одиницю виміру – моль, з’ясувати значення сталої Авогадро, вміння розраховувати число молекул за відомою кількістю речовини, і навпаки |
Учень/учениця: називає: одиницю вимірювання кількості речовини, молярний об’єм газів за нормальних умов, число Авогадро; пояснює: сутність фізичної величини кількість речовини; встановлює: взаємозв'язок між фізичними величинами (масою, молярною масою, об’ємом, молярним об’ємом, кількістю речовини); обчислює: число частинок (атомів, молекул, йонів) у певній кількості речовини, масі, об’ємі; молярну масу, масу і кількість речовини; об’єм даної маси або кількості речовини газу за нормальних умов; відносну густину газу за іншим газом |
|
32. |
|
Розрахункові задачі. 1. Обчислення числа частинок (атомів, молекул, йонів) у певній кількості речовини. |
Закріпити знання про зв'язок між кількістю речовини і кількістю частинок, вміння рахувати кількість речовини за відомою масою і навпаки |
|
|
33. |
|
Самостійна робота з обчислення числа частинок (атомів, молекул, йонів) у певній кількості речовини. |
Узагальнити і систематизувати знання кількість речовини, розвивати навички розв’язування задач |
|
|
34.
|
|
Молярна маса. Обчислення маси. |
Формувати навички розв’язування задач з використанням кількості речовини, маси, М. |
|
|
35. |
|
Розрахункові задачі. 2. Обчислення за хімічною формулою маси даної кількості речовини і кількості речовини за відомою масою. |
Формувати навички розв’язування задач з використанням кількості речовини, маси, М. Вчити аналізувати умови задач і раціональні шляхи їх вирішення |
|
|
36. |
|
Закон Авогадро. Молярний об’єм газів. Обчислення об’єму. |
Ввести поняття молярного об’єму газів, вивести формулу обчислення кількості речовини з використанням молярного об’єму газів, формувати навички розв’язування задач з використанням об’єму газів за н.у. |
|
|
37. |
|
Розрахункові задачі. 3. Обчислення об’єму газу за н.у. |
Формувати навички розв’язування задач з використанням об’єму газів за н.у, кількості речовини, маси, М. Вчити аналізувати умови задач і раціональні шляхи їх вирішення |
|
|
38. |
|
Відносна густина газів. Обчислення з використанням відносної густини газів. |
Формувати уявлення про відносну густину газів, уміння обчислювати відносну густину газів, розв’язувати задачі, розвивати вміння порівнювати речовини за Д. |
|
|
39. |
|
Розрахункові задачі. 4. Обчислення з використанням відносної густини газів. |
Формувати уявлення про відносну густину газів, уміння обчислювати відносну густину газів, розв’язувати задачі, розвивати вміння порівнювати речовини за Д. |
|
|
40. |
|
Узагальнюючий урок з теми «Кількість речовини» |
Узагальнити та систематизувати знання з теми «Кількість речовини» |
|
|
41. |
|
Залікова робота з теми «Кількість речовини. Розрахунки за хімічними формулами» |
Контроль знань з теми |
|
|
42. |
|
Тема 4. Основні класи неорганічних сполук (25 +4 год.) Класифікація неорганічних сполук, їхній склад і номенклатура. |
Дати уявлення про особливості складу неорганічних речовин |
Учень/учениця: називає оксиди, основи, кислоти, амфотерні гідроксиди, середні солі за сучасною науковою українською номенклатурою, індикатори (лакмус, метиловий оранжевий, фенолфталеїн, універсальний індикатор); описує поширеність представників основних класів неорганічних сполук у природі; наводить приклади оснόвних, кислотних і амфотерних оксидів, оксигеновмісних і безоксигенових, одно-, дво-, триосновних кислот, розчинних і нерозчинних основ, амфотерних гідроксидів, середніх солей; класифікує неорганічні сполуки за класами; розрізняє несолетворні (CO, N2O, NO, SiO) й солетворні оксиди (кислотні, основні, амфотерні), розчинні й нерозчинні основи, кислоти за складом (оксигеновмісні, безоксигенові) та основністю (одно-, дво-, триосновні), середні солі; реакції заміщення, обміну, нейтралізації; характеризує поняття амфотерності, фізичні та хімічні властивості оксидів, основ, кислот, солей, амфотерних гідроксидів; порівнює за хімічними властивостями основні, кислотні та амфотерні оксиди, луги і нерозчинні основи; встановлює генетичні зв’язки між простими і складними речовинами, основними класами неорганічних сполук; обґрунтовує залежність між складом, властивостями та застосуванням неорганічних речовин; прогнозує перебіг хімічних реакцій солей і кислот з металами, використовуючи ряд активності; складає хімічні формули оксидів, основ, кислот, середніх солей; рівняння реакцій, які характеризують хімічні властивості оснόвних, кислотних та амфотерних (Алюмінію, Цинку) оксидів (взаємодія з водою, кислотами, лугами, іншими оксидами (для алюміній і цинк оксидів у розчині та під час сплавляння), лугів (взаємодія з кислотними оксидами, кислотами та солями в розчині), нерозчинних основ (взаємодія з кислотами, розкладання під час нагрівання), кислот (взаємодія з металами, основними оксидами, основами та солями), середніх солей (взаємодія з металами, кислотами – хлоридною, сульфатною, нітратною, лугами, солями); способи добування оксидів (взаємодія простих і складних речовин із киснем, розкладання нерозчинних основ, деяких кислот і солей під час нагрівання), лугів (взаємодія лужних і лужноземельних (крім магнію) металів із водою, оксидів лужних і лужноземельних елементів із водою) й нерозчинних основ (взаємодія солей із лугами), кислот (взаємодія кислотних оксидів із водою, неметалів із воднем, солей із кислотами), середніх солей (взаємодія кислот із металами, основних оксидів із кислотами, кислотних оксидів з лугами, лугів із кислотами, солей із кислотами, солей із лугами, кислотних оксидів з основними оксидами, солей із солями, солей із металами (реакції здійснюють у розчинах), металів із неметалами), амфотерних гідроксидів (Алюмінію, Цинку) (взаємодія солей із лугами); використовує сучасну українську номенклатуру основних класів неорганічних сполук; таблицю розчинності кислот, основ та солей для складання рівнянь хімічних реакцій; індикатори для виявлення кислот і лугів; обчислює за рівняннями хімічних реакцій масу, кількість речовини та об’єм газу (н. у.) за відомою масою, кількістю речовини, об’єму одного з реагентів чи продуктів реакції; планує експеримент, проводить його, описує спостереження, робить висновки; розв’язує експериментальні задачі; висловлює судження про значення хімічного експерименту як джерела знань; про вплив речовин на навколишнє середовище і здоров’я людини; оцінює значення найважливіших представників основних класів неорганічних сполук; дотримується запобіжних заходів під час роботи з кислотами і лугами |
|
43. |
|
Склад і номенклатура оксидів. |
Формувати поняття про назви і класифікацію оксидів. |
|
|
44. |
|
Склад і номенклатура основ. |
Формувати поняття про назви і класифікацію основ |
|
|
45. |
|
Склад і номенклатура кислот. |
Формувати поняття про назви і класифікацію кислот |
|
|
46. |
|
Склад і номенклатура солей. |
Формувати поняття про назви і класифікацію солей |
|
|
47. |
|
Фізичні властивості оксидів. |
Ознайомити з фізичними властивостями оксидів. |
|
|
48. |
|
Хімічні властивості основних та кислотних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами. |
Формувати вміння писати хімічні рівняння, реакції обміну |
|
|
49. |
|
Хімічні властивості амфотерних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами. |
Форм. вміння писати хімічні рівняння, вивчити хім. в-ті амфотерних оксидів, порівняти з іншими оксидами |
|
|
50. |
|
Фізичні властивості основ. Заходи безпеки під час роботи з лугами. Розрахункові задачі. 5. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції. |
Пояснити алгоритм розв’язування задач за рівняннями: маси, об’єму, кількості речовини |
|
|
51. |
|
Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Реакція нейтралізації. |
Вивчити хімічні властивості лугів, поглиблювати вміння писати хімічні реакції. |
|
|
52. |
|
Хімічні властивості нерозчинних основ: взаємодія з кислотами і розкладання внаслідок нагрівання. |
Вивчити хімічні властивості основ, поглиблювати вміння писати хімічні реакції. |
|
|
53. |
|
Самостійна робота з теми «Основні класи неорганічних сполук (І частина)» |
Контроль знань з теми |
|
|
54.
|
|
Фізичні властивості кислот. Заходи безпеки під час роботи з кислотами. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції. |
Вчити використовувати алгоритм розв’язування задач за рівняннями: маси, об’єму, кількості речовини |
|
|
55 |
|
Хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами, солями. |
Вивчити хімічні властивості кислот, поглиблювати вміння писати хімічні реакції. |
|
|
56 |
|
Ряд активності металів. Реакції заміщення й обміну. |
Формувати вміння писати хімічні рівняння, реакції обміну та заміщення |
|
|
57 |
|
Фізичні властивості середніх солей. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції. |
Закріпити використання алгоритму розв’язування задач за рівняннями: маси, об’єму, кількості речовини |
|
|
58 |
|
Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями. |
Вивчити хімічні властивості середніх солей, поглиблювати вміння писати хімічні реакції. |
|
|
59 |
|
Поняття про амфотерні гідроксиди. |
Вивчити властивості амфотерних гідроксидів. |
|
|
60 |
|
Практична робота №1. Дослідження властивостей основних класів неорганічних сполук. |
Практично застосувати знання для дослідження властивостей основних класів неорганічних сполук. |
|
|
61 |
|
Загальні способи добування оксидів, кислот. |
Закріпити уявлення про способи добування оксидів та кислот з простих та складних речовин. |
|
|
62 |
|
Загальні способи добування основ і середніх солей. |
Закріпити уявлення про способи добування основ та солей з простих та складних речовин. |
|
|
63 |
|
Генетичні зв’язки між основними класами неорганічних сполук. |
Закріпити знання про утворення складних неорганічних речовин з простих та складних. |
|
|
64 |
|
Генетичні зв’язки між основними класами неорганічних сполук. |
Закріпити знання про утворення складних неорганічних речовин з простих та складних. |
|
|
65 |
|
Генетичні зв’язки між основними класами неорганічних сполук. |
Закріпити знання про утворення складних неорганічних речовин з простих та складних. |
|
|
66 |
|
Практична робота №2. Розв’язування експериментальних задач. |
Практично застосувати знання для розв’язування експериментальних задач. |
|
|
67 |
|
Поширеність у природі та використання оксидів, кислот, основ і середніх солей. |
Дати уявлення про поширеність неорганічних речовин у природі та їх використання людиною. |
|
|
68 |
|
Контрольна робота №2 з теми «Основні класи неорганічних сполук» |
Контроль знань з теми «Основні класи неорганічних сполук». |
|
|
69 |
|
Представлення результатів навчальних проектів. 4. Сполуки основних класів у будівництві й побуті. 5. Хімічний склад і використання мінералів. 6. Вирощування кристалів солей. 7. Вплив хімічних сполук на довкілля і здоров’я людини. |
Формування інформаційної компетентності. |
|
|
70 |
|
Підсумковий урок. Вплив речовин на довкілля. |
Повторити вивчене |
|
Урок 1. Правила ТБ. Найважливіші хімічні поняття. Масові частки.
- Тестова самостійна робота з теми «Початкові хімічні поняття. Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів»
У завданнях може бути одна або кілька відповідей ( 1 бал за кожне завдання)
І варіант
- До складу силіцій (ІV) оксиду входять атоми Силіцію та Оксигену. Формула речовини
A SiO В SiO2
Б SiO3 Г SiO4
- До складу магній нітриду входять атоми Магнію та Нітрогену (III). Формула речовини
A Mg3N2 В MgN
Б Mg3N Г MgN2
- До складу бор оксиду входять атоми Бору та Оксигену. Формула речовини
А ВО В В2О
Б ВО3 Г В2О3
- До складу карбон(ІІ) оксиду входять атоми Карбону та Оксигену. Формула цієї речовини
А СО2 В С2О2
Б СО Г С2О
- До складу ванадій (V) оксиду входять атоми Ванадію та Оксигену. Формула цієї речовини
А V2O5 В V5O
Б VO5 Г V2O3
- До складу фосфор (ІІІ) оксиду входять атоми Фосфору та Оксигену. Формула цієї речовини
А РО2 В Р2O3
Б РО3 Г Р3O
- До складу ферум(ІІІ) оксиду входять атоми Феруму та Оксигену. Формула цієї речовини
A FeО3 В Fe3О
Б FeО2 Г Fe2О3
- До складу алюміній сульфіду входять атоми Алюмінію та Сульфуру (II).Формула цієї речовини
A A13S2 Б A12S3
В A1S3 Г A13S
- Складіть формулу натрій оксиду, до складу якого входять Натрій та Оксиген. У формулі сума індексів становить
А 5 В 2
Б 4 Г 3
- Складіть формулу сульфур(УІ) оксиду, до складу якого входять атоми Сульфуру та Оксигену. У формулі сума індексів становить
В 3 Г 6
ІІ варіант
У завданнях може бути одна або кілька відповідей
- До складу алюміній оксиду входять атоми Алюмінію та Оксигену. Формула речовини
А АlO В А12O
Б Al2O3 І А1O3
- До складу кальцій хлориду входять атоми Кальцію і Хлору. Формула речовини
А СаС12 В СаСІ
Б Са9С1 Г СаС19
- До складу натрій оксиду входять атоми Натрію та Оксигену. Формула речовини
A Na2O В NaO
Б NaО2 Г Na3O
- До складу сульфур (VІ) оксиду входять атоми Сульфуру та Оксигену. Формула цієї речовини
A S2O3 В SO6
Б S2O6 Г SO3
- До складу карбон (ІV) оксиду входять атоми Карбону та Оксигену. Формула цієї речовини
А СO4 В С4O
Б СO2 Г С4O2
- До складу фосфор (V) оксиду входять атоми Фосфору та Оксигену. Формула речовини
А Р2О5 В Р5О2
Б РО5 Г Р5О
- До складу манган (VІІ) оксиду входять атоми Мангану та Оксигену. Формула цієї речовини
А МnO4 В МnO7
Б Мn7O2 Г Мn2O7
- До складу ферум(ІІІ) оксиду входять атоми Феруму та Оксигену. Формула цієї речовини
A Fe3O2 В Fe2O3
Б FeO3 Г FeO4
- Складіть формулу бор оксиду, до складу якого входять Бор та Оксиген. У формулі сума індексів становить
А 5 В 2
Б 4 Г 3
- Складіть формулу ванадій (V) оксиду, до складу якого входять атоми Ванадію та Оксигену. У формулі сума індексів становить
А 8 В 2
Б 7 Г 6
2. Гра «Хрестики-нулики»
а) Розв’язок — прості речовини.
|
Cu |
Cl2 |
SО3 |
|
CuCl2 |
О3 |
H3PО4 |
|
HC1 |
CC14 |
Na |
б) Розв’язок — складні речовини.
|
CuO |
Cl2 |
S8 |
|
CuCl2 |
SO3 |
H2SO4 |
|
H2 |
CC14 |
Na |
3. Самостійна робота. Початкові хімічні поняття
Варіант І
Початковий рівень
1. Вкажіть відносну атомну масу Хлору:
А 73 Б 36,5 В 35,5 Г 71
2. Вкажіть просту речовину:
А кисень Б вода
В вуглекислий газ Г кухонна сіль
3. Напишіть формулу речовини, молекула якої складається з трьох атомів Гідрогену, одного атома Фосфору і чотирьох атомів Оксигену. До простих чи складних речовин вона належить?
Середній рівень
- Установіть відповідність між назвою хімічного елемента, його відносною атомною масою, символом і назвою простої речовини, яку він утворює:
Купрум 207 Рb кисень
Оксиген 64 Сu мідь
Плюмбум 16 О свинець
5. Користуючись періодичною системою, укажіть максимальне значення валентності Карбону, Брому і Стануму.
6. Укажіть, у скільки разів відносна атомна маса хімічного елемента з порядковим номером 16 більша за відносну атомну масу хімічного елемента з порядковим номером 8:
А у 2рази Б у 4рази В у 3 рази Г у 5разів
Достатній рівень
7. Укажіть відповідність між формулою речовини і значенням валентностей хімічних елементів, які її утворюють:
Формула Валентність
1 P2O5 А II і II
2 Н2О Б І і II
3 SO, В V і II
4 СО Г IV і II
Д III і II
8. Що має більшу масу: три атоми хімічного елемента, який розміщений у головній підгрупі IV групи 2 періоду періодичної системи, чи два атоми хімічного елемента з порядковим номером 12?
Високий рівень
9. Складіть формули хімічних речовин за валентністю хімічних елементів:
IV VII II V II III І
PbO, MnO, CO, PS, NaP, ZnO, NaCl
Варіант II
Початковий рівень
1. Вкажіть відносну атомну масу Оксигену
А 16 Б 32 В 48 Г8
2. Вкажіть органічну речовину:
А сода Б срібло В цукор Г вапно
- Напишіть формулу речовини, молекула якої складається з двох атомів Гідрогену, одного атома Сульфуру і чотирьох атомів Оксигену. До простих чи складних речовин вона належить?
Середній рівень
- Установіть відповідність між назвою хімічного елемента, його відносною атомною масою, символом і назвою простої речовини, яку він утворює:
Карбон 1 Ag срібло
Гідроген 108 Н вуглець
Аргентум 12 С водень
5. Користуючись періодичною системою, укажіть максимальне значення валентності Бору, Сульфуру і Плюмбуму.
6. Укажіть, у скільки разів відносна атомна маса хімічного елемента з порядковим номером 29 більша за відносну атомну масу хімічного елемента із порядковим номером 16:
А у 2 рази Б у 3 рази В у 4 рази Г у 6 разів
Достатній рівень
7. Укажіть відповідність між формулою речовини і значенням валентностей хімічних елементів, які її утворюють:
Формула Валентність
1 NH3 А IV і II
2 SiO2, Б III і II
3 В2О3 В II і III
4 СІ2О Г III і І
Д І і II
8. Що має більшу масу: три атоми хімічного елемента, який розміщений у головній підгрупі III групи 3 періоду періодичної системи, чи два атоми хімічного елемента з порядковим номером 11?
Високий рівень
9. Складіть формули хімічних речовин за валентністю хімічних елементів:
IV VII II V І III II І
SnO, СlO NO, PCI, KN, CuO, KBr
4. Самостійна робота. Масова частка елементів у складній речовині
Початковий рівень
- Укажіть, яку букву використовують для позначення масової частки елемента у складній речовині:
A) w Б) Мr В) Аr Г) n
- Укажіть суму масових часток всіх хімічних елементів у речовині:
А 1 Б 10 В 100 Г 1000
Середній рівень
- Визначте масові частки хімічних елементів у молекулі SО2.
Достатній рівень
- Певна кількість силікатної кислоти H2SiО3 складається з 1 г Гідрогену, 14 г Силіцію і 24 г Оксигену. Обчисліть масові частки хімічних елементів у силікатній кислоті.
Високий рівень
- У зразку залізної руди масова частка Феруму у вигляді мінералу магнетиту Fe3О4 становить 60%. Яка масова частка магнетиту у цій руді?
- Обчисліть масу мангану, який можна добути із 20 т руди, що містить 14% манган (ІV) оксиду МnO2.
5. Розв’язування задач
1. У поданому переліку назвіть речовину, в якій масова частка Фосфору найбільша: РН3, РС13, Р2O5, Н3РO4, РС15, Са3(РO4)2.
2. Розташуйте формули речовин у порядку зменшення масової частки Оксигену: N2O5, NO2, N2O3, N2O, N2O4, NO.
3. У 50 г речовини міститься 24 г Оксигену. Знайдіть масову частку Оксигену в речовині.
4. Масова частка Гідрогену в деякій сполуці становить 25%. У якій масі сполуки міститься 40 г Гідрогену?
5. Масова частка Алюмінію в його сполуці з Оксигеном становить 52,94%. Яка маса Алюмінію міститься в 300 г сполуки?
6. Прореагували 56 г заліза і 32 г сірки. Яка масова частка Феруму та Сульфуру в утвореній сполуці?
7. Деяка хімічна сполука містить 10 г кальцію, 3 г вуглецю і 12 г кисню. Обчисліть масові частки Кальцію, Карбону та Оксигену у цій сполуці.
6. Самостійна робота. Початкові хімічні поняття
І варіант
Початковий рівень
1. Яку частинку називають атомом?
2. Укажіть рядок, у якому мова йде про просту речовину:
А молекула кисню складається з двох атомів Оксигену;
Б молекула води складається з двох атомів Гідрогену і одного атома Оксигену
В молекула гідроген пероксиду складається з двох атомів Гідрогену та двох атомів Оксигену.
Г молекула вуглекислого газу складається з одного атома Карбону і двох атомів Оксигену
3. Зазначте максимальне значення валентності, яке може виявляти Сульфур у хімічних сполуках:
А II Б III В IV Г VI
Середній рівень
4. Складіть формули сполук, утворених Сульфуром(ІІ) і:
а) Калієм; б) Барієм; в) Алюмінієм; г) Карбоном(ІV).
5. Користуючись періодичною системою, установіть послідовність величин для Хлору. Порядковий номер номер періоду відносна атомна маса номер групи:
А 3 Б 35,5 В VII Г 17
6. У скільки разів відносна молекулярна маса силану SiH4 більша за відносну молекулярну масу метану СН4?
Достатній рівень
7. Зразок речовини масою 30 г містить 3,6 г Карбону. Визначте масову частку Карбону у цій речовині.
8. Відносна формульна маса сполуки деякого двовалентного хімічного елемента із Флуором удвічі більша за відносну атомну масу Фосфору. Встановіть формулу сполуки.
Високий рівень
9. Встановіть хімічну формулу сполуки, утворену Ферумом і Оксигеном, якщо масова частка Феруму у ній становить 70%.
Варіант II
Початковий рівень
- Що таке відносна молекулярна маса речовини?
- Укажіть рядок, у якому мова йде про складну речовину:
А молекула азоту складається з двох атомів Нітрогену;
Б молекула водню складається з двох атомів Гідрогену;
В молекула амоніаку складається з трьох атомів Гідрогену та одного атома Нітрогену
Г молекула озону складається із трьох атомів Оксигену
- Зазначте максимальне значення валентності, яке може виявляти Хлор у хімічних сполуках:
АII Б III В V Г VII
Середній рівень
- Складіть формули сполук, утворених Хлором(І) і: а) Магнієм; б) Хромом(ІІІ); в) Літієм; г) Силіцієм(ІV).
- Користуючись періодичною системою, установіть послідовність величин для Алюмінію: порядковий номер номер періоду відносна атомна маса номер групи:
А 27 Б III В 13 Г 3
- У скільки разів відносна молекулярна маса хлору С12 менша за відносну молекулярну масу фосфор (V) оксиду Р2O5?
Достатній рівень
- Зразок речовини масою 112 г містить 44,8 г Купруму. Визначте масову частку Купруму у цій речовині.
- Відносна молекулярна маса сполуки Хлору з Оксигеном становить 183. Знайдіть формулу сполуки, якщо у її молекулі міститься 2 атоми Хлору.
Високий рівень
- Встановіть хімічну формулу сполуки, утворену Купрумом і Оксигеном, якщо масова частка Купруму у ній становить 80%.
Урок 2. Валентність
- Тестова самостійна робота Визначення валентності за формулами бінарних сполук
У завданнях може бути одна або кілька відповідей ( 1 бал за кожне завдання)
І варіант
- Валентність Силіцію в речовині, формула якої SiО2, дорівнює
А II В IV
Б VI Г І
- Валентність Барію в речовині, формула якої ВаІ2, дорівнює
А II В IV
Б І Г VII
- Валентність Карбону в речовині, формула якої СН4, дорівнює
А І В IV
Б II Г VI
- Валентність Нітрогену в речовині, формула якої N2О3, дорівнює
А III В V
Б VI Г II
- Валентність Хлору в речовині, формула якої С12О, дорівнює
А II В VI
Б V Г І
- Розставте формули у порядку зростання валентності першого елемента у формулі сполуки
А СuО В SO2
Б Р2О5 Г AgCl
- Розставте формули у порядку зростання валентності елемента у сполуці з Гідрогеном
A SiH4 В NH3
Б H2S Г НІ
- Розставте формули у порядку зростання валентності елемента у сполуці з Оксигеном
А Сr2O3 B SO3
Б FeO Г Li2O
- Викресліть у кожному рядку зайву, на Ваш погляд, речовину
|
MgO |
CuCl2 |
ZnBr2 |
NaCl |
|
СаО |
NH3 |
AlCl3 |
B2O3 |
|
SO2 |
SiH4 |
Na2O |
CO2 |
|
NO |
KCl |
BaO |
FeCl2 |
- Визначте закономірність і доповніть рядки аналогічними формулами
|
H2O |
CaO |
Al2O3 |
SO2 |
|
|
|
|
|
BeCl2 |
SeO3 |
CaO |
TeO3 |
|
|
|
|
ІІ варіант
- Валентність Брому в речовині, формула якої Вr2O7, дорівнює
А II В IV
В VII Г V
- Валентність Карбону в речовині, формула якої СН4, дорівнює
А II В IV
Б І Г V
- Валентність Нітрогену в речовині, формула якої NO2, дорівнює
А IV В І
В II Г III
- Валентність Селену в речовині, формула якої SeO3, дорівнює
А III В IV
Б II Г VI
- Валентність Сульфуру в речовині, формула якої Li2S, дорівнює
А II В III
Б І Г IV
- Розставте формули у порядку зростання валентності першого елемента у формулі сполуки
Б Р2О3 Г CaS
- Розставте формули у порядку зростання валентності елемента у сполуці з Гідрогеном
А РН3 В HF
Б H2Se Г GeH4
- Розставте формули у порядку зростання валентності елемента у сполуці з Оксигеном
А Мn2O7 В SO2
Б Fe2O3 Г Н2О
- Викресліть у кожному рядку зайву, на ваш погляд, речовину
|
СuО |
КС1 |
ZnS |
CaSe |
|
FeCI3 |
SO3 |
SeO3 |
CrO3 |
|
CO |
BaS |
NaBr |
CaO |
|
NaI |
K2O |
CuBr |
MnCl2 |
- Визначте закономірність і доповніть рядки аналогічними формулами
|
Mn2O7 |
SeO3 |
P2O5 |
SiO2 |
|
|
|
|
|
AgCl |
SeO2 |
Cu2O |
CO2 |
|
|
|
|
- Самостійна робота «Валентність»
Складіть формули сполук за відомою валентністю: ( 1 бал за кожне завдання)
І варіант
1. Сполука Калію з Оксигеном _____________
2. Сполука Гідрогену із Сульфуром(ІІ) ________
3. Сполука Алюмінію з Оксигеном ________
4. Сполука Плюмбуму(ІІ) з Хлором(І) ________
5. . Сполука Стануму(ІV) з Оксигеном _______
6. Сполука Хлору(V) з Флуором ___________
7. Сполука Феруму(ІІІ) з Бромом(І) ________
8. Сполука Мангану(VІІ) з Оксигеном _____
9. Сполука Фосфору(ІІІ) з Гідрогеном ________
10.Сполука Аргентуму(І) з Фосфором(ІІІ) ______
ІІ варіант
Складіть формули сполук за відомою валентністю:
1. Сполука Кальцію з Фосфором(ІІІ) _________
2. Сполука Гідрогену з Флуором ____________
3. Сполука Алюмінію з Бромом(І) ____________
4. Сполука Меркурію(ІІ) з Оксигеном __________
5. Сполука Феруму(ІІІ) з Оксигеном ___________
6. Сполука Плюмбуму(ІV) з Хлором(І) _________
7. Сполука Мангану(ІV) з Оксигеном __________
8. Сполука Сульфуру(VІ) з Флуором ___________
9. Сполука Літію з Нітрогеном(ІІІ) _____________
10. Сполука Алюмінію із Сульфуром(ІІ) ______
- Самостійна робота «Валентність хімічних елементів»
І варіант
Початковий рівень
1. Дайте визначення поняття «валентність».
2. Яку валентність виявляють у хімічних сполуках Оксиген і Гідроген?
3. Чи всі хімічні елементи мають стале значення валентності?
Середній рівень
4. За розміщенням у періодичній системі визначте максимальне значення валентності таких хімічних елементів: Be, Р, Si, S, В, Se , Мn
5. Визначте валентність хімічних елементів за формулами сполук: H2Se, SeO2, OF2, As2O5.
Достатній рівень
6. Визначте валентність елементів за формулами їхніх сполук з Оксигеном: Р2O5, SO2, SO3, NO, NO2, SnO, SnO2, I2O5.
Високий рівень
7. Установіть відповідність між хімічним елементом і максимальним та мінімальним значеннями валентності у його хімічних сполуках:
1 Р А II, VI
2 СІ Б II, IV
3 S В І, VII
Г III, V
8. Розташуйте хімічні сполуки у порядку зростання значення валентності Нітрогену:
а) NO2; б) NO; в) N2O3; г) N2O.
Початковий рівень
1. Укажіть елемент, який виявляє у сполуках валентність І:
А Алюміній Б Карбон В Гідроген Г Оксиген
2. Укажіть, яку валентність виявляє Оксиген у сполуках:
А І Б II В III Г IV
3. Укажіть валентність елементів у речовині РН3:
А І і II Б II і II В ІІІ і І Г ІІ і III
Середній рівень
4. Хімічні сполуки, в яких хімічні елементи виявляють валентність тільки два, знаходяться в рядку:
A LiI, NaF, НС1, KF, AgCl, Б А12О3, Cu2S, А1С13, Fe3О4, N2О5,
В CaO, MgS, BaO, CuS, СuO, Г А1С13, BF3, РН3, NH3, РС13.
5. Хімічні сполуки, в яких хімічні елементи виявляють валентність три і один, знаходяться в рядку:
A LiI, NaF, НС1, KF, AgCl, Б А12O3, Cu2S, А1С13, Fe3O4, N2O5,
В CaO, MgS, BaO, CuS, CuO, Г AlCl3, BF3, РН3, NH3, PCI3
6. Укажіть відповідність між формулою речовини і значенням валентностей хімічних елементів, які її утворюють:
Формула Валентність
1 H2S А І і І
2 СO2 Б VI і II
3 НС1 В IV і II
4 SO3 Г V і II
Д І і II
Достатній рівень
7. У сполуках з Оксигеном Манган виявляє валентності II, III, IV, VII. Складіть формули цих сполук.
Високий рівень
8. Напишіть формули бінарних сполук з Оксигеном таких хімічних елементів: Магнію, Фосфору(ІІІ), Калію, Хлору(ІV), Феруму(ІІІ), Купруму(ІІ), Силіцію (IV), Цинку, Алюмінію, Гідрогену, Плюмбуму(ІІ), Плюмбуму(IV).
4. Гра «Вірю – не вірю»
Поставте знак «+», якщо твердження є правильне, і знак «-«, якщо хибне.
- Речовини, що складаються з атомів називаються молекулярними.
- Індекси вказують на кількість атомів у структурній формулі речовини.
- Хімічна формула – це умовний запис складу речовини за допомогою символів та індексів.
- Кухонна сіль складається з молекул.
- Індекси записують справа внизу біля символа хімічного елемента.
- Хімічна формула відображає якісний та кількісний склад речовини.
- Кількісний склад речовини показує, які атоми входять до її складу.
- Формула Al2O3 читається алюміній-два-о-три
Урок 3. Хімічні рівняння
- Самостійна робота Закон збереження маси. Складання рівнянь хімічних реакцій.
Доповніть твердження або дайте відповіді на запитання (1 бал за кожне завдання)
І варіант
- Закон збереження маси формулюється так: ________
- Індекс — це ____________________________________________
- У якій частині рівняння реакції записані формули реагентів? _________________
- Чи однакова сума коефіцієнтів реагентів і продуктів у рівнянні реакції? _____________
- У рівнянні реакції виділення газуватої речовини позначають символом _________
- У записі «3Н2О» число атомів Оксигену дорівнює ___________________________
- У записі «2H2SО4» число атомів Сульфуру дорівнює ________________________
- У записі «4Са(ОН)2» число атомів Гідрогену дорівнює _______________________
1. Закон збереження маси був відкритий __________
2. Коефіцієнт - це _________________________________
3. У якій частині рівняння реакції записані формули продуктів? _________________
4. Чи однакова сума атомів реагентів і продуктів у рівнянні реакції? ______________
5. У рівнянні реакції виділення осаду позначають символом ____________________
6. У записі «5СО2» число атомів Оксигену дорівнює __________________________
7. У записі «3Н3РО4» число атомів Фосфору дорівнює ____________________
8. У записі «2А1(ОН)3» число атомів Гідрогену дорівнює _______________________
- Завдання «Хімічна розминка»
Доберіть коефіцієнти в наведених схемах:
Р + С12 РС15
СН4 С + Н2
Na + S Na2S
HCl + MgMgCl2 + H2
ZnSО4 + KOH K2SО4 + Zn (OH)2
BaCl2 +Na2SО4 BaSО4 +NaCl
AlCl3 + NaOH NaCl + Al(OH)3
Fe(OH)3 Fe2О3 +H2О
H2SО4 + A1 Al2 (SО4 )3 + H2
P2О5 +Na2О Na3PО4
A12 (SО4)3 +Ba (NО3)2 A1(NО3)3 +BaSО4
- Естафета «Хто швидший» (самостійна робота)
Розставте коефіцієнти в рівняннях:
1. Zn + О2 ZnO
2. Fe + Cl2 FeCl3
3. Mg + HClMgCl2+H2
4. Al(OH)3 A12О3 +H2О
5. HNО3 H2О + NО2+О2
6. CaO + H2О Ca(OH)2
7. H2 + C12 HC1
8. KC1О3 KC1О4 + KC1
9. Fe(ОH)2+H2О + О2Fe(ОH)3
10. KBr + Cl2KCl + Br2
- Самостійна робота. Схеми реакцій перетворіть на хімічні рівняння:
FeBr3 FeBr2 + Br2;
CuCl2 + Na2S CuS + NaCl;
Fe + О2 Fe3О4;
Fe + Cl2 FeCl3;
Zn + HC1 ZnCl2 + H2;
KOH + H2SО4 K2SО4 + Н2О;
NaOH + H3PО4 Na3PО4 + H2О;
CuOH Cu2О + H2О.
Урок 4. Короткі історичні відомості про спроби класифікації хімічних елементів
- Тест-контроль «Знайди пару»
|
|
В основу класифікації хімічних елементів на металічні та неметалічні покладено |
А схожість фізичних властивостей простих речовин |
|
|
На підставі схожості властивостей елементів та їх сполук було виділено природню родину лужних металів |
Б Cl, Br, I |
|
|
На підставі схожості властивостей елементів та їх сполук було виділено природню родину галогенів |
B He, Ne, Ar |
|
|
На підставі схожості властивостей елементів та їх сполук було виділено природню родину інертних газів |
Г Li, Na, K |
|
|
Загальний закон природи |
Д періодичний закон Д.І.Менделєєва |
|
|
|
|
|
|
|
|
|
|
Із збільшенням порядкового номера хімічна активність лужних металів |
А збільшується |
|
|
У періодичній системі лужні металічні елементи розміщені |
Б лужні метали |
|
|
Метали – легкі, легкоплавкі, електропровідні |
В F, Cl, Br, I |
|
|
Природна родина неметалів |
Г на початку періоду |
|
|
Прості речовини мають одноатомні молекули |
Д благородні інертні гази |
- Гра «Вгадай слово»
Завдання 1. Із літер, які відповідають символам хімічних елементів, прочитайте слово
Завдання 2. Із літер, які відповідають символам галогенів, прочитайте слово
|
Я |
А |
Н |
Т |
У |
К |
О |
Л |
М |
І |
Р |
Д |
|
O |
F |
Li |
Cl |
Na |
K |
Br |
Rb |
I |
Cs |
S |
Fr |
- Тестова самостійна робота.
- Які з наведених властивостей характеризують хімічний елемент:
А температура плавлення
Б заряд ядра
В число електронів на зовнішньому енергетичному рівні
Г густина
Д число енергетичних рівнів
- Які з наведених властивостей характеризують просту речовину:
А температура плавлення
Б заряд ядра
В тип кристалічної гратки
Г густина
Д число енергетичних рівнів
- Елемент з порядковим номером 11 має хімічні властивості подібні до властивостей:
А бору
Б літію
В алюмінію
Г нітрогену
- Елемент з порядковим номером 17 має хімічні властивості подібні до властивостей:
А брому
Б літію
В алюмінію
Г нітрогену
- Які пари хімічних елементів найбільші подібні за хімічними властивостями:
А Na, K
Б S, Cl
B Cl, Br
Г He, Ne
- Визначте, які ряди елементів записані в порядку зростання атомного радіуса:
А I, Br, Cl, F
Б F, Cl, Br, I
B C, N, O, F
Г Ca, Sr, Ba
- Визначте, які ряди елементів записані в порядку зменшення атомного радіуса:
А I, Br, Cl, F
Б F, Cl, Br, I
B C, N, O, F
Г Li, Be, B, C
- Назвіть ряди елементів для яких посилюються металічні ( 1) і неметалічні (2) властивості:
A Li Na K Rb
Б C N O
B I Br Cl F
Г Te Se S
Д Mg Ca Sr Ba
Урок 5. Поняття про лужні, інертні елементи, галогени.
- Хімічний диктант ( «+» - так, «-» - ні) (1 бал – за кожне завдання)
І варіант – для лужних елементів
ІІ варіант – для галогенів
- Прості речовини – типові метали
- Прості речовини – типові неметали
- Утворюють молекули двохатомні
- Сполуки проявляють основні властивості
- Сполуки проявляють кислотні властивості
- Елементи розміщені у І групі головній підгрупі
- Елементи розміщені у VII групі головній підгрупі
- Мають сталу валентність
- Із збільшенням відносних атомних мас елементів посилюються металічні властивості
- Загальна формула утворених оксидів – R2O
- Загальна формула утворених оксидів – R2O7
- Утворюють леткі сполуки з Гідрогеном
- Тест-контроль «Знайди пару»
Завдання. Визначте відповідність означень у стовпчиках 1 та 2.
Для елементу Натрію
- період А Na2O
- група Б 23
- порядковий номер В головна
- відносна атомна маса Г 3
- символ хімічного елемента Д 11
- підгрупа Е Na
- вищий оксид Є І
Для елементу Хлору
- період А СІ
- група Б 35,5
- порядковий номер В 3
- відносна атомна маса Г СI2O7
- символ хімічного елемента Д головна
- підгрупа Е 17
- вищий оксид Є VII
- Гра «Вилучи зайве»
Завдання. Проведіть аналіз рядків, вилучіть зайве.
- Na, Cs, Ba, K
- F, Ne, Cl, Br
- KOH, Ca(OH)2 , LiOH, NaOH
- Na2O, MgO, K2O, Li2O
- H2S, HCl, HBr, HI
- F2, O2, Cl2, Br2
- He, Ne, Xe, Te
- Прийом «Хрестики-нулики»
Вправу виконують два учні, які почергово повинні закреслити певні клітинки.
Завдання 1. Закресліть оксиди лужніх металів.
K2O Na2O Cs2O
CaO Al2O3 SO3
Cl2O7 ZnO SO2
Завдання 2. Закресліть гідроксиди лужних металів.
NaOH Zn(OH)2 Ca(OH)2
Ba(OH)2 KOH CuOH
Al(OH)3 Fe(OH)3 LiOH
Завдання 3. Закресліть леткі сполуки галогенів з гідрогеном
H2S H2SO3 HCl
HNO3 HBr PH3
HI H2SiO3 NH3
Завдання 4. Закресліть прості речовини – галогени
O2 Cl2 N2
H2 Br2 O3
Se I2 P4
Завдання 5. Закресліть інертні елементи
O He H
S Ar Br
Se Xe Te
Урок 6. Періодичний закон Д.І.Менделєєва
- Фразеологічний хімічний диктант ( 1 бал за кожну відповідь)
- На час відкриття Періодичного закону було відомо … (63 хімічні елементи)
- Ознакою класифікації хімічних елементів обрано сталу характеристику елемента… (атомну масу)
- Елементи у періодичній системі розташовані у ряд за зростанням … ( їх відносних атомних мас)
- Таблиця класифікації хімічних елементів називається… (періодична система)
- Через певну кількість елементів властивості їх повторюються … (періодично)
- Номер елементу у ряді елементу, розміщених у порядку зростання відносних атомних мас називається… (порядковий номер)
- Властивості елементів і властивості утворених ними простих і складних тіл, перебувають у періодичній залежності… ( від величини їх атомних мас)
- Графічним відображенням періодичного закону Д.І.Менделєєва є … (періодична система хімічних елементів)
2. Тестова самостійна робота. Періодичний закон і періодична система Д.І.Менделєєва
І варіант
- Обведіть у кружечок слово «так», якщо твердження правильне, слово «ні» — якщо неправильне ( за кожне завдання – 1 бал)
|
Так |
Ні |
1. У Періодичній системі хімічні елементи розташовані в порядку збільшення відносної атомної маси. |
|
Так |
Ні |
2. Періодична система складається з 8 періодів. |
|
Так |
Ні |
3. У короткому варіанті Періодичної системи є 8 груп елементів. |
|
Так |
Ні |
4. Перший хімічний елемент у Періодичній системі — Гідроген. |
|
Так |
Ні |
5. Другий період Періодичної системи містить 10 елементів. |
|
Так |
Ні |
6. Відносна атомна маса обчислюється відносно 1/12 маси атома Карбону. |
|
Так |
Ні |
7. Четвертий період Періодичної системи містить 18 елементів. |
|
Так |
Ні |
8. Шостий період Періодичної системи містить 32 елементи. |
|
Так |
Ні |
9. Кожний період починається з активного металічного елемента. |
|
Так |
Ні |
10. Третій період називають великим. |
|
Так |
Ні |
11. Атом Карбону в шість разів важчий за атом Гідрогену. |
|
Так |
Ні |
12. Атом Неону у два рази важчий за атом Бору. |
- Установіть відповідність між назвою хімічного елемента та його символом.
Назва хімічного Символ хімічного елемента
елемента
1 Гідроген А К
2 Купрум Б Са
3 Кальцій В Н
4 Сульфур Г Сu
Д S
- Установіть послідовність хімічних елементів за збільшенням їхнього порядкового номера.
А О
Б Р
В Н
Г Ва
ІІ варіант
- Обведіть у кружечок слово «так», якщо твердження правильне, слово «ні» — якщо неправильне.
|
Так |
Ні |
1. У Періодичній системі хімічні елементи розташовані за алфавітним порядком. |
|
Так |
Ні |
2. Періодична система складається із 7 періодів. |
|
Так |
Ні |
3. У короткому варіанті Періодичної системи є 10 груп елементів. |
|
Так |
Ні |
4. Другий хімічний елемент у Періодичній системі — Гідроген. |
|
Так |
Ні |
5. Другий період Періодичної системи містить 8 елементів. |
|
Так |
Ні |
6. Відносна атомна маса обчислюється відносно атома Гідрогену. |
|
Так |
Ні |
7. Четвертий період Періодичної системи містить 32 елементи. |
|
Так |
Ні |
8. Сьомий період Періодичної системи містить 32 елементи. |
|
Так |
Ні |
9. Кожний період закінчується активним металічним елементом. |
|
Так |
Ні |
10. Третій період називають малим. |
|
Так |
Ні |
11. Атом Оксигену у вісім разів важчий за атом Гідрогену. |
|
Так |
Ні |
12. Атом Сульфуру у два рази важчий за атом Оксигену. |
- Установіть відповідність між назвою хімічного елемента та його символом.
Назва хімічного Символ хімічного елемента
елемента
1 Оксиген А Р
2 Аурум Б О
3 Хлор В F
4 Фосфор Г Аu Д Сl
- Установіть послідовність хімічних елементів за збільшенням їхнього порядкового номера.
А) О Б) Р В) К Г) Ті
3. Самостійна робота Періодичний закон Д.І. Менделєєва
І варіант
- Позначте назву родини, що утворена елементами головної підгрупи сьомої групи Періодичної системи.
А інертні елементи Б лужні елементи
В галогени Г лужноземельні елементи
- Однією лінією підкресліть символи металічних елементів, що належать до головних підгруп, а двома — символи металічних елементів побічних підгруп. Інші символи підкреслювати не потрібно.
Na, S, Cu, Br, Pb, Ba, Fe, Si, Au.
- З’єднайте лініями назви хімічних елементів та число електронів на зовнішньому електронному рівні їхніх атомів.
|
1 |
1.Хлор |
А 1 |
|
2 |
2.Силіцій |
Б 7 |
|
3 |
3.Цезій |
В 4 |
- Заповніть таблицю.
|
Порядковий номер елемента |
6 |
11 |
16 |
20 |
|
Формула вищого оксиду |
|
|
|
|
|
Формула гідрату вищого оксиду |
|
|
|
|
|
Формула леткої сполуки з Гідрогеном (якщо існує) |
|
|
|
|
- Порядкові номери елементів А і Б дорівнюють відповідно n та n + 2. Якщо хімічний елемент А — це найлегший галоген, то яким хімічним елементом є Б? Визначте та запишіть його порядковий номер у Періодичній системі.
ІІ варіант
- Позначте назву родини, що утворена елементами головної підгрупи першої групи Періодичної системи.
А інертні елементи Б лужні елементи
В галогени Г лужноземельні елементи
- Однією лінією підкресліть символи металічних елементів, що належать до головних підгруп, а двома — символи неметалічних елементів. Інші символи підкреслювати не потрібно.
Sr, S, Cu, Br, Sn, Li, Fe, Si, Au.
- З’єднайте лініями назви хімічних елементів та число електронів на зовнішньому електронному рівні їхніх атомів.
|
1 |
Сульфур |
А 5 |
|
2 |
Карбон |
Б 4 |
|
3 |
Фосфор |
В 6 |
- Заповніть таблицю.
|
Порядковий номер елемента |
3 |
7 |
12 |
15 |
|
Формула вищого оксиду |
|
|
|
|
|
Формула гідрату вищого оксиду |
|
|
|
|
|
Формула леткої сполуки з Гідрогеном (якщо існує) |
|
|
|
|
- Порядкові номери елементів А, Б і В дорівнюють відповідно n, n + 2 та n + 4. Якщо хімічний елемент А утворює найлегший інертний газ, а Б — це металічний елемент, то яким хімічним елементом є В? Визначте та запишіть його порядковий номер у Періодичній системі.
- Гра «Влови помилку»
Учитель зачитує твердження, учні повинні проаналізувати його і вказати правильне воно чи ні.
- До великих належать 1, 2, 3 періоди періодичної системи (ні)
- Порядковий номер елемента збігається із зарядом ядра його атома і кількістю електронів у ньому (так)
- Кожна група періодичної системи складається з головної і побічної підгруп (так)
- Кожний період періодичної системи складається з двох рядків (ні)
- У періодичній системі розміщуються 8 періодів (ні)
- У періодичній системі є 8 груп (так)
Урок 7. Структура Періодичної системи хімічних елементів
- Прийом «Незакінчене речення» ( 1бал за кожне завдання)
- Періоди - горизонтальні ряди елементів, розташовані в порядку зростання їх атомних мас, що починаються… (лужним металічним і закінчуються інертним елементом)
- Великими називаються періоди у яких елементи … (розташовані у двох рядах)
- Групи – вертикальні стовпчики хімічних елементів … (подібних за властивостями)
- Головна підгрупа складається з елементів, що розташовані у … (малих і великих періодах)
- За номером групи для елемента можна визначити … (вищу валентність)
- У малих періодах, зліва направо, і збільшенням відносних атомних мас послаблюються … ( металічні властивості)
- У головних підгрупах із збільшенням відносних атомних мас зверху вниз посилюються … (металічні властивості)
- Періодична система хімічних елементів вміщує періодів … (7)
- У періодичній системі кількість груп рівна … (8)
- Порядковий номер хімічного елемента вказує на … (заряд ядра атома і кількість електронів у атомі)
2. Самостійна робота Періодична система хімічних елементів. Відносна атомна маса
І варіант
- Обведіть у кружечок слово «так», якщо твердження правильне, слово «ні» — якщо неправильне (за кожне завдання – 1 бал)
|
Так |
Ні |
1. У Періодичній системі хімічні елементи розташовані в порядку збільшення відносної атомної маси |
|
Так |
Ні |
2. Періодична система складається із семи періодів |
|
Так |
Ні |
3. Перші три періоди Періодичної системи називають малими |
|
Так |
Ні |
4. Кожен період починається з інертного елемента |
|
Так |
Ні |
5. Хлор належить до родини лужних елементів |
|
Так |
Ні |
6. Кальцій розташований у четвертій групі Періодичної системи |
|
Так |
Ні |
7. Перший період містить два хімічних елементи |
|
Так |
Ні |
8. Манган розташований у головній підгрупі Періодичної системи |
|
Так |
Ні |
9. Меркурій розташований у побічній підгрупі Періодичної системи |
|
Так |
Ні |
10.Оксиген належить до неметалічних елементів |
|
Так |
Ні |
11. У періодах зі збільшенням порядкового номера посилюються неметалічні властивості |
|
Так |
Ні |
12. У групах зі збільшенням відносної атомної маси посилюються металічні властивості |
- Установіть відповідність між хімічним елементом та родиною елементів, до якої він належить.
Елемент Родина
1 Кальцій А лужні елементи
2 Хлор Б лужноземельні, елементи
3 Калій В рідкісноземельні елементи
4 Сульфур Г галогени
Д халькогени
- Установіть елементи в порядку збільшення їхньої максимальної валентності.
А О
Б P
В Si
Г Al
IІ варіант
1. Обведіть у кружечок слово «так», якщо твердження правильне, слово «ні» — якщо неправильне.
|
Так |
Ні |
1. У Періодичній системі хімічні елементи розташовані у порядку збільшення їхньої валентності |
|
Так |
Ні |
2. Періодична система складається із семи груп |
|
Так |
Ні |
3. Четвертий період Періодичної системи називають великим |
|
Так |
Ні |
4. Кожний період закінчується інертним елементом |
|
Так |
Ні |
5. Хлор належить до родини галогенів |
|
Так |
Ні |
6. Карбон розташований у четвертій групі Періодичної системи |
|
Так |
Ні |
7. Другий період містить вісім хімічних елементів |
|
Так |
Ні |
8. Алюміній розташований у головній підгрупі Періодичної системи |
|
Так |
Ні |
9. Плюмбум розташований у побічній підгрупі Періодичної системи |
|
Так |
Ні |
10. Барій належить до неметалічних елементів |
|
Так |
Ні |
11. У періодах зі збільшенням порядкового номера посилюються металічні властивості |
|
Так |
Ні |
12. У групах зі збільшенням відносної атомної маси посилюються неметалічні властивості |
- Установіть відповідність між хімічним елементом та родиною елементів, до якої він належить.
Елемент Родина
1 Барій А лужні елементи
2 Бром Б лужноземельні елементи
3 Натрій В рідкісноземельні елементи
4 Оксиген Г галогени
Д халькогени
- Розташуйте елементи у порядку збільшення їхніх неметалічних властивостей.
А Карбон
Б Хлор
В Бор
Г Флуор
3.Заповніть таблицю.
|
Символ хімічного елемента |
Назва хімічного елемента |
Порядковий номер хімічного елемента |
Заряд ядра атома |
Кількість електронів в атомі |
Група і підгрупа, у якій розташований хімічний елемент |
Період, у якому розташований хімічний елемент |
|
Р |
|
|
|
|
|
|
|
|
Нітроген |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
+ 16 |
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
Головна підгрупа ІV групи |
третій |
4. Тестова самостійна робота (2 бали за кожне завдання)
І варіант
- Зростання атомних радіусів спостерігається в ряду елементів:
А Na, Mg, Al, Si
Б O, S, Se, Te
B I, Br, Cl, F
- У якого елемента сильніше виявлені металічні властивості:
А берилію
Б магнію
В кальцію
- Назвіть елемент головної підгрупи
А Mg
Б V
B Mo
- Назвіть формулу вищого оксиду хімічного елемента з протонним числом 16:
А R2O3
Б RO
B RO3
- Які хімічні властивості виявляє вищий оксид елемента з протонним числом 13:
А основні
Б кислотні
В амфотерні
ІІ варіант
- Максимальний радіус атома має:
А Mg
Б Ca
B Ra
- В якого елемента сильніше виявлені металічні властивості:
А Літій
Б Берилій
В Бор
- Назви елемент побічної підгрупи:
А Na
Б Ag
B Rb
- Назвіть формулу вищого оксиду хімічного елемента з протонним числом 12:
А R2O3
Б RO
B RO3
- Які хімічні властивості виявляє вищий оксид елемента з протонним числом 11:
А основні
Б кислотні
В амфотерні
Урок 8. Будова атома. Склад атомних ядер (протони і нейтрони)
1. Вправа «Вставте пропущені слова»
1. Періодична система хімічних елементів Д.І.Менделєєва являється графічним представленням … .
2. Періодична система складається із … періодів і … груп хімічних елементів.
3. Елементи у періодичній системі розміщені у порядку зростання … .
4. Кожен атом складається із позитивно зарядженого … і негативно заряджених … , що рухаються довкола … .
5. Заряд ядра атома відповідає … елемента в періодичній системі.
6. До складу ядра атома входять позитивно заряджені частинки -- … із зарядом … і електронейтральні частинки -- … .
7. Числом протонів у ядрі визначається … атома .
2. Робота в групах
І група. Охарактеризуйте, користуючись періодичною системою, будову атома елемента з порядковим номером 19. Зобразіть ядерну модель будови даного атома та вкажіть його складові.
ІІ група. Охарактеризуйте, користуючись періодичною системою, будову атома елемента з порядковим номером 16. Зобразіть ядерну модель будови даного атома та вкажіть його складові.
ІІІ група. Охарактеризуйте, користуючись періодичною системою, будову атома елемента з порядковим номером 15. Зобразіть ядерну модель будови даного атома та вкажіть його складові.
ІV група. Охарактеризуйте, користуючись періодичною системою, будову атома елемента з порядковим номером 14. Зобразіть ядерну модель будови даного атома та вкажіть його складові.
V група. Охарактеризуйте, користуючись періодичною системою, будову атома елемента з порядковим номером 13. Зобразіть ядерну модель будови даного атома та вкажіть його складові.
VІ група. Охарактеризуйте, користуючись періодичною системою, будову атома елемента з порядковим номером 12. Зобразіть ядерну модель будови даного атома та вкажіть його складові.
3. Експрес-тест
В - 1
- Порядковий номер елемента І групи: а) 8 ; б) 2 ; в) 20 ; г) 19
- Порядковий номер елемента Фосфору: а) 7 ; б) 7 ; в) 15 ; г) 31
- Відносна атомна маса атома Хлору: а) 17 ; б) 71 ; в) 35 ; г) 35,5
- Заряд ядра атома Кальцію: а) +19 ; б) + 30 ; в) +20 ; г) +65.
- Кількість електронів у атома Магнію: а) 7 ; б) 24 ; в) 1 ; г) 12
- Кількість протонів у ядрі атома Хрому: а) 26 ; б)28 ; в) 24 ; г) 52.
- Кількість нейтронів у ядрі атома Мангану: а)25 ; б)55 ; в) 30 ; г)29
- Вкажіть порядкові номери елементів, які належать до однієї групи
а) 8 і 18 ; б) 2 і 36; в) 20 і 22; г) 19 і 20.
9. Вкажіть порядкові номери елементів , з однаковою кількістю нейтронів у ядрі:
а) 8 і 9 ; б) 20 і 21 ; в) 20 і 24 ; г) 19 і 20.
10. Складіть формулу оксиду елемента з порядковим номером 20.
В - 2
- Порядковий номер елемента ІІ групи: а) 8 ; б) 2 ; в) 20 ; г) 19
- Порядковий номер елемента Нітрогену: а) 7 ; б) 7 ; в) 15 ; г) 31
- Відносна атомна маса атома Брому: а) 17 ; б) 80 ; в) 79 ; г) 35
- Заряд ядра атома Магнію: а) +19 ; б) + 30 ; в) +24 ; г) +12.
- Кількість електронів у атома Аргону: а) 40 ; б) 39 ; в) 18 ; г) 19
- Кількість протонів у ядрі атома Силіцію: а) 26 ; б)28 ; в) 14 ; г) 52.
- Кількість нейтронів у ядрі атома Алюмінію: а)27 ; б)13 ; в) 14 ; г)29
- Вкажіть порядкові номери елементів, які належать до однієї підгрупи
а) 8 і 18 ; б) 3 і 36; в) 8 і 24; г) 16 і 34.
9. Вкажіть порядкові номери елементів, з однаковою кількістю нейтронів у ядрі:
а) 8 і 9 ; б) 34 і 35 ; в) 20 і 24 ; г) 18 і 20.
10. Складіть формулу оксиду елемента з порядковим номером 12.
В - 3
- Порядковий номер елемента VІІ групи: а) 8 ; б) 17 ; в) 20 ; г) 19
- Порядковий номер елемента Сульфуру: а)16 ; б) 7 ; в) 15 ; г) 32
- Відносна атомна маса атома Фосфору: а) 15 ; б) 71 ; в) 31 ; г) 30
- Заряд ядра атома Алюмінію: а) +19 ; б) + 30 ; в) +27 ; г) 13.
- Кількість електронів у атома Купруму: а) 7 ; б) 29 ; в) 63 ; г) 64
- Кількість протонів у ядрі атома Силіцію: а) 26 ; б)28 ; в) 24 ; г) 14.
- Кількість нейтронів у ядрі атома Феруму: а)26 ; б)55 ; в) 56 ; г)29
- Вкажіть порядкові номери елементів , які належать до однієї підгрупи
а) 10 і 26 ; б) 10 і 36; в) 20 і 22; г) 19 і 20.
9. Вкажіть порядкові номери елементів, з однаковою кількістю нейтронів у ядрі:
а) 25 і 26 ; б) 20 і 21 ; в) 20 і 24 ; г) 18 і 20.
10. Складіть формулу оксиду елемента з порядковим номером 13.
В - 4
- Порядковий номер елемента VІІІ групи: а) 8 ; б) 2 ; в) 20 ; г) 19
- Порядковий номер елемента Феруму: а) 56 ; б) 26 ; в) 55 ; г) 31
- Відносна атомна маса атома Хрому: а) 24 ; б) 51 ; в) 35 ; г) 52
- Заряд ядра атома Хлору: а) +19 ; б) + 17 ; в) +35 ; г) +65.
- Кількість електронів у атома Фосфору: а) 31 ; б) 30 ; в) 15 ; г) 12
- Кількість протонів у ядрі атома Цинку: а) 26 ; б)30 ; в) 65 ; г) 35.
- Кількість нейтронів у ядрі атома Алюмінію: а)27 ; б)13 ; в) 14 ; г)29
- Вкажіть порядкові номери елементів, які належать до однієї підгрупи
а) 13 і 39 ; б) 13 і 31; в) 20 і 22; г) 19 і 20.
9. Вкажіть порядкові номери елементів, з однаковою кількістю нейтронів у ядрі:
а) 8 і 9 ; б) 20 і 21 ; в) 20 і 24 ; г) 29 і 30.
10. Складіть формулу оксиду елемента з порядковим номером 11.
4. Самостійна робота
Здійснити обчислення і заповнити таблицю згідно свого варіанту:
|
№ варіанту |
Назва елементу |
Номер групи |
Підгрупа |
Період |
пе |
пр |
пп |
|
1 |
Алюміній |
|
|
|
|
|
|
|
2 |
Сульфур |
|
|
|
|
|
|
|
3 |
Кальцій |
|
|
|
|
|
|
|
4 |
Магній |
|
|
|
|
|
|
|
5 |
Купрум |
|
|
|
|
|
|
|
6 |
Нітроген |
|
|
|
|
|
|
|
7 |
Бром |
|
|
|
|
|
|
|
8 |
Цинк |
|
|
|
|
|
|
|
9 |
Хром |
|
|
|
|
|
|
|
10 |
Фосфор |
|
|
|
|
|
|
|
11 |
Манган |
|
|
|
|
|
|
|
12 |
Ферум |
|
|
|
|
|
|
Урок 9. Протонне число. Нуклонне число. Нуклід
1. Гра «Вірю – не вірю»
1. Складовими частинами атома є ядро та електронна оболонка
2. Ядро має негативний заряд , а навколо нього обертаються позитивно заряджені електрони
3. У ядрі містяться позитивно заряджені частинки – протони.
4. Нейтрон – електронейтральна частинка ядра
5. Заряд ядра атома визначається числом нейтронів у ядрі
6. Заряд ядра атома відповідає порядковому номеру елемента у періодичній системі
7. Позитивно заряджені частинки із зарядом +1 -- нейтрони
8. Нукліди – різні види атомних ядер .
9. Загальна кількість протонів і нейтронів у ядрі – нуклонне число
10. Протонним числом визначається кількість протонів у ядрі
11. Навколо ядра атома рухаються протони
12. Вид атомів одного хімічного елемента з певним числом протонів і нейтронів називають нуклідом
2. Тестова самостійна робота
В - 1
1. Протонне число для атома Силіцію: а) 26 ; б)28 ; в) 14 ; г) 52.
2. Кількість нейтронів у ядрі атома Алюмінію: а)27 ; б)13 ; в) 14 ; г)29
3. Кількість протонів і нейтронів для нукліду 25 Mg: а) 8 і 9 ; б) 25 і 12; в) 12 і 13 ; г) 13 і 25.
4. Нуклонне число для елемента Калію: а) 32 ; б)19 ; в) 39 ; г) 16.
5. Символ нукліду елемента Сульфуру з масовим числом 34: а) 32S ; б)34P ; в)34S; г) 34Cl.
6. Установіть відповідність між назвою елемента, протонним числом і числом нейтронів у ядрах атомів
1. Бром А.+25 І.20
2. Манган Б.+35 ІІ.30
В.+55 ІІІ.45
В – 2
1. Протонне число для атома Сульфуру: а) 26 ; б)28 ; в) 16; г) 32.
2. Кількість нейтронів у ядрі атома Силіцію: а)28 ; б)13 ; в) 14 ; г)29
3. Кількість протонів і нейтронів для нукліду 28 Mg: а) 8 і 9 ; б) 12 і 16; в) 12 і 13 ;
г) 13 і 25.
4. Нуклонне число для елемента Кальцію: а) 20 ; б)40 ; в) 39 ; г) 16.
5. Символ нукліду елемента Сульфуру з масовим числом 32: а) 34S ; б)32P ; в)32S; г) 34Cl.
6. Установіть відповідність між назвою елемента, протонним числом і числом нейтронів у ядрах атомів
1. Алюміній А.+25 І. 28
2. Хром Б.+13 ІІ. 30
В.+24 ІІІ.14
В - 3
1. Протонне число для атома Кальцію: а) 40 ; б)20 ; в) 14 ; г) 41.
2. Кількість нейтронів у ядрі атома Фосфору: а)31 ; б)16 ; в) 17 ; г)15
3.Кількість протонів і нейтронів для нукліду 34P : а) 8 і 34 ; б) 15 і 34; в) 15 і 31 ;
г) 15 і 19.
4. Нуклонне число для елемента Мангану: а) 30 ; б)29 ; в) 54 ; г) 55.
5. Символ нукліду елемента Хлору з масовим числом 37: а) 36Cl ; б)34P ; в) 35Cl.; г) 37Cl.
6. Установіть відповідність між назвою елемента, протонним числом і числом нейтронів у ядрах атомів
1. Цинк А.+25 І.80
2. Бром Б.+30 ІІ.35
В.+35 ІІІ.45
В - 4
1. Протонне число для атома Купруму: а) 63 ; б)28 ; в) 29 ; г) 64.
2. Кількість нейтронів у ядрі атома Алюмінію: а)27 ; б)13 ; в) 14 ; г)29
3. Кількість протонів і нейтронів для нукліду 34S: а) 8 і 9 ; б) 16 і 34; в) 16 і 18 ; г) 13 і 25.
4. Нуклонне число для елемента Феруму: а) 26 ; б)55 ; в) 56 ; г) 16.
5. Символ нукліду елемента Фосфору з масовим числом 33: а) 32S ; б)34P ; в)34S; г) 33P .
6. Установіть відповідність між назвою елемента, протонним числом і числом нейтронів у ядрах атомів
1. Барій А.+28 І.20
2. Силіцій Б.+14 ІІ.14
В.+56 ІІІ.81
3. Вправа «Незакінчені речення»
1. Позитивно заряджені частинки , що містяться у ядрі -- … .
2. Кількість … у ядрі визначається протонним числом.
3. В ядрі атома крім протонів містяться електронейтральні частинки -- … .
4. Нейтральна частинка ядра -- … .
5. Кількість … у ядрі називається нейтронним числом .
6. Загальна назва протонів і нейтронів у ядрі атома -- … .
7. Ядра атомів – це система нуклонів , що взаємопов`язані між собою … силою.
8. Загальна кількість протонів і нейтронів у ядрі називають … або масовим числом.
9. Атом елемента , який характеризується певним нуклонним числом , називається … .
10. Нуклід характеризується певною кількістю … і … .
Урок 10. Ізотопи. Сучасне формулювання періодичного закону
1. Хімічний диктант
1. Вид атомів з однаковим зарядом ядра -- … .
2. Атом – це електронейтральна частинка, в центрі якої знаходиться позитивно заряджене … , а навколо нього розміщуються негативно заряджені … .
3. Кількість … у ядрі атома дорівнює порядковому номеру елемента в періодичній системі.
4. Нейтральна частинка ядра -- … .
5. Сума протонів і нейтронів називається … числом .
6. Атом елемента , який характеризується певним нуклонним числом, називається … .
7. Всі нукліди одного хімічного елемента називаються … .
8. Ізотопи одного хімічного елемента займають одне місце у періодичній системі, тому що мають одне і те ж … число.
9. Головною характеристикою атома є … його ядра.
10. Сучасне формулювання періодичного закону Д.І.Менделєєва: Властивості простих … , а також форми і властивості сполук елементів перебувають у періодичній залежності від величин … .
2. Робота в групах
Скласти кросворди, використовуючи визначення даної теми
3. Розв`язування задач
1. Купрум має два нукліди, атомні маси яких 63 (71,87масових %) і 65 (28,13масових %). Здійсніть обчислення і визначте середню атомну масу Купруму.
2. Хлор має два нукліди, атомні маси яких 35 (75,4масових %) і 37 (26,6 масових %). Здійсніть обчислення і визначте середню атомну масу Хлору.
3. У природних сполуках Силіцій міститься у вигляді нуклідів 28Sі (92,28 масових %),29Sі (4,67 масових %) та 30Sі (3,05 масових %). Здійсніть обчислення і визначте середню атомну масу Купруму.
4. Хлор має два нукліди, атомні маси яких 35 і 37. Середня атомна маса атома Хлору 35,453. Визначте масові частки кожного з нуклідів Хлору.
5. Купрум має два нукліди, атомні маси яких 63 і 65. Середня атомна маса атома Купруму 63,546. Визначте масові частки кожного з нуклідів Купруму.
Урок 11. Самостійна робота №1: Періодичний закон і періодична система хімічних елементів. (І частина).
Варіант 1
- Серед перелічених елементів, вкажіть лужний метал:
а) Магній; б) Калій; в) Ферум; г) Ванадій.
- Назвіть елементи, в яких атомні ядра містять:
а) 8 нейтронів і 8 протонів; б) 13 протонів і 14 нейтронів.
- Визначте склад ядер елементів №23 і №18.
- Що таке хімічний елемент?
- Який з елементів Нітроген чи Арсен має яскравіше виражені неметалічні властивості? Відповідь поясніть.
- Невідомий елемент знаходиться в ІІ групі, відносна молекулярна маса гідроксиду рівна 241. Визначте елемент.
Варіант 2
- Який з неметалів відносять до галогенів?
а) С; б) Не; в) О; г) F.
- Які природні родини хімічних елементів ви знаєте?
- Яка будова атомного ядра?
- Визначте склад ядер атомів елементів № 22 і № 37.
- Який з елементів має більше виражені металічні властивості: Магній чи Стронцій?
- Невідомий елемент знаходиться в VI групі, відносна молекулярна маса вищого оксиду рівна 127. Назвіть елемент.
Варіант 3
1. Лужні метали утворюють гідроксиди загальною формулою: а) ROH; б) R(OH)2; в) R(OH)3.
2. Сформулюйте визначення періодичного закону?
3. Яка відмінність у складі ядер ізотопів: 16О, 17О, 18О ?
4. Як змінюється характер оксидів в ряду:
Na2O – MgO – Al2O3 – SiO2 ?
5. У сполуках з Гідрогеном і металами галогени:
а) одновалентні; б) двовалентні; в) семивалентні.
6. Невідомий елемент знаходиться в V групі, відносна молекулярна маса сполуки з воднем рівна 78. Назвіть елемент?
Варіант 4
- Яку сполуку з воднем утворює Бром:
а) HR; б) H2R; в) H3R ?
- Що таке ізотопи?
- Назвіть елементи в яких атомні ядра містять:
а) 24 протони і 28 нейтронів; б) 1 протон і 0 нейтронів.
- Скільки нейтронів мають ядра ізотопів:
24Mg , 25Mg , 26Mg .
- Як змінюється характер оксидів в ряду:
CO2 – SiO2 – GeO2 – SnO2 ?
- Невідомий елемент знаходиться в І групі, відносна молекулярна маса вищого оксиду 232. Знайдіть елемент?
Оцінювання кожного завдання у 2 бали.
Урок 12. Будова електронних оболонок атомів хімічних елементів 1-3 періодів і К, Са
1. Хімічний диктант
1. Віддаль від ядра, на якій найбільш імовірне перебування електрона - … .
2. Кількість енергетичних рівнів в електронній оболонці атома визначають … .
3.Чим електрон ближче до ядра, тим … його енергія.
4. Електрони з однаковою енергією об`єднуються в … , які позначаються п .
5. Кількість енергетичних рівнів у елемента Силіцію … .
6.Чим більший номер рівня, тим … енергія електронів.
7. Максимальну кількість електронів на енергетичному рівні можна обчислити за формулою … .
8. Максимальна кількість електронів на 3-ому енергетичному рівні … .
9. Розподіл електронів по енергетичних рівнях 2,8,3 характерний для елемента … .
10. Схема заповнення електронами енергетичних рівнів для елемента Хлору … .
2.Самостійна робота
З допомогою періодичної системи заповнити таблицю згідно свого варіанту
|
№ варіанту |
Назва елементу |
Заряд ядра |
пе |
пр |
пп |
Розподіл електронів по енергетичних рівнях |
|
1 |
Калій |
|
|
|
|
|
|
2 |
Сульфур |
|
|
|
|
|
|
3 |
Нітроген |
|
|
|
|
|
|
4 |
Магній |
|
|
|
|
|
|
5 |
Силіцій |
|
|
|
|
|
|
6 |
Берилій |
|
|
|
|
|
|
7 |
Оксиген |
|
|
|
|
|
|
8 |
Неон |
|
|
|
|
|
|
9 |
Аргон |
|
|
|
|
|
|
10 |
Фосфор |
|
|
|
|
|
|
11 |
Флуор |
|
|
|
|
|
|
12 |
Алюміній |
|
|
|
|
|
|
13 |
Карбон |
|
|
|
|
|
|
14 |
Натрій |
|
|
|
|
|
|
15 |
Кальцій |
|
|
|
|
|
Урок 13. Стан електронів в атомі. Електронні орбіталі
1. Вправа «Незакінчені речення»
1. Електрон, рухаючись в атомі, не описує чітко виражену траєкторію, а утворює певний об`єм простору навколо ядра -- … .
2. Швидкий рух електрона навколо ядра спричиняє утворення «…» .
3. Електронні хмари, що виникають внаслідок руху окремих електронів у атомі, утворюють … .
4.Утворена рухом електрона електронна хмара - … .
5. Відомі вам форми орбіталей: … .
6. На одній орбіталі можуть перебувати … електрони.
7. Рух електрона навколо власної осі називають … .
8. Віддаль від ядра, на якій найбільш імовірне перебування електрона - … .
9. Кількість енергетичних рівнів в електронній оболонці атома визначають … .
10.Чим ближче до ядра атома перебувають електрони, тим запас їх енергії … , а у більш віддалених … .
2. Графічний диктант
1. Електрони в атомі не перебувають у постійному русі.
2. Енергетичний рівень -- це об`єм простору навколо ядра атома, у якому найбільш ймовірне перебування електрона.
3. Під час хімічних реакцій ядра атомів не зазнають жодних змін.
4. Утворену рухом електрона електронну хмару називають орбіталлю.
5. s-орбіталь має форму кулі.
6. p- електрони, під час руху навколо ядра, описують форму неправильної вісімки.
7. На одній орбіталі може перебувати 2 електрони.
8. Віддаль від ядра, на якій найбільш імовірне перебування електрона називають енергетичним рівнем.
9. Кількість енергетичних рівнів в електронній оболонці атома визначають за номером групи.
10.Найбільш віддалений від ядра енергетичний рівень називають зовнішнім
Урок 14. Енергетичні рівні та підрівні; їх заповнення електронами в атомах елементів №1 - №20
1. Вправа «Незакінчені речення»
1. Кількість енергетичних рівнів в електронній оболонці атома визначають … .
2. Електрони з однаковою енергією об`єднуються в … , які позначаються п .
3. Максимальну кількість електронів на енергетичному рівні можна обчислити за формулою … .
4. Віддаль від ядра атома до зовнішнього енергетичного рівня - … .
5. Чим більший радіус атома, тим більше … сили притягання між ядром і електронами зовнішнього енергетичного рівня.
6. Якщо на рівні міститься більше двох електронів , які дещо відрізняються своєю енергією, рівень ділять на … , в межах яких електрони мають однакову енергію .
7. Кількість підрівнів дорівнює … .
8. На першому енергетичному рівні один підрівень, на другому - … , на третьому - … .
9. Максимальна кількість електронів на орбіталях:
На s-орбіталі - … електрони, на p- орбіталі ... електронів , на d-орбіталі - … електронів.
10. Кількість підрівнів дорівнює номеру … .
2. Робота в групах
І група. Дайте характеристику елемента Натрію на основі його розміщення у періодичній системі та будовою атома.
ІІ група. Дайте характеристику елемента Магнію на основі його розміщення у періодичній системі та будовою атома.
ІІІ група. Дайте характеристику елемента Алюмінію на основі його розміщення у періодичній системі та будовою атома.
ІV група. Дайте характеристику елемента Силіцію на основі його розміщення у періодичній системі та будовою атома.
V група. Дайте характеристику елемента Фосфору на основі його розміщення у періодичній системі та будовою атома.
VІ група. Дайте характеристику елемента Сульфуру на основі його розміщення у періодичній системі та будовою атома.
3. Самостійна робота
Виконайте завдання згідно свого варіанту
|
№ варіанту |
Назва елементу |
Заряд ядра |
пе |
пр |
пп |
Розподіл електронів по енергетичних рівнях |
Електронна формула |
Кількість неспарених електронів |
|
1 |
Алюміній |
|
|
|
|
|
|
|
|
2 |
Сульфур |
|
|
|
|
|
|
|
|
3 |
Кальцій |
|
|
|
|
|
|
|
|
4 |
Магній |
|
|
|
|
|
|
|
|
5 |
Силіцій |
|
|
|
|
|
|
|
|
6 |
Нітроген |
|
|
|
|
|
|
|
|
7 |
Оксиген |
|
|
|
|
|
|
|
|
8 |
Неон |
|
|
|
|
|
|
|
|
9 |
Аргон |
|
|
|
|
|
|
|
|
10 |
Фосфор |
|
|
|
|
|
|
|
|
11* |
Манган |
|
|
|
|
|
|
|
|
12* |
Ферум |
|
|
|
|
|
|
|
|
13* |
Титан |
|
|
|
|
|
|
|
|
14* |
Скандій |
|
|
|
|
|
|
|
- Перевірочна робота
а) Карбон; б) Натрій; в) Ферум.
2. Встановіть відповідність між електронною формулою та назвою елемента:
Електронна формула Елемент
А. 1s2 2s2 2p5; 1. Магній
Б. 1s2 2s2 2p6 ; 2.Флуор
В. 1s2 2s2 ; 3. Фосфор
Г. 1s2 2s2 2p6 3s2 . 4. Берилій
5. Неон.
3. Напишіть схему будови атома й електронну формулу запропонованих атомів, укажіть кількість вільних квантових комірок, кількість спарених і неспарених електронів:
а) Оксиген; б) Фосфор; в) Магній.
4. Просту речовину, утворену хімічним елементом, електронна формула зовнішнього енергетичного рівня якого — ...3s23p1, спалили в кисні. Напишіть рівняння реакції.
Варіант ІІ
1. Визначте положення атомів у періодичній системі хімічних елементів та обчисліть число протонів, нейтронів, електронів в атомах елементів:
а) Кальцій; б) Калій; в) Кобальт.
2. Встановіть відповідність між електронною формулою та назвою елемента:
Електронна формула Елемент
А. 1s2 2s2 2p4; 1. Натрій
Б. 1s2 2s2 2p6 ; 2.Оксиген
В. 1s2 2s2 2р6 3s2 3р3; 3. Фосфор
Г. 1s2 2s2 2p6 3s1. 4. Літій
5. Неон.
3. Напишіть схему будови атома й електронну формулу запропонованих атомів, укажіть кількість вільних квантових комірок, кількість спарених і неспарених електронів:
а) Алюміній; б) Берилій; в) Неон.
4. Просту речовину, утворену хімічним елементом, електронна формула зовнішнього енергетичного рівня якого — ...3s23p3, спалили в кисні. Напишіть рівняння реакції.
Варіант ІІІ
1. Визначте положення атомів у періодичній системі хімічних елементів та обчисліть число протонів, нейтронів, електронів в атомах елементів:
а) Нітроген; б) Калій; в) Магній.
2. Встановіть відповідність між електронною формулою та назвою елемента:
Електронна формула Елемент
А. 1s2 2s2 2p5; 1. Фосфор
Б. 1s2 2s2 2p6 ; 2.Флуор
В. 1s2 2s2 ; 3. Магній
Г. 1s2 2s2 2p6 3s2 . 4. Берилій
5. Неон.
3. Напишіть схему будови атома й електронну формулу запропонованих атомів, укажіть кількість вільних квантових комірок, кількість спарених і неспарених електронів:
а) Оксиген; б) Фосфор; в) Магній.
4. Просту речовину, утворену хімічним елементом, електронна формула зовнішнього енергетичного рівня якого — ...3s23p4, спалили в кисні. Напишіть рівняння реакції.
Варіант ІV
1. Визначте положення атомів у періодичній системі хімічних елементів та обчисліть число протонів, нейтронів, електронів в атомах елементів:
а) Магній; б) Калій; в) Ферум
2. Встановіть відповідність між електронною формулою та назвою елемента:
Електронна формула Елемент
А. 1s2 2s2 2p4; 1. Неон
Б. 1s2 2s2 2p6 ; 2.Оксиген
В. 1s2 2s2 2р6 3s2 3р3 ; 3. Фосфор
Г. 1s2 2s2 2p6 3s1. 4. Літій
5. Натрій.
3. Напишіть схему будови атома й електронну формулу запропонованих атомів, укажіть кількість вільних квантових комірок, кількість спарених і неспарених електронів:
а) Алюміній; б) Берилій; в) Неон.
4. Просту речовину, утворену хімічним елементом, електронна формула зовнішнього енергетичного рівня якого — ...3s23p2, спалили в кисні. Напишіть рівняння реакції.
Урок 15. Електронні та графічні електронні формули атомів. Поняття про радіус атомів.
- Хімічна естафета між двома рядами парт:
Літій Карбон
Берилій Магній
Алюміній Нітроген
Бор Силіцій
Оксиген Сульфур
Хлор Флуор
Неон Аргон
- Вставте пропущені слова:
Радіус атома – це … (відстань між ядром атома та зовнішнім енергетичним рівнем). Радіус атома Натрію більший, ніж в атома … (літію), бо вони розташовані в одній підгрупі і заряд ядра атома Натрію … (+11). Графічна електронна формула – це … (відображення розподілу електронів за енергетичними комірками). В одній комірці можуть найбільше перебувати … (2) електрони.
- Групова робота:
Група 1. Порівняйте будову атома Карбону та Силіцію.
Група 2. Порівняйте будову атома Калію та Літію.
Група 3. Порівняйте будову атома Сульфуру та Натрію.
Група 4. Порівняйте будову атома Алюмінію та Хлору.
- Складіть кольорову стрічку за збільшенням величини атомного радіуса:
![]()
![]()
![]()
![]()
![]()
![]()
Na H Rb Cs Li K
- Складіть кольорову стрічку за зменшенням атомного радіуса:
![]()
![]()
![]()
![]()
![]()
O F C B N
- Напишіть будову йонів Алюмінію, Магнію, Оксигену, Карбону.
Урок 16. Періодична система хімічних елементів з позиції теорії будови атома.
- «Мікрофон»:
- Який порядок заповнення електронами енергетичних рівнів та підрівнів?
- Скільки комірок необхідно для розміщення всіх електронів першого, другого, третього рівнів?
- У що перетворився б атом Магнію, якби віддав 2 електрони? (Йон Mg2+)
- Робота в групах:
- І група: Що спільного у будові електронних оболонок Берилію і Магнію? Відповідь підтвердьте записами електронних формул атомів.
- ІІ група: Що спільного у будові електронних оболонок Алюмінію і Сульфуру? Відповідь підтвердьте записами електронних формул атомів.
- ІІІ група: Що спільного у будові електронних оболонок Неону і Аргону? Відповідь підтвердьте записами електронних формул атомів.
- ІV група: Порівняйте будову атома та йона Карбону.
- V група: Порівняйте будову атома та йона Бору.
- Проаналізуйте зміну властивостей елементів ІІ періоду та їхніх сполук з позиції теорії будови атома.
- Проаналізуйте зміну властивостей елементів ІІІ групи та їхніх сполук з позиції теорії будови атома.
- Самостійна робота
І варіант
- Складіть електронні схеми атомів: Нітрогену, Аргону, Фосфору, Калію.
- Атоми яких елементів мають такі електронні формули:
а) 1s22s22p63s1; б) 1s22s22p63s23р2.
- Напишіть будову атома Карбону у збудженому стані.
- Складіть електронні схеми таких йонів: Са2+, О2-, АІ3+.
- Атом елемента має стільки електронів, скільки їх є в йона Магнію. Який це елемент?
- Напишіть рівняння реакції між простими речовинами, утвореними елементами, електронні формули атомів яких мають такі закінчення: …3s1 і …2s22p4.
ІІ варіант
- Складіть електронні схеми атомів: Силіцію, Оксигену, Алюмінію, Кальцію.
- Атоми яких елементів мають такі електронні формули:
а) 1s22s22p63s2; б) 1s22s22p63s23р5.
- Напишіть будову атома Фосфору у збудженому стані.
- Складіть електронні схеми таких йонів: Ве2+, С4-, СІ-.
- Атом елемента має на 3 електрони більше, ніж йон Калію. Який це елемент?
- Напишіть рівняння реакції між простими речовинами, утвореними елементами, електронні формули атомів яких мають такі закінчення: …3s23р1 і …2s22p4.
ІІІ варіант
- Складіть електронні схеми атомів: Гідрогену, Алюмінію, Гелію, Хлору.
- Атоми яких елементів мають такі електронні формули:
а) 1s22s22p63s23р1; б) 1s22s22p63s23р4.
- Напишіть будову атома Силіцію у збудженому стані.
- Складіть електронні схеми таких йонів: Мg2+, S2-, АІ3+.
- Атом елемента має стільки електронів, скільки їх є в йона Натрію. Який це елемент?
- Напишіть рівняння реакції між простими речовинами, утвореними елементами, електронні формули атомів яких мають такі закінчення: …2s1 і …2s22p5.
ІV варіант
- Складіть електронні схеми атомів: Сульфуру, Літію, Карбону, Флуору.
- Атоми яких елементів мають такі електронні формули:
а) 1s22s22p63s2; б) 1s22s22p63s23р6.
- Напишіть будову атома Сульфуру у збудженому стані.
- Складіть електронні схеми таких йонів: АІ3+, С4+, F-.
- Атом елемента має на 3 електрони більше, ніж йон Кальцію. Який це елемент?
- Напишіть рівняння реакції між простими речовинами, утвореними елементами, електронні формули атомів яких мають такі закінчення: …3s23р2 і …2s22p4.
Оцінювання завдань самостійної роботи: 2 бали кожне завдання.
6. Індивідуальні завдання: напишіть будову атома №3, № 12, № 5, №8, №18, №20.
7. Хімічний диктант: електронна орбіталь, р-елементи, радіус атома, період, група, побічна підгрупа, періодичний закон (сучасне формулювання), протон, нейтрон, електрон, протонне число, нуклонне число.
(За кожне правильне визначення – 0,5 бала).
Урок 17. Характеристика хімічних елементів №1 - №20 за їх місцем у періодичній системі та будовою атома. Значення періодичного закону.
- Робота в групах:
Група 1. Що спільного та відмінного в будові атомів елементів ІІІ періоду?
Група 2. Що спільного та відмінного в атомів елементів ІІА групи?
Група 3. Порівняйте властивості інертних газів та галогенів з позиції теорії будови атомів та за місцем розташування у ПС.
Група 4. Порівняйте властивості лужних металів та галогенів з позиції теорії будови атомів та за місцем розташування у ПС.
(Робота в групі оцінюється до 6 балів)
- Самостійна робота (10 хв.) оцінюється у 2 бали за кожну вправу.
І варіант
- Поясніть, чому Натрій, порівняно з Магнієм, сильніше виявляє металічні властивості.
- Гідрат якого оксиду – СО2 чи N2О5 – має сильніше виражені кислотні властивості? Відповідь обґрунтуйте.
- Порівняйте в елементів ІІІ періоду металічні та неметалічні властивості простих і складних речовин, форми оксидів і гідратів оксидів, валентність елементів у них. Чи відповідають результати вашого порівняння висновку, що в межах одного періоду відбувається поступовий перехід від металічних властивостей хімічних елементів та їх сполук до неметалічних?
ІІ варіант
- Поясніть, чому Хлор, порівняно з Фосфором, сильніше виявляє неметалічні властивості.
- Гідрат якого оксиду – СаО чи АІ2О3 – має сильніше виражені основні властивості? Відповідь обґрунтуйте.
- За місцем у ПС хімічних елементів з порядковими номерами 52 і 56 спрогнозуйте хімічний характер їх оксидів та поясніть свій вибір.
3. Розв'яжіть задачі та вправи:
- Напишіть визначення періодичного закону за Д.І. Менделєєвим.
- Охарактеризуйте елемент № 5.
- Елемент утворює з Гідрогеном летку водневу сполуку, формула якої Н2Е. Про який елемент йдеться, якщо відомо, що його атом має на три енергетичних рівні більше, ніж найпоширеніший у природі елемент?
- Напишіть визначення періодичного закону за сучасним формулюванням.
- Охарактеризуйте елемент № 7.
- Елемент утворює з Гідрогеном летку водневу сполуку, формула якої НЕ. Про який елемент йдеться, якщо відомо, що його атом має на 2 електрони більше, ніж йон Натрію?
4. «Мікрофон»:
1. Якими особливостями будови атомів зумовлюються металічні властивості елементів?
2. Якими особливостями будови атомів зумовлюються неметалічні властивості елементів?
3. Користуючись таблицею, опишіть за місцем у періодичній системі та за будовою атомів елементи з порядковими номерами 3 і 15.
4. Назвіть елементи, що мають таку будову електронних оболонок, дайте характеристику цим елементам за положенням у періодичній системі:
А) 1S22S22P3, Б) 1S22S22P63S23P1.
Урок 18. Залікова робота №1 з теми «Періодичний закон і періодична система хімічних елементів Д.І.Менделєєва». (ІІ частина)
Варіант 1
І рівень
1. Вкажіть формулу вищого оксиду, хімічного елемента з протонним числом 7: а) R2O; б) R2O5; в) RO; г) R2O3.
2. До однієї групи належать елементи з порядковими номерами: а) 12; б) 20; в) 21.
- ( а,б ); 2 ( б,в ); 3 ( а,в ).
3. В зазначеному переліку знаків хімічних елементів: Fe, N, Li, C, Cu більше елементів:
а) металічних; б) неметалічних.
(кожне завдання – 1 бал)
ІІ рівень
- Сформулюйте визначення періодичного закону.
- Скільки неспарених електронів має атом Флуору?
а) 7; б) 1; в) жодного. Відповідь мотивуйте?
- Вкажіть порядкові номери елементів, що здатні утворювати сполуку з воднем типу RH3:
а) 5 і 6; б) 7 і 8; в) 7 і 15.
(кожне завдання – 1 бал)
ІІІ рівень
- Дайте характеристику хімічному елементу з порядковим номером 10 згідно положення у періодичній системі.
(2 бали)
2. В будові атомів елементів з порядковими номерами 5 і 8 спільне:
а) заряд ядра; б) кількість електронів; в) кількість електронних рівнів; г) кількість електронів на зовнішньому енергетичному рівні. Відповідь підтвердіть.
(1 бал)
IV рівень
- Порівняйте будову атома та йона магнію.
(3 бали)
Варіант 2
І рівень
- Який з елементів утворює летку водневу сполуку типу RH4: а) Р; б) Si; в) S ?
- Вкажіть протонні числа елементів, що належать до одного періоду: а) 17; б) 18; в) 19.
1 ( а,б ); 2 ( б,в ) 3 ( а,в )
- Назвіть елементи головних підгруп:
а) Mg; б) V; в) Li; г) Mo.
(кожне завдання – 1 бал)
ІІ рівень
- Сформулюйте визначення періоду?
- Вкажіть порядковий номер елемента, атом якого має на зовнішньому рівні 3 електрони:
а) 3; б) 5; в) 7. Відповідь підтвердіть.
- Які хімічні властивості проявляє вищий оксид елемента з порядковим № 13?
а) основні; б) кислотні; в) амфотерні.
(кожне завдання – 1 бал)
ІІІ рівень
- В будові атомів елементів з порядковими номерами 4 і 12 спільне:
а) заряд ядра; б) кількість протонів; в) кількість електронних рівнів; г) кількість електронів на зовнішньому енергетичному рівні. Відповідь мотивуйте.
(1 бал)
- Дайте характеристику хімічного елемента № 3 згідно положення у періодичній системі.
(2 бали)
IV рівень
- Порівняйте будову атома та йона алюмінію.
(3 бали)
Варіант 3
І рівень
- Скільки нейтронів, містить ядро атома елемента з порядковим номером 18?
а) 22; б) 8; в) 3.
2. Вкажіть протонні числа елементів, що належать до однієї групи: а) 6 і 16; б) 6 і 22; в) 16 і 22.
3. Елемент з протонним числом 13 утворює вищий оксид типу: а) R2O; б) RO; в) R2O3.
(кожне завдання – 1 бал)
ІІ рівень
- Сформулюйте визначення групи?
- Назвіть елемент за будовою електронної оболонки атома:
1S22S22P63S23P1.
- Однакову кількість електронів на зовнішньому рівні мають атоми елементів з порядковими номерами:
а) 4 і 12; б) 12 і 13.
(кожне завдання – 1 бал)
ІІІ рівень
- За місцем у періодичній системі охарактеризуйте елемент № 17.
(2 бали)
- В будові атомів елементів з порядковими номерами
14 і 18 спільна кількість:
а) електронів; б) нейтронів; в) електронних рівнів;
г) електронів на зовнішньому енергетичному рівні.
Відповідь мотивуйте.
(1 бал)
IV рівень
- Порівняйте будову атома та йона натрію.
(3 бали)
Варіант 4
І рівень
- Скільки протонів містить ядро атома елемента з порядковим номером 11?
а) 23; б) 12; в) 11.
- В зазначеному переліку знаків хімічних елементів:
Cu, Mg, P, S, Cl більше елементів:
а) металічних; б) неметалічних.
3. Який з елементів утворює летку водневу сполуку типу RH: а) Р; б) С; в) Br.
(кожне завдання – 1 бал)
ІІ рівень
- Що таке протони?
- Скільки неспарених електронів має атом Берилію:
а) 2; б) 1; в) жодного.
- Які хімічні властивості проявляє вищий оксид елемента з протонним числом 15:
а) основні; б) кислотні; в) амфотерні.
(кожне завдання – 1 бал)
ІІІ рівень
- В будові атомів елементів з порядковими номерами 5 і 13 спільна кількість:
а) нейтронів; б) протонів; в) електронних рівнів;
г) електронів на зовнішньому енергетичному рівні.
Відповідь мотивуйте.
(1 бал)
- Дайте характеристику хімічного елемента з порядковим номером 6. Відповідно до положення у періодичній системі.
(2 бали)
IV рівень
- Невідомий метал І групи утворює оксид з молекулярною масою 30. Який це метал?
(3 бали)
Урок 19. Представлення результатів навчальних проектів:
- З історії відкриття періодичної системи хімічних елементів.
- Форми періодичної системи хімічних елементів.
Урок 20. Хімічний зв'язок і будова речовини. Природа хімічного зв'язку. Електронегативність елементів.
1. Бесіда з критичним мисленням:
1. Що вам відомо про будову атома ?
2. Назвіть хімічні елементи періодичної системи, що мають завершений зовнішній енергетичний рівень.
3. Наведіть приклади хімічних елементів з незавершеним зовнішнім енергетичним рівнем.
4. За якими властивостями відрізняються елементи із завершеним і незавершеним зовнішнім енергетичним рівнем?
5. Наведіть приклади елементів-металів.
6. Наведіть приклади елементів-неметалів.
7. Чим відрізняється будова зовнішнього енергетичного рівня в елементів металів і неметалів?
8. Наведіть приклади s-елементів, p-елементів, d-елементів, f-елементів.
2. Метод «Критичне читання тексту»
Обговорення прочитаного тексту відбуватиметься за планом:
- Яке запитання автор ставить у даному фрагменті тексту?
- Яка відповідь пропонується?
- Які факти та докази наведені у тексті підтверджують відповідь на поставлене запитання?
- З якими вагомими (невідомими) словами ви зустрілися у тексті?
- Якої інформації, на вашу думку бракує у даному фрагменті?
Текст
У природі рідко можна зустріти атоми у вільному стані. Найчастіше вони утворюють велику кількість сполук з іншими атомами. Причина стійкості молекул полягає в тому, що між сполученими атомами в молекулі виникає хімічний зв’язок, в утворенні якого головну роль відіграють електрони зовнішнього рівня.
Хімічний зв’язок – це досить складне поняття. Можна сказати, що він утворюється за рахунок взаємодії всіх електронів і всіх ядер атомів, які входять до складу молекул.
Атом складається з позитивно зарядженого ядра і електронів. Найпростіший атом – атом Гідрогену – містить всього один неспарений електрон, що перебуває на першому енергетичному рівні. При зближенні двох атомів Гідрогену ядро одного з них притягує електрон іншого атома, і навпаки. Між атомами виникає взаємодія, і відстань між ними зменшується доти, поки взаємне притягання не врівноважиться відштовхуванням ядер. У молекулі, що утворилася, електронна густина у просторі між ядрами виявляється підвищеною. Дві електронні хмари атомів поєднуються в єдину електронну хмару молекули.
Основна причина утворення зв’язку між атомами — їх прагнення утворити стійку електронну конфігурацію зовнішнього енергетичного рівня. Таким рівнем можна вважати восьмиелектронний завершений рівень ns2np6, наприклад, у інертних елементів. Завершений рівень характеризується високою міцністю і стійкістю. У процесі хімічної взаємодії атоми прагнуть перетворити зовнішній енергетичний рівень так, щоб він став завершеним.
У процесі утворення хімічного зв’язку атоми перебудовують зовнішній енергетичний рівень. При цьому атоми можуть віддавати або приєднувати (частково чи повністю) електрони зовнішнього енергетичного рівня. Учення про будову атомів пояснює механізм утворення молекул простих і складних речовин, а також природу хімічного зв’язку. Неспарені електрони різних хімічних елементів здатні утворювати спільні електронні пари. При утворенні спільної електронної пари двома атомами різних хімічних елементів один з них притягує її сильніше, ніж інший.
Кількісно здатність притягувати електрони зовнішнього енергетичного рівня інших атомів вимірюється поняттям електронегативності. Поняття «електронегативність» введено для розуміння змісту хімічного зв’язку між атомами різних хімічних елементів.
Поняттям електронегативності кількісно вимірюється здатність притягувати електрони зовнішнього енергетичного рівня інших атомів.
Електронегативність – це здатність атома відтягувати до себе електрони атомів інших елементів у сполуках.
- Бліц-опитування:
- У чому причина утворення хімічного зв’язку між атомами?
- Чому атоми різних елементів утримуються один біля одного?
- Яке поняття введено для розуміння змісту хімічного зв’язку між атомами різних хімічних елементів ?
- Що таке електронегативність?
- Який елемент має найбільшу електронегативність?
- Який елемент має найменшу електронегативність?
- В яких елементів — металів чи неметалів — електронегативність менша?
- Розмістити елементи в порядку зростання електронегативності: барій, стронцій, кальцій, берилій, магній, радій.
Урок 21. Ковалентний зв'язок, його утворення.
- Робота біля дошки:
1. Двоє учнів будують електронні формули атомів Літію та Хлору.
2. Як перетворити зовнішній енергетичний рівень цих атомів на завершений?
3. Який стан енергетично більш вигідний — Li чи Li+; F чи F−?
2. Робота в групах:
Група 1. Зобразіть утворення ковалентного зв’язку у формулах: азоту, фтору, брому.
Група 2. Опишіть механізм утворення ковалентного зв’язку у молекулах амоніаку та метану.
Група 3. Зобразіть утворення зв’язку у молекулах вуглекислого та чадного газів. Порівняйте їх.
Група 4. Опишіть механізм утворення молекули сірководню та гідроген броміду.
1. На які види поділяється ковалентний зв’язок?
2. Як можна визначити, полярним чи неполярним ковалентним зв’язком утворена молекула певної речовини?
3. За яким принципом утворюється ковалентний зв’язок?
4. Серед наведених молекул укажіть молекули, утворені ковалентним полярним зв’язком: HBr, N2, N2O5, O2, H2O, H2S.
5. Складіть схему утворення вищеназваних молекул.
Урок 22. Полярний і неполярний ковалентний зв'язок.
- Складання таблиці
|
№ з/п |
Формули речовин |
Назви речовин |
Тип зв’язку |
Механізм утворення |
|
1 |
|
Водень |
|
|
|
2 |
|
Чадний газ |
|
|
|
3 |
|
Хлор |
|
|
|
4 |
|
Вода |
|
|
- Групова робота
Група 1. Порівняйте механізм утворення зв’язку у молекулах азоту та амоніаку (NH3).
Група 2. Порівняйте механізм утворення зв’язку у молекулах вуглекислого та чадного газів.
Група 3. Порівняйте механізм утворення зв’язку у молекулах кисню та азоту.
Група 4. Порівняйте механізм утворення зв’язку у молекулах метану (СН4) та водню.
- «Мікрофон»: Зв'язок у яких молекул міцніший: в азоту, кисню чи водню? Відповідь поясніть.
- Гра «Вірю – не вірю»:
- Хімічний зв'язок – це зв'язок між однаковими молекулами у речовині.
- Ковалентний зв'язок утворюється за допомогою спільних електронних пар.
- Ковалентний зв'язок буває двох видів: полярний та неполярний.
- Ковалентний зв'язок буває трьох видів: полярний, йонний та неполярний.
- Ковалентний зв'язок буває чотирьох видів: полярний, водневий, йонний та неполярний.
- Всі речовини утворені ковалентним зв’язком.
- Усі речовини утворені трьома типами зв’язку.
- Водневий зв'язок – це міжмолекулярний зв'язок.
- Ковалентний та йонний зв'язок – це зв'язок всередині однієї молекули.
- Молекули кухонної солі утворені ковалентним полярним зв’язком.
- Молекули хлороводню утворені ковалентним неполярним зв’язком.
- Молекули азоту утворені потрійним неполярним зв’язком.
ВІДПОВІДІ: 1-, 2+, 3+, 4-, 5-, 6-, 7+, 8+, 9+, 10-, 11-, 12+.
Оцінювання гри: кожна відповідь правильна – 0,5 бала.
- Фронтальне опитування (на етапі закріплення):
1. Які види хімічного зв’язку ви знаєте?
2. Напишіть електронні та структурні формули молекул (три учні біля дошки): PH3, H2O, O2. Назвіть вид хімічного зв’язку й електрони, що беруть участь в утворенні зв’язку в цих молекулах.
3. Чому в молекулах простих речовин ділянка електронної густини після перекривання орбіталей розташовується симетрично відносно ядер атомів?
4. Поясніть, з погляду будови атома, чому молекули інертних елементів складаються з окремих атомів.
Урок 23. Електронні формули молекул. Йони. Йонний зв'язок, його утворення.
- Групова робота
Група 1
Завдання 1. Атом елемента має на чотири електрони менше, ніж йон Магнію.
Назвіть цей елемент, складіть електронну формулу атома.
Група 2
Завдання 1. Атом елемента має на чотири електрони більше, ніж йон Натрію.
Назвіть цей елемент, складіть електронну формулу атома.
Група 3
Завдання 1. Атом елемента має на 5 електронів більше, ніж йон Літію.
Назвіть цей елемент, складіть електронну формулу атома.
Група 4
Завдання 1. Атом елемента має на три електрони менше, ніж йон Калію. Назвіть
цей елемент, складіть електронну формулу атома.
Завдання 2 (для усіх груп).
Складіть схему утворення хімічного зв’язку цього елемента:
а) з Оксигеном;
б) з Гідрогеном.
Опишіть на підставі будови атома, якими електронами утворений хімічний зв’язок у сполуках з Гідрогеном.
- Мозковий штурм – відповідь на поставлені проблемні запитання: Чим цей зв'язок відрізняється від ковалентного? Які сили взаємодії беруть участь в утворенні цього зв'язку?
- Вправи:
2.1. Порівняйте будову атома Магнію та його йона.
2.2. Порівняйте будову атома Хлору та його йона.
2.3. Атом елемента має на 1 електрон більше, ніж йон Кальцію. Який це елемент?
2.4. Атом елемента має на 5 електронів менше, ніж йон Хлору. Назвіть цей елемент.
4. Тестовий контроль:
- Хімічний зв'язок виникає внаслідок: а) електростатичної взаємодії йонів; б) електростатичної взаємодії позитивно заряджених ядер та негативно заряджених електронів.
- Електронегативність атомів – це властивість атомів:
а) віддавати електрони атомам інших елементів;
б) відтягувати на себе електрони від інших атомів;
в) приєднувати електрони від інших атомів.
- Ковалентний хімічний зв'язок утворений за допомогою:
а) спільних електронних пар, що зміщені до більш електронегативного елемента; б) спільних електронних пар; в) спільних електронних пар, що розміщені симетрично.
- Йони утворилися з: а) атомів внаслідок втрати або приєднання до них електронів; б) атомів тільки внаслідок приєднання електронів; в) атомів тільки внаслідок втрати електронів; г) атомів або атомних груп внаслідок втрати ними або приєднання до них електронів.
- У вузлах йонних кристалічних граток розміщені: а) атоми; б) неполярні молекули; в) позитивно і негативно заряджені йони.
- Речовини, що мають атомні кристалічні ґратки, характеризуються такими властивостями ……… (тверді, висока температура плавлення та кипіння, нерозчинні у воді).
Взаємоперевірка учнями: кожне завдання – 1 бал (разом – 6 балів, решту балів учні отримають під час інших частин уроку), перевіряють зошити сусіди по парті.
Урок 24. Ступінь окиснення. Визначення ступеня окиснення за хімічною формулою сполуки.
1. Правила для визначення ступеня окиснення у сполуках:
- Ступінь окиснення простих речовин дорівнює 0.
- Гідроген має ступінь окиснення +1, крім сполук гідридів, де він проявляє - 1.
- Оксиген має ступінь окиснення -2 у всіх сполуках, крім пероксиду водню та оксиду флуору, де Оксиген проявляє ступінь окиснення -1 та +1 відповідно.
- Кількість «+» у молекулі має дорівнювати кількості «-», тобто алгебраїчна сума «+» і «-» має бути рівна нулю.
- Ступінь окиснення лужних металів дорівнює +1.
- Позитивний ступінь окиснення ставиться на першому місці у формулі.
- Номер групи чисельно дорівнює найвищому позитивному ступеню окиснення елемента.
- Вправи для учнів: визначити ступінь окиснення у формулах: H2O, SO2, SO3, KCl, NaJ, Na2S, HNO3, Ca(OH)2, H2SO4, H2SO3, Cu(OH)2, LiOH, Ca3(PO4)2, H3PO4, Al2O3.
- Складіть кольорову стрічку за збільшенням ступеня окиснення Нітрогену:






Na3N N2O5 N2O N2 N2O3 NO2
- Заповніть таблицю:
|
№ з/п |
Назва речовини |
Формула |
Ступінь окиснення першого елемента |
Ступінь окиснення другого елемента |
|
1 |
Кухонна сіль |
|
|
|
|
2 |
Мідний купорос |
|
|
|
|
3 |
Калій карбонат |
|
|
|
|
4 |
Аргентум нітрат |
|
|
|
|
5 |
Пісок |
|
|
|
-
Термінологічний хімічний диктант:
- Хімічний зв'язок – це … (зв'язок між атомами речовини).
- Йонний зв'язок – це зв'язок … (між атомами металу і неметалу, який утворюється за допомогою електростатичної взаємодії між ними).
- Йони – це … (заряджені частинки).
- Аніони – це … (негативно заряджені частинки).
- Катіони – це … (позитивно заряджені частинки).
- Молекула кухонної солі утворена … (йонним зв’язком).
- Речовини з йонним зв’язком мають високу … (температуру плавлення).
- Речовини з йонним зв’язком по відношенню до води є … (добре розчинні у воді).
- Молекула купрум(ІІ) хлориду відрізняється від гідроген хлориду … зв’язком (йонним).
- Речовини з йонним зв’язком під час розчинення у воді утворюють … (йони).
- Приклади речовин з йонним зв’язком: … (KCl, NaJ, Na2S, тощо).
- Усі металічні елементи утворюють з неметалічними молекули за рахунок … (електростатичного притягання йонів).
Оцінювання: по 0,5 бала за кожну правильну відповідь.
Урок 25. Складання формул сполук за відомими ступенями окиснення елементів.
1. Завдання для класу (фронтально):
1. Визначте вид хімічного зв’язку і усно розрахуйте ступені окиснення атомів у сполуках: NaF, CO2, O2, H3P, NO, KCl, Cl2, BF3, SO3, P2O5.
2. Як зміниться ступінь окиснення атома Сульфуру внаслідок окиснення сульфур (IV) оксиду до сульфур (VI) оксиду? Запишіть рівняння хімічної реакції.
3. Віддав чи приєднав при цьому електрони атом Сульфуру у такому процесі:
S+4 − 2e− →S+6
- Самостійна робота:
Завдання 1. Обчисліть кількість відданих або прийнятих електронів відповідно до схеми. Укажіть процеси окиснення й відновлення:
Cl0 → Cl−
Sn+2 → Sn+4
N+5 → N−3
S+6 → S−2
P0 → P+5
Mn+7 → Mn+2
Завдання 2. В якому ступені окиснення атоми можуть виявляти відновні властивості?
Завдання 3. Чи можуть йони виявляти відновні властивості?
Завдання 4. На підставі будови атома обчисліть вищий і нижчий ступені окиснення атомів Сульфуру, Нітрогену, Хлору. Укажіть, у якому ступені окиснення ці атоми виявляють окисні властивості, у якому — відновні.
Завдання 5. Обчисліть ступені окиснення атомів у формулах хімічних речовин, що беруть участь у хімічних реакціях, укажіть окисник, відновник:
CuO + H2 → CuO+H2O
H0 −1e− → H+ — відновник
Cu+2 + 2e− → Cu0 — окисник
Завдання 6. Допишіть рівняння, розрахуйте ступені окиснення атомів, укажіть окисник і відновник:
а) Mg + O2 → б) Al + Br2 →
в) Zn + H2SO4 → г) P + O2 →
д) Mg + Cl2 → е) Mg + HCl →
ж) Ca + O2 → з) H2 + O2 →
и) Al + I2 → к) Na + Cl2 →
л) P + Ca → м) FeO + H2 →
н) Li + N2 → о) N2 + H2 →
Оцінювання: кожне завдання – 2 бали.
-
Вправи:
- Складіть формули сполук з Оксигеном таких елементів: Купруму (+2), Хлору (+7), Натрію (+1), Сульфуру (+4), Сульфуру (+6), Ніколу (+3).
- Складіть формули металічних елементів ІІА групи з Сульфуром, знаючи, що останній має ступінь окиснення +2.
- Складіть формули неметалічних елементів головної підгрупи VІІ групи з Алюмінієм.
- Складіть усі можливі формули хімічних сполук, утворених хімічним елементом Нітрогеном з Оксигеном, знаючи, що перший проявляє усі додатні ступені окиснення від 1 до 5.
- Заповніть таблицю:
|
|
Cl (-1) |
F |
S (-2) |
N (-3) |
|
Са |
|
|
|
|
|
Li |
|
|
|
|
|
Al |
|
|
|
|
|
Mn (+4) |
|
|
|
|
Уроки 26, 27. Кристалічні гратки. Атомні, молекулярні та йонні кристали. Залежність фізичних властивостей речовин від типів кристалічних ґраток.
- Заповніть таблицю:
|
|
Йонна |
Атомна |
Молекулярна |
Металічна |
|
Частинки, з яких складаються ґратки |
Йони |
Атоми |
Молекули |
Атоми і позитивні йони |
|
Властивості |
Тверді, кристалічні речовини, з високими температурами плавлення і кипіння |
Тверді, кристалічні, практично нерозчинні у розчинниках, з дуже високими температурами плавлення і кипіння |
Не тверді, легкоплавкі, леткі |
Тверді, проводять струм, тепло |
|
Сили взаємодії |
Електростатичне притягання «+» і «-». |
Взаємне протягування атомів за допомогою спільних електронних пар |
Сили Ван-дер-Ваальса дуже слабкі (міжмолеку-лярна взаємодія) |
Електро-статичне притягання «+» і «-». |
|
Приклади речовин |
Майже всі солі, основні оксиди, гідроксиди |
Силіцій, бор, алмаз, графіт, кремній карбід |
Хлор, йод, вода, спирт, амоніак, нафталін |
метали |
- «Мікрофон»: Поясніть залежність фізичних властивостей речовин від типу кристалічної ґратки.
-
Вправи:
- Яку кристалічну ґратку має NaCl: а) молекулярну; б) атомну; в) йонну;
г) металічну.
- Вкажіть формулу сполуки, в якій Карбон проявляє ступінь окиснення -4:
а) СО; б) СО2; в) СН4.
- Порівняйте різні типи кристалічних ґраток.
- Визначте ступені окиснення елементів у сполуках: Al, H2SiO3, AgCl, O2 .
- Електронегативність елементів зростає в ряду: а) Se, S, O; б) Be, Mg, Ca.
3.6. Знаючи ступені окиснення елементів, напишіть формули сполук:
а) Sn+2OH-1; б) Ag+1SO3-2 ; в) B+3O-2.
- Самостійна робота на чотири варіанти.
Варіант 1
І рівень
- Електронегативність елементів зростає в ряду:
а) Li, Na, K; б) I, Br, Cl .
- Яку кристалічну ґратку має алмаз?
а) молекулярну; б) йонну; в) металічну; г) атомну.
- Вкажіть тип хімічного зв’язку в молекулі хлору ( Cl2 ):
а) йонний; б) ковалентний полярний;
в) ковалентний неполярний.
(кожне завдання – 1 бал)
ІІ рівень
- Сформулюйте визначення ступеня окиснення ?
- Вкажіть формулу сполуки, в якій Нітроген проявляє ступінь окиснення +3:
а) HNO2; б) AgNO3; в) HNO3.
- Серед наведених формул випишіть формулу сполуки з йонний зв’язком:
а) KF; б) F2; в) PH3 .
(кожне завдання – 1 бал)
ІІІ рівень
- Визначте ступені окиснення елементів у сполуках:
CH4, Zn, H2SO4, Mg .
(1 бал)
- Який тип зв’язку в сполуці PH3? Поясніть механізм його утворення.
(2 бали)
IV рівень
1. Знаючи ступені окиснення елементів, напишіть формули сполук: а) Mg+2Cl-1; б) Fe+2OH-1; в) Ca+2PO4-3 .
(1 бал)
- Складіть формули речовин, в яких Сульфур проявляє такі ступені окиснення:
S0 ; S+4 ; S+6 .
(2 бали)
Варіант 2
І рівень
- Електронегативність елементів зменшується в ряду:
а) Al, Mg, Na; б) Ge, Si, C .
- Яку кристалічну ґратку має вода ?
а) молекулярну; б) атомну; в) йонну; г) металічну.
- Вкажіть тип хімічного зв’язку в молекулі HBr:
а) йонний; б) ковалентний полярний;
в) ковалентний неполярний.
(кожне завдання – 1 бал)
ІІ рівень
- Сформулюйте визначення електронегативності?
- Вкажіть формулу сполуки, в якій Хлор виявляє ступінь окиснення +1:
а) KClO3; б) KClO; в) KCl.
- Серед наведених формул випишіть формулу сполуки з ковалентним полярним зв’язком:
а) H2; б) NH3; в) NaCl.
(кожне завдання – 1 бал)
ІІІ рівень
- Визначте ступені окиснення елементів у сполуках:
K2S, J2, HNO3, C .
(1 бал)
- Який тип зв’язку в сполуці КF? Поясніть механізм його утворення.
(2 бали)
IV рівень
1. Знаючи ступені окиснення елементів, напишіть формули сполук: а) Li+1S-2;
б) Cr+3OH-1; в) Fe+2NO3-1.
(1 бал)
2. Складіть формули речовин, в яких Магній проявляє такі ступені окиснення:
Mg0 ; Mg+2 .
(2 бали)
Варіант 3
І рівень
- Електронегативність елементів зростає в ряду:
а) Se, S, O; б) Be, Mg, Ca.
- Яку кристалічну ґратку має натрій хлорид?
а) молекулярну; б) атомну; в) йонну; г) металічну.
- Вкажіть тип хімічного зв’язку в молекулі CaF2:
а) йонний; б) ковалентний полярний;
в) ковалентний неполярний.
(кожне завдання – 1 бал)
ІІ рівень
- Який зв’язок називається ковалентним зв’язком?
- Вкажіть формулу сполуки, в якій Хром проявляє ступінь окиснення +6:
а) Cr2O3; б) H2CrO4; в) Cr(OH)3 .
- Серед наведених формул випишіть формулу сполуки з ковалентним неполярним зв’язком:
а) N2; MgO; LiF.
(кожне завдання –1 бал)
ІІІ рівень
- Визначте ступені окиснення елементів у сполуках:
Al, H2SiO3, AgCl, O2 .
(1 бал)
- Який тип зв’язку в сполуці F2? Поясніть механізм його утворення.
(2 бали)
IV рівень
- Знаючи ступені окиснення елементів, напишіть формули сполук: а) Ca+2OH-1; б) Ag+1SO3-2; в) Al+3O-2 .
(1 бал)
- Складіть формули речовин, в яких Фосфор проявляє такі ступені окиснення:
Р0 ; Р+5 .
(2 бали)
Варіант 4
І рівень
- Електронегативність елементів спадає в ряду:
а) C, Si, Ge; б) Br, Cl, F.
- Яку кристалічну ґратку має силіцій?
а) молекулярну; б) атомну; в) йонну; г) металічну.
- Вкажіть тип хімічного зв’язку в молекулі водню (Н2):
а) йонний; б) ковалентний полярний;
в) ковалентний неполярний.
(кожне завдання – 1 бал)
ІІ рівень
- Який зв’язок називається ковалентним полярним зв’язком ?
- Вкажіть формулу сполуки, в якій Сульфур проявляє ступінь окиснення +4:
а) H2S; б) CaSO3; в) MgSO4 .
- Серед наведених формул, випишіть формулу сполуки з йонним зв’язком :
а) Cl2, б) HCl, в) CaCl2 .
(кожне завдання – 1 бал)
ІІІ рівень
- Визначте ступені окиснення елементів у сполуках:
Co, PbSO4, Na2S, Cu.
(1 бал)
- Який тип зв’язку в сполуці О2? Поясніть механізм його утворення.
(2 бали)
IV рівень
- Знаючи ступені окиснення елементів, напишіть формули сполук: а) K+1OH-1;
б) Na+1PO4-3; в) B+3Cl-1.
(1 бал)
- Складіть формули речовин, в яких цинк проявляє такі ступені окиснення:
Zn+2 ; Zn0 .
(2 бали)
Урок 28. Самостійна робота з теми «Хімічний зв'язок і будова речовини».
Варіант 1
І рівень
1. Який тип хімічного зв’язку називається ковалентним полярним зв’язком?
2. Визначте, який тип хімічного зв’язку у сполуках, поданих формулами: NH3, F2, CaBr2.
3. Вкажіть ряд сполук, в якому елементи розміщені в порядку зменшення ступеня окиснення елементів:
а) SO3, SO2 ; б) Na2O, MgO .
(кожне завдання – 1 бал)
ІІ рівень
- Напишіть визначення йонів.
- Чим відрізняється тип хімічного зв’язку сполуках, поданих формулами: F2 і KF?
- Які частинки розміщені в вузлах кристалічної ґратки кухонної солі (NaCl)?
(кожне завдання – 1 бал)
ІІІ рівень
- У якій сполуці ступінь окиснення Хлору найвищий:
Cl2, Cl2O, Cl2O7, KClO3.
- Атом елемента має на 2 електрони більше, ніж йон Фтору. Назвіть елемент, напишіть електронні формули його атома і йона.
- На основі електронної формули Калію поясніть, чому Калій утворює йон з зарядом +1?
(кожне завдання – 1 бал)
IV рівень
- В молекулах водню чи азоту зв’язок між атомами міцніший? Відповідь обґрунтуйте.
(3 бали)
Варіант 2
І рівень
1. Який тип хімічного зв’язку називається йонним зв’язком?
2. Визначте, який тип зв’язку у сполуках, поданих формулами: N2, CH4, K2S.
- Вкажіть ряд сполук, в якому елементи розміщені в порядку збільшення ступеня окиснення елементів:
а) СО2, Р2О5; б) СН4, SiН4.
(кожне завдання – 1 бал)
ІІ рівень
- Які типи кристалічних решіток ви знаєте?
- Чим відрізняється тип хімічного зв’язку у сполуках, поданих формулами: HBr і NaBr?
- Які частинки розміщені в вузлах кристалічної ґратки натрій фториду (NaF) ?
(кожне завдання – 1 бал)
ІІІ рівень
- У якій сполуці ступінь окиснення Мангану найменший:
MnSO4, MnO, MnO2, KMnO4 .
- Атом елемента має на 4 електрони менше ніж йон Оксигену. Назвіть елемент, напишіть електронні формули його атома і йона.
- На основі електронної формули Оксигену поясніть, чому Оксиген утворює йон з зарядом –2?
(кожне завдання – 1 бал)
IV рівень
- В молекулах фтору чи кисню зв’язок між атомами міцніший? Відповідь поясніть.
(3 бали)
Варіант 3
І рівень
- Ступінь окиснення атомів у простих речовинах дорівнює:
а) 0; б) +1; в) –1.
2. Визначте, який тип зв'язку у сполуках, поданих формулами: H2, HCl, NaCl .
3. Вкажіть ряд сполук, в якому елементи розміщені в порядку зменшення ступеня окиснення елементів:
а) К2О, MgO; б) CO2, CO .
(кожне завдання – 1 бал)
ІІ рівень
- Який зв’язок називається ковалентним неполярним зв’язком?
- Вкажіть вищий ступінь окиснення Сульфуру.
- Які частинки розміщені в вузлах кристалічної ґратки води?
(кожне завдання – 1 бал)
ІІІ рівень
- У якій сполуці ступінь окиснення Хрому найвищий:
Cr(OH)3, CrO3, CrO, CrCl3.
- Атом елемента має на 5 електронів більше, ніж йон Магнію. Назвіть елемент, напишіть електронні формули його атома та йона.
- На основі електронної формули Алюмінію поясніть, чому Алюміній утворює йон з зарядом +3 ?
(кожне завдання – 1 бал)
IV рівень
- В молекулах кисню чи водню зв’язок між атомами сильніший? Відповідь поясніть.
(3 бали)
Варіант 4
І рівень
- Сума ступенів окиснення атомів у хімічній сполуці завжди дорівнює:
а) 0 ; б) –1; в) +1.
2. Визначте, який тип зв'язку у сполуках поданих формулами: MgF2, O2, H2O.
3. Вкажіть ряд сполук, в якому елементи розміщені в порядку збільшення ступеня окиснення елементів:
а) NaCl, AlCl3; б) H2, O2 .
(кожне завдання – 1 бал)
ІІ рівень
- Сформулюйте визначення ковалентного зв'язку?
- Чим відрізняються типи хімічного зв'язку у сполуках, поданих формулами: N2 і NH3 .
- Які частинки розміщені в вузлах кристалічної ґратки кремнію?
(кожне завдання – 1 бал)
ІІІ рівень
- У якій сполуці ступінь окиснення Сульфуру найменший:
H2S, H2SO4, S, SO2 ?
- Атом елемента має на 6 електронів менше, ніж йон Фтору. Назвіть елемент, напишіть електронні формули його атома і йона.
- На основі електронної формули Хлору поясніть, чому Хлор утворює йон з зарядом –1 ?
(кожне завдання – 1 бал)
IV рівень
- Чому пару електронів, що утворює ковалентний зв’язок називають спільною? Відповідь поясніть.
(3 бали)
Урок 29. Представлення результатів навчальних проектів.
3. Залежність фізичних властивостей речовин від типів кристалічних ґраток.
Урок 30. Контрольна робота №1 з тем «Періодична система та періодичний закон хімічних елементів» та «Хімічний зв’язок і будова речовини».
Варіант 1
І рівень
1. Серед переліку елементів вкажіть лужний метал: а) Na; б) Mg; в) Al.
2. Яку кристалічну ґратку має вода: а) молекулярну; б) атомну; в) йонну; г) металічну.
3. Який з елементів утворює летку водневу сполуку типу RH3: а) Si; б) S; в) P.
(кожне завдання – 1 бал)
ІІ рівень
- Який зв'язок називається ковалентним?
- Вкажіть протонне число елемента, атом якого має на зовнішньому рівні 6 електронів: а) 17; б) 8; в) 6.
3. Визначте кількість протонів і нейтронів в ядрі атома елемента з порядковим номером 23.
(кожне завдання – 1 бал)
ІІІ рівень
- Напишіть будову електронної оболонки атома елемента з порядковим номером 15.
(1 бал)
- Порівняйте атом Калію та його йон.
(2 бали)
IV рівень
- Знаючи ступені окиснення елементів, напишіть формули сполук:
а) Li+1S-2 ; б) Cr+3OH-1 ; в) Fe+2NO3-1 .
(1 бал)
- Охарактеризуйте хімічний елемент № 3 згідно положення у періодичній системі.
(2 бали)
Варіант 2
І рівень
1. Вкажіть тип хімічного зв'язку в молекулі HBr: а) йонний; б) ковалентний полярний; в) ковалентний неполярний.
2. У сполуках з Гідрогеном і металами галогени:
а) одновалентні; б) двовалентні; в) семивалентні.
3. Скільки нейтронів містить ядро атома елемента № 21: а) 4; б) 3; в) 24.
(кожне завдання – 1 бал)
ІІ рівень
- Сформулюйте визначення ядерної реакції.
- Вкажіть формулу сполуки, в якій Хлор виявляє ступінь окиснення +1:
а) KClO3 ; б) KClO ; в) KCl .
3. Однакову кількість електронів на зовнішньому рівні мають атоми елементів з порядковими номерами: а) 6 і 14 ; б) 6 і 7 ;
(кожне завдання – 1 бал)
ІІІ рівень
- Вкажіть кількість валентних електронів в атома елемента з порядковим номером 5.
(1 бал)
- Порівняйте атом Сульфуру та його йон.
(2 бали)
IV рівень
- Визначте ступені окиснення елементів у сполуках: MgS, Br2, HNO3, Cu.
(1 бал)
- Дайте характеристику хімічного елемента № 16 згідно положення у періодичній системі.
(2 бали)
Варіант 3
І рівень
1. Лужні метали утворюють вищий оксид загальною формулою:
а) R2O ; б) RO ; в) RO2 .
2. Яку кристалічну ґратку має NaCl: а) молекулярну; б) атомну; в) йонну; г) металічну.
3. Скільки протонів містить ядро атома Оксигену: а) 32; б) 16; в) 8.
(кожне завдання – 1 бал)
ІІ рівень
- Сформулюйте визначення періодичного закону?
- Серед наведених формул випишіть формули сполук з ковалентним полярним зв’язком: а) H2 ; б) NH3 ; в) NaCl.
3. Які хімічні властивості проявляє вищий оксид елемента з протонним числом 19:
а) основні; б) кислотні; в) амфотерні.
(кожне завдання – 1 бал)
ІІІ рівень
- Напишіть будову електронної оболонки атома елемента з порядковим номером 10.
(1 бал)
- Порівняйте валентність і ступінь окиснення.
(2 бали)
IV рівень
1. Знаючи ступені окиснення елементів, напишіть формули сполук:
а) Sn+2OH-1; б) Ag+1SO3-2 ; в) B+3O-2 .
(1 бал)
2. Дайте характеристику хімічного елемента №2 згідно положення у періодичній системі.
(2 бали)
Варіант 4
І рівень
1. Які елементи належать до ІІІ групи головної підгрупи: а) Al; б) Si; в) In; г) O.
2. Яку сполуку з воднем утворює Флор: а) HR; б) H2R; в) H3R .
3. Електронегативність елементів зростає в ряду: а) Se, S, O; б) Be, Mg, Ca.
(кожне завдання – 1 бал)
ІІ рівень
- Який зв'язок називається йонним?
- Вкажіть протонне число елемента, атом якого має на зовнішньому рівні 2 електрони:
а) 11; б) 12; в) 16.
3. Вкажіть формулу сполуки, в якій Карбон проявляє ступінь окиснення -4:
а) СО; б) СО2; в) СН4.
(кожне завдання – 1 бал)
ІІІ рівень
- Вкажіть кількість валентних електронів в атома елемента з порядковим номером 7.
(1 бал)
- Порівняйте різні типи кристалічних ґраток.
(2 бали)
IV рівень
- Визначте ступені окиснення елементів у сполуках: Al, H2SiO3, AgCl, O2 .
(1 бал)
- Охарактеризуйте хімічний елемент № 6 за місцем у періодичній системі.
(2 бали)
Урок 31. Кількість речовини. Розрахунки за хімічними формулами. Кількість речовини. Моль – одиниця кількості речовини. Число Авогадро.
- Заповніть таблицю:
|
Формула |
Кількість речовини, моль |
Кількість молекул |
Кількість атомів |
|
СО |
0,2 |
|
|
|
СО2 |
1,5 |
|
|
|
АІ2О3 |
2 |
|
|
|
НСІ |
0,5 |
|
|
|
РН3 |
3,5 |
|
|
-
Розв'яжіть задачі:
- Знайдіть кількість молекул кисню у 50 молях цього газу.
- Де більше молекул у кисні чи азоті, взятих по 1,75 моль?
- Скільки атомів Оксигену у вуглекислому газі, взятому кількістю речовини 4,5 моль.
- Розрахуйте кількість атомів Гідрогену ортофосфатної кислоти (Н3РО4) кількість речовини 3 моль.
- Порівняйте кількість атомів Хлору у кислотах НСІ та НСІО кількістю речовини по 0,65 моль кожна.
- Порівняйте кількість атомів Оксигену у воді кількістю речовини 5,6 моль та вуглекислому газі кількістю речовини 3,4 моль.
-
Вставте пропущені слова:
- Кількість речовини – це … речовини, в якій міститься 61023 молекул. (порція).
- Моль – це така порція речовини, у якій … (міститься 61023 формульних частинок).
- Сталою Авогардо називають … (число 61023).
- Авогадро – це італійський … (вчений – хімік).
- Моль – це одиниця кількості … (речовини).
- Усі речовини з однаковою кількістю речовини мають … число молекул. (однакове).
- Складіть логічний ланцюжок з відомостей трьох колонок:
А) 4Н2 1) 3 моль озону І) 121023 молекул
Б) 3О3 2) 4 моль водню ІІ) 61023 атомів
В) Н2 3) 1 моль водню ІІІ) 2,41024 молекул
Г) 2СО 4) 2 моль чадного газу ІV) 541023 молекул
ВІДПОВІДЬ: А) – 2) – ІІІ)
Б) – 1) – ІV)
В) – 3) – ІІ)
Г) – 4) – І)
Урок 32. Розрахункові задачі. Обчислення числа частинок (атомів, молекул, йонів) у певній кількості речовини.
- Заповніть таблицю:
|
Формула |
Кількість речовини, моль |
Кількість молекул |
Кількість атомів |
|
Н2СО3 |
|
61023 |
|
|
СаСО3 |
|
|
301023 |
|
АІ |
3 |
- |
|
|
НСІО |
|
0,61023 |
|
|
Р2О5 |
1,5 |
|
|
-
Розв'яжіть задачі:
- Знайдіть кількість молекул води кількістю речовини 0,3 моль.
- Розрахуйте кількість речовини 121023 молекул водню.
- Яку кількість речовини займуть 1,21023 атомів Феруму.
- Яку кількість речовини займуть 2,41023 молекул вуглекислого газу.
- Порахуйте кількість молекул у сульфатній кислоті (Н2SО4) кількістю речовини 2,75 моль.
- Розрахуйте кількість атомів окремо взятих елементів відповідно до умови задачі 2.5.
- Групова робота: у групах складіть по три задачі та розв’яжіть їх.
- Самостійна робота:
І рівень
- Кількість речовини – це фізична величина, що визначається співвідношенням:
а) ν = Vм / V; б) ν = m · M; в) ν = N / NА.
- В 1 моль будь якого газу за нормальних умов міститься молекул:
а) 6 · 1023; б) 6 · 1024; в) 6 · 1025.
3. Одиниця вимірювання кількості речовини є:
а) г ; б) кг ; в) моль.
(кожне завдання – 1 бал)
ІІ рівень
- Вкажіть кількість молекул 1 моль газу за нормальних умов.
- Сформулюйте визначення кількості речовини.
- Знайдіть значення числа молекул речовини виходячи з формули ν = Ν / ΝА.
(кожне завдання – 1 бал)
ІІІ рівень
- Якій кількості речовини кисню (О2) відповідає 2,8 · 1023 молекул кисню?
- Число молекул хлору становить 4,2 · 1023 молекул. Якій кількості речовини відповідає дане число молекул?
(кожне завдання – 1,5 бали)
ІV рівень
- Якій кількості речовини відповідає 9,6 · 1024 молекул нітратної кислоти (HNO3)?
- Обчисліть число молекул у нітроген (ІV) оксиді кількістю речовини 4,5 моль.
(кожне завдання – 1,5 бал)
Урок 33. Самостійна робота з обчислення числа частинок (атомів, молекул, йонів) у певній кількості речовини.
1. Тестові завдання: (обери одну правильну відповідь)
1. Скільки атомів Гідрогену й Оксигену міститься у воді Н20 кількістю речовини 1 моль?
а) 6,02•1023 атомів Гідрогену та 6,02•1023 атомів Оксигену;
б) 12,04•1023 атомів Гідрогену та 6,02•1023 атомів Оксигену;
в) 12,04•1023 атомів Гідрогену та 12,04•1023 атомів Оксигену.
2. Скільки атомів містить мідь кількістю речовини 3 моль;
а) 12,04•1023 атомів; б) 6,02•1023 атомів; в) 18,06•1023 атомів.
3. Скільки атомів містить залізо кількістю речовини 0,5 моль?
а) 3,01•1023 атомів; б) 6,02•1023 атомів; в) 18,06•1023 атомів;
4. Скільки молекул і атомів містить азот N2 кількістю речовини 2 моль?
а) 6,02•1023 молекул азоту та 6,02•1023 атомів Нітрогену;
б) 12,04•1023 молекул азоту та 6,02•1023 атомів Нітрогену;
в) 12,04•1023 молекул азоту та 24,08•1023 атомів Нітрогену.
5. Яку кількість речовини становить 3•1023 атомів Сульфуру?
а) 0,2 моль; б) 1 моль; в) 0,5 моль
6. Яку кількість речовини становить 18•1023 молекул брому (Вr2)?
а) 1,5 моль; б) 3 моль; в) 0.3 моль
2. Хімічний диктант. Заповніть пропуски.
Варіант 1
|
|
О2 |
SO2 |
Na2O |
|
ν |
5 |
|
|
|
NA |
|
|
|
|
N молекул |
|
30,1·1023 |
|
|
N йонів |
|
|
1,505·1023 |
|
N атомів |
|
|
|
Варіант 2
|
|
H2 |
CO2 |
CaO |
|
ν |
3 |
|
|
|
NA |
|
|
|
|
N молекул |
|
60,2·1023 |
|
|
N йонів |
|
|
3,01·1023 |
|
N атомів |
|
|
|
- Розрахункові задачі:
- Обчислення числа частинок (атомів, молекул, йонів) у певній кількості речовини.
Заповніть таблицю за прикладом
|
Формула |
Кількість речовини молекули |
Кількість речовини атомів Гідрогену |
Кількість речовини атомів Карбону |
Кількість речовини атомів Оксигену |
|
2 С2H6O |
2 моль |
12 моль |
4 моль |
2 моль |
|
5 H2CO3 |
|
|
|
|
|
4CH4O |
|
|
|
|
|
6C3H8O |
|
|
|
|
|
3C2H4O2 |
|
|
|
|
Обчисливши число молекул складної речовини й число атомів кожного хімічного елемента в заданій кількості речовини, знайди відповідність:
|
Варіант |
Формула речовини |
Кількість речовини |
Число молекул |
Число атомів |
||
|
І |
Na2SiO3 |
0,5 моль |
? |
Na |
Si |
O |
|
? |
? |
? |
||||
|
ІІ |
KNO3 |
1,5 моль |
? |
K |
N |
O |
|
? |
? |
? |
||||
|
ІІІ |
Al(OH)3 |
0,4 моль |
? |
Al |
O |
H |
|
? |
? |
? |
||||
|
IV |
H2SO4 |
0,2 моль |
? |
H |
S |
O |
|
? |
? |
? |
||||
- Самостійна робота
Варіант 1
- Дайте визначення кількості речовини.
- Обчисліть відносну молекулярну масу барій карбонату BaCO3
- Обчисліть число молекул кисню (O2) кількістю речовини 0,7 моль
- Обчисліть число молекул і атомів у ферум (ІІІ) оксиді кількістю речовини 3 моль.
- Де більше атомів у 6 моль CO чи 5 моль алюміній оксиду?
Самостійна робота
Варіант 2
- Дайте визначення сталої Авогадро.
- Обчисліть відносну молекулярну масу магній сульфату MgSO4.
- Обчисліть число молекул водню (H2) кількістю речовини 0,3 моль
- Обчисліть число молекул і атомів у алюміній оксиді кількістю речовини 5 моль.
- Де більше атомів у 3,5 моль O2 чи 0,5 моль фосфор (V) оксиду?
Самостійна робота
Варіант 3
- Дайте визначення моль.
- Обчисліть відносну молекулярну масу калій нітрату KNO3.
- Обчисліть число молекул азоту (N2) кількістю речовини 3,2 моль
- Обчисліть число молекул і атомів у нітроген (V) оксиді кількістю речовини 4 моль.
- Де більше атомів у 4 моль кальцій оксиду чи 2 моль ферум (ІІІ) оксиду?
Самостійна робота
Варіант 4
- Чому дорівнює стала Авогадро?
- Обчисліть відносну молекулярну масу натрій силікату Na2SiO3.
- Обчисліть число молекул хлору (Cl2) кількістю речовини 4,5 моль.
- Обчисліть число молекул і атомів у карбон (IV) оксиді кількістю речовини 6 моль.
- Де більше атомів у 3 моль азоту чи 1,5 моль карбон (ІV) оксиду?
Урок 34. Молярна маса. Обчислення маси. Розрахункові задачі.
- Шифровий диктант
|
А. кількість речовини води |
|
2. n (H2O) |
Б. маса водню |
|
3. Mr (CuO) |
В. маса Гідрогену |
|
4. m (H2) |
Г. число Авогадро |
|
5. NA |
Д. відносна атомна маса Феруму |
|
6. m (H) |
Е. масова частка Оксигену |
|
7. Ar (Fe) |
Є.кількість атомів Фосфору |
|
8. W (O) |
Ж. відносна молекулярна маса купрум(ІІ) оксиду |
2. Заповніть таблицю, виконавши розрахунки за початковими даними:
|
Речовина - гази |
Кількість речовини, моль |
Маса речовини, г |
Об’єм газу, л |
Число молекул |
|
Азот |
0,5 |
|
|
|
|
Сірководень |
|
68 |
|
|
|
Карбон (ІІ) оксид |
|
|
5,6 |
|
- Розмитий запис
Допоможіть учневі відновити запис у зошиті, який він залив компотом.
![]() =…моль
=…моль
![]()
![]()
![]()
![]()
![]()
![]()
Урок 35. Обчислення за хімічною формулою маси даної кількості речовини і кількості речовини за відомою масою.
1. Фразеологічний диктант
- Найдрібніша частинка речовини, що зберігає склад і властивості даної речовини називається … . (Молекула).
- Речовини з молекулярною будовою мають низькі температури … . (Плавлення).
- Кількість речовини позначається … . ( , читається «ню»).
- Чисельне значення сталої Авогадро відповідає … . (6,02*1023 ).
- Фізична величина, що визначається числом структурних частинок, які містяться в даній порції речовини, називається … . (Кількість речовини).
- Число частинок (атомів, молекул, йонів і т. д.), які містяться в одному моль речовини, незалежно від її агрегатного стану, показує … . (Стала Авогадро).
- Кількість структурних частинок речовини позначається … . (N).
- Фізична величина, що дорівнює відношенню маси речовини до відповідної кількості даної речовини, називається … . (Молярна маса).
- Одиницею кількості речовини є … . (Моль).
- Молярна маса речовин позначається … .(M).
- Запишіть, користуючись символами:
1300 атомів Фосфору – (N (Р))
120 г Кальцію –
3 моль елементу Калію –
1,5 моль алюміній оксиду –
2·1023 молекул сульфур(ІV) оксиду –
- Самостійна робота
Варіант 1.
- Позначте одиниці виміру молярної маси:
А) г/см3; Б) кг; В) г/моль; Г) г
- Обчисліть молярну масу натрій оксиду.
А) 58г/моль; Б) 60г/моль; В) 64 г/моль; Г) 62 г/моль
- Установіть відповідність між хімічною формулою речовини та значенням її молярної маси:
А) FeCl3 1. 152,5г/моль
Б) Cr(NO3)3 2. 162,5 г/моль
3. 238 г/моль
- Обчисліть масу фосфору кількістю речовини 1,5 моль.
- Обчисліть, якій кількості речовини відповідає аміак (NH3) масою 119 г.
- До складу речовини входять два атоми Натрію, атом Сульфуру та три атоми Оксигену. Напишіть формулу, обчисліть масові частки елементів у сполуці. Обчисліть, якій кількості речовини відповідає її маса 50,4 г.
Варіант 2.
- Позначте число, що дорівнює сталій Авогадро:
А) 22,4 л; Б) 6*1023; В) 2г/моль; Г) 3*1027 кг
- Обчисліть молярну масу арґентум (І)оксиду.
А) 156г/моль; Б) 140г/моль; В) 232 г/моль; Г) 230 г/моль
- установіть відповідність між хімічною формулою речовини та значенням її молярної маси:
А) MnCl2 1. 126г/моль
Б) Pb(NO3)2 2. 331 г/моль
3. 313 г/моль
- Обчисліть масу барію кількістю речовини 3,5 моль.
- Обчисліть, якій кількості речовини відповідає кальцій сульфід (CaS) масою 360 г.
- До складу речовини входять три атоми Калію, атом Фосфору та чотири атоми Оксигену. Напишіть формулу, обчисліть масові частки елементів у сполуці. Обчисліть, якій кількості речовини відповідає її маса 159 г.
Варіант 3.
- Позначте формулу для обчислення молярної маси:
А) ![]() ; Б)
; Б)![]() ; В)
; В)![]() ; Г)
; Г) ![]()
- Обчисліть молярну масу хром (ІІІ) оксиду.
А) 125 г/моль; Б) 125,25 г/моль; В) 152 г/моль; Г) 152,8 г/моль
- Установіть відповідність між хімічною формулою речовини та значенням її молярної маси:
А) CaS 1. 72 г/моль
Б) MgSO3 2. 78 г/моль
3. 104 г/моль
- Обчисліть масу силіцію кількістю речовини 4,5 моль.
- Обчисліть, якій кількості речовини відповідає натрій бромід (NaBr) масою 87,55 г.
- До складу речовини входять атом Барію, атом Карбону та три атоми Оксигену. Напишіть формулу, обчисліть масові частки елементів у сполуці. Обчисліть, якій кількості речовини відповідає її маса 39,4 г.
Варіант 4.
1.Позначте формулу для обчислення маси речовини:
А) ![]() ; Б)
; Б)![]() ; В)
; В)![]() ; Г)
; Г) ![]()
- Обчисліть молярну масу фосфор (V)оксиду.
А) 142 г/моль; Б) 124 г/моль; В) 148 г/моль; Г) 146 г/моль
- Установіть відповідність між хімічною формулою речовини та значенням її молярної маси:
А) K2S 1. 62 г/моль
Б) H2CO3 2. 110 г/моль
3. 70 г/моль
- Обчисліть масу магнію кількістю речовини 0,45 моль.
- Обчисліть, якій кількості речовини відповідає магній сульфід (MgS) масою 140 г.
- До складу речовини входять атом Аргентуму, атом Нітрогену та три атоми Оксигену. Напишіть формулу, обчисліть масові частки елементів у сполуці. Обчисліть, якій кількості речовини відповідає її маса 680 г..
Оцінювання – 1 бал (1-3 завдання), 3 бали (4-6 завдання).
Урок 36. Закон Авогадро. Молярний об’єм газів. Обчислення об’єму.
-
Самостійна робота
- Кількість речовини вимірюється в одиницях:
А) моль; б)літр; в) метр
2. Число частинок, що міститься в 2 моль:
а) 12, 04 •1023; б) 3,01 •1023; в) 6,02 •1023.
3. В 1 моль вуглекислого газу міститься:
а) 1,67 •1023 молекул; б) 6,02 •1023 молекул; в) 44 молекули.
4. Якою формулою виражається взаємозв’язок між кількістю речовини та сталою Авогадро?
а) ν = N / NA б) N = NA • ν
5. Прізвище вченого, ім’ям якого названо число частинок, що міститься в 1 моль будь-якої речовини:
А) Менделєєв; б) Авогадро; в) Лавуазьє; Г) Резерфорд
6. В 1 моль будь-якої речовини міститься саме стільки частинок, скільки міститься атомів у зразку одного з нуклідів масою 0,012 кг:
А) Нітроген -15; б) Оксиген -16; в) Карбон -12
- Складіть кола Вена для вуглекислого газу та кисню.
- Задача без запитання: скласти і розв'язати задачу.
А) Дано:
m(N2O)= 17,6 г
![]()
?
Б) Дано:
![]()
![]()
?
Урок 37. Розрахункові задачі. Обчислення об’єму газу за нормальних умов.
1. Не закінчене речення
1. В однакових об’ємах різних газів міститься….
2. Цей закон відкрив…
3. Однакова кількість молекул різних газів займає…
4. Один моль будь-якого газу за нормальних умов займає об’єм…
5. Цей об’єм називають…
6. Скільки атомів Феруму міститься в 1 моль заліза?
7. Молярна маса молекули кисню О2 дорівнює...
8. Формула розрахунку кількості речовини за відомою масою речовини.
9. Стала Авогадро NА дорівнює...
10. Одиниці вимірювання молярної маси…
- Робота з формулами: користуючись загальною формулою, виведіть похідну:
![]()
![]()
![]()
- Заповніть таблицю:
|
Формула речовини |
Кількість речовини |
Молярна маса |
Маса |
Об’єм |
Число молекул |
Число атомів |
|
СO2 |
4 моль |
|
|
|
|
|
|
SO2 |
|
|
|
4,48 л |
|
|
|
N2 |
|
|
56 г |
|
|
|
|
CO |
2 моль |
|
|
|
|
|
|
H2S |
|
|
|
11,2 л |
|
|
|
CH4 |
|
|
48 г |
|
|
|
Урок 38. Відносна густина газів. Обчислення з використанням відносної густини газів.
- Лист Барона Мюнхгаузена

2. Заповніть таблицю:
|
Формула речовини |
Молярна маса |
Відносна густина за воднем |
Відносна густина за киснем |
Відносна густина за азотом |
Відносна густина за гелієм |
|
CO2 |
|
|
|
|
|
|
SO2 |
|
|
|
|
|
|
NH3 |
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
SO2 |
|
|
|
|
|
3. Розв’яжіть задачі:
- Відносна густина пари речовини за воднем дорівнює 17. Обчисліть молярну масу речовини.
- Відносна густина пари речовини за киснем 2, а 1 л даного газу займає масу 2,86 г. Обчисліть молекулярну масу речовини.
- Відносна густина пари речовини за киснем дорівнює 0, 5. Обчисліть молекулярну масу речовини та виведіть формулу, якщо вона містить 75% Карбону та 25% Гідрогену.
Урок 39. Розрахункові задачі. Обчислення з використанням відносної густини газів.
1. Хімічний диктант
1. Сформулюйте закон Авогадро
2. Дайте визначення відносної густини газів
3. Дайте визначення кількості речовини
4. Назвіть три формул, за якими можна обчислити кількість речовини
5. Сформулюйте визначення молекулярної маси речовини.
6. Сформулюйте визначення молярного об’єму.
2. Знайдіть «Білу ворону»
А) H2, O2, N2, Cl2, SO2
Б) H2, O2, Fe, N2, Cl2, SO2
В)V, Vm, N, NA, F, M, m
Г) г/л, г/моль, кг/м, л/моль
Д) D(H2), D(He), D(Na), D(N2)
3. Кольорова стрічка
4. Обчисліть суму всіх чисел, розв’язавши задачу, що стосується 4 моль етену С2Н4
|
|
28 |
28г/моль |
89,6 л |
14 |
112 г |
|
M(C2H4) |
1 |
2 |
3 |
4 |
5 |
|
V(C2H4) |
6 |
7 |
8 |
9 |
10 |
|
m (C2H4) |
11 |
12 |
13 |
14 |
15 |
|
D(H2) |
16 |
17 |
18 |
19 |
20 |
|
D(N2) |
21 |
22 |
23 |
24 |
25 |
Урок 40. Узагальнюючий урок з теми «Кількість речовини»
- Гра «Хрестики-нулики»

-
Відгадай загадку.
- Загадка
В хімії всі речі дивні.
Кількість - річ не примітивна
В газах є, в кислотах, солях,
А вимірюється в молях.
Моль - величина магічна,
Стала в ній - число логічне,
А чи знаєте як зветься,
Величезним всім здається.
Не зникає в часу леті
Шість на десять в двадцять третій. (число Авогадро)
2. Загадка - задача
Стовп стоїть ось електричний
Он і другий - діло звичне.
Дріт стовпи ті два єднає
Довжину півсотні має,
Ну а маса: 6 кіло
Алюмінію було.
Число атомів назвіть
Скільки містить даний дріт?
Скільки треба молів взяти,
Щоб аж п'ять стовпів з'єднати?
3. Ігровий момент «Квітка».
Напишіть всі можливі обчислення (написані на пелюстка і листку квітки) для речовин кількістю речовини 5 моль.
4. Хімічна естафета
Взято вуглекислий газ (СО2) кількістю речовини 2 моль.
Обчислити:
M =
m =
NМОЛ =
V =
DH2 =
Сума цілих частин всіх результатів =
5. Вправи:
А) Де міститься більше атомів:
а) у магнії масою 1 г чи у вуглеці масою 1 г;
б) у залізі масою 16,8 г чи у кремнії масою 16,8 г;
У скільки разів?
Б) Задача без запитання
Дано:
m(H2SO4)= 29,4 г
![]()
?
Скласти і розв’язати задачу.
Дано:
![]()
![]()
?
В) Творче завдання:
В якій кількості речовини ферум (ІІІ) оксиду міститься 18,06 • 1023 атомів Феруму?
Скільки атомів Феруму міститься в такій же кількості речовини ферум (ІІ) оксиду?
- Тестова перевірка знань з теми.
Варіант 1
І рівень
1.Позначте одиниці виміру молярної маси:
- г/см3
- кг
Б. г/моль
Г. г
2. Позначте запис молярного об’єму газів:
А. V Б. Vm В. m Г. ![]()
3.Установіть послідовність дій для обчислення відносної густини(н.у.) озону за метаном:
- Обчислюємо відносну молекулярну масу метану
Б. Ділимо значення відносної молекулярної маси озону на значення відносної молекулярної маси метану
- Записуємо результат
Г. Обчислюємо відносну молекулярну масу озону.
ІІ рівень
4. Обчисліть і позначте молярну масу натрій оксиду:
- 60 г/моль
- 39 г/моль
Б. 64г/моль
Г. 62 г/моль
5. Обчисліть та позначте, якій кількості відповідає аміак (NH3) об’ємом 5,6л
- 0,35 моль
- 0,25 моль
Б. 0,2 моль
Г. 0,3 моль
6. Обчисліть і позначте загальне число атомів у воді кількістю речовини 3 моль:
-
36,12
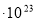
-
5,418
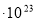
Б.![]()
Г. 3,612![]()
ІІІ рівень
7. Обчисліть та позначте об’єм, що займе пропан (С3Н8) масою 132г:
- 66,46 л Б. 67,2 л В.57,8 л Г. 68,4 л
8.Установіть послідовність характеристик карбон(ІІ) оксиду :
Відносна густина за азотом – густина - молярна маса – відносна молекулярна маса
А. 1,25 г/л Б.28 В. 1 Г. 28 г/моль
IV рівень
9. Установіть відповідність між молярною масою, формулами речовини та їх масою кількістю речовини 1,45 моль:
А. 292 г/моль 1. PbSO4 I. 179,8 г
Б. 303 г/моль 2. Ag2SiO3 II. 423,4 г
3. CuCO3 III. 439,35 г
Варіант 2
І рівень
1.Позначте одиниці виміру маси:
А. г/см3
Б. кг/л
В. г/моль
Г. г
2. Позначте формулу, за якою можна обчислити кількість речовини:
А. ![]()
Б.![]()
Г. ![]()
3.Установіть послідовність дій для обчислення відносної густини(н.у.) кисню за гелієм:
А. Записуємо результат
Б. Обчислюємо відносну молекулярну масу кисню
В. Ділимо значення відносної молекулярної маси кисню на значення відносної молекулярної маси гелію
Г.Обчислюємо відносну молекулярну масу гелію.
ІІ рівень
4. Обчисліть і позначте молярну масу сульфатної кислоти H2SO4:
А. 100 г/моль
Б. 98 г/моль
В. 89 г/моль
Г. 102 г/моль
5. Обчисліть та позначте, якій кількості речовини відповідає об’єм гідроген хлориду (НСl) 16,8 л
А. 0,755 моль
Б. 0,76 моль
В. 0,75 моль
Г. 0,7 моль
6. Обчисліть і позначте загальне число атомів у воді кількістю речовини 0,45 моль:
А. 87,27![]()
Б. 8,127![]()
В. 84,28![]()
Г. 8,438![]()
ІІІ рівень
7. Обчисліть та позначте об’єм, який займе дигідрогенсульфід масою 275,4 г:
А. 180,68 л
Б. 182,56 л
- 186,26 л
Г. 181,44 л
8.Установіть послідовність характеристик етану С2Н6 :
Густина - відносна густина за неоном – відносна молекулярна маса - молярна маса
А. 30 Б.30 г/моль В. 1,34 г/л Г. 1,5
IV рівень
9. Установіть відповідність між молярною масою, формулами речовини та їх масою кількістю речовини 3 моль:
А. 312 г/моль 1. FeCO3 I. 936 г
Б. 116 г/моль 2. Ag2SO4 II. 348 г
3. Ag2SO3 III. 888 г
Варіант 3
І рівень
1.Позначте одиниці виміру кількості речовини:
- г/см3
Б. моль
- г/моль
Г. г
2. Позначте запис числа молекул речовини:
А. V Б. Vm В. m Г. ![]()
3.Установіть послідовність дій для обчислення відносної густини(н.у.) кисню за воднем:
- Обчислюємо відносну молекулярну масу водню
Б. Ділимо значення відносної молекулярної маси кисню на значення відносної молекулярної маси водню
- Записуємо результат
Г. Обчислюємо відносну молекулярну масу кисню.
ІІ рівень
4. Обчисліть і позначте молярну масу алюміній оксиду:
- 60 г/моль
Б. 39 г/моль
- 64г/моль
Г. 102 г/моль
5. Обчисліть та позначте, якій кількості відповідає нітроген (IV) оксид (NО2) об’ємом 8,96 л
- 0,4 моль
Б. 0,25 моль
- 0,2 моль
Г. 0,3 моль
6. Обчисліть і позначте загальне число атомів у водню кількістю речовини 3 моль:
-
36,12
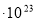
Б. 5,418![]()
Г. 3,612![]()
ІІІ рівень
7. Обчисліть та позначте об’єм, що займе етан (С2Н6) масою 90г:
- 66,46 л
Б. 57,8 л
- 67,2 л
Г. 68,4 л
8.Установіть послідовність характеристик карбон (IV) оксиду :
Відносна густина за гелієм – густина - молярна маса – відносна молекулярна маса
А. 1,96 г/л Б.44 В. 11 Г. 44 г/моль
IV рівень
9. . Установіть відповідність між молярною масою, формулами речовини та їх масою кількістю речовини 1,6 моль:
А. 122 г/моль 1. CaSO4 I. 179,8 г
Б. 136 г/моль 2. Na2SiO3 II. 217,6 г
3. ZnCO3 III. 195,2 г
Варіант 4
І рівень
1.Позначте одиниці виміру молярного об’єму :
А. г/см3
Б. моль
В. л/моль
Г. г
2. Позначте запис маси:
А. V Б. Vm В. m Г. ![]()
3.Установіть послідовність дій для обчислення відносної густини(н.у.) вуглекислого газу за воднем:
А. Обчислюємо відносну молекулярну масу водню
Б. Ділимо значення відносної молекулярної маси вуглекислого газу на значення відносної молекулярної маси водню
В. Записуємо результат
Г.Обчислюємо відносну молекулярну масу вуглекислого газу.
ІІ рівень
4. Обчисліть і позначте молярну масу кальцій оксиду:
А. 60 г/моль
Б. 56 г/моль
В. 64г/моль
Г.102 г/моль
5. Обчисліть та позначте, якій кількості відповідає нітроген (V) оксид (N2 О5) об’ємом 2,24 л
А. 0,4 моль
Б. 0,1 моль
В. 0,2 моль
Г. 0,3 моль
6. Обчисліть і позначте загальне число атомів у водню кількістю речовини 5 моль:
А. 36,12![]()
Б. 5,418![]()
В. ![]()
Г. 60,20![]()
ІІІ рівень
7. Обчисліть та позначте об’єм, що займе етен (С2Н4) масою 112г:
А. 66,46 л Б.57,8 л В. 67,2 л Г.89,6 л
8. Установіть послідовність характеристик озону :
Відносна густина за воднем – густина - молярна маса – відносна молекулярна маса
А. 2,14 г/л Б.24 В. 48 Г. 48 г/моль
IV рівень
9. Установіть відповідність між молярною масою, формулами речовини та їх масою кількістю речовини 1,4 моль:
А. 342 г/моль 1. Al2 ( SO4)3 I. 478,8 г
Б. 100 г/моль 2. Na2SiO3 II. 104 г
3. CaCO3 III. 140 г
Урок 41. Залікова робота №3 з теми «Кількість речовини. Розрахунки за хімічними формулами».
Варіант 1
І рівень
- Молярний об'єм газів за нормальних умов становить:
а) 44,8л/моль; б) 22,4л/моль; в) 11,2л/моль.
- Як позначається відносна густина газу:
а) М; б) D; в) ρ.
- Вираз ν = м / Μ означає:
а) математичний вираз молярної маси;
б) математичний вираз маси речовини;
в) математичний вираз кількості речовини.
(кожне завдання – 1 бал)
ІІ рівень
- Вкажіть число молекул, що міститься в 1 моль кисню?
2. Знайдіть значення об’єму газу, виходячи з формули:
ν = V / Vм.
3. Сформулюйте визначення відносної густини газу.
(кожне завдання – 1 бал)
ІІІ рівень
- Кисень займає об'єм 8,96 л. Яка його маса?
- Обчисліть відносну густину карбон (ІV ) оксиду за повітрям.
- Обчисліть число молекул у нітроген (ІV) оксиді кількістю речовини 2,5 моль.
(кожне завдання – 1 бал)
ІV рівень
- Який об'єм займе 12 · 1023 молекул етану (С2Н6 )?
(1 бал)
- Якій масі відповідає хлоридна кислота (НСl) кількістю речовини 3 моль? Яке число молекул міститься у такій масі кислоти?
(2 бали)
Варіант 2
І рівень
- Кількість речовини – це фізична величина, що визначається співвідношенням:
а) ν = Vм / V; б) ν = m / M; в) ν = N · NА.
- В 1 моль будь якого газу за нормальних умов міститься молекул:
а) 6 · 1023; б) 6 · 1024; в) 6 · 1025.
3. Одиниця вимірювання молярного об’єму є:
а) г / моль; б) кг / моль; в) л / моль.
(кожне завдання – 1 бал)
ІІ рівень
- Вкажіть об'єм 1 моль газу за нормальних умов.
- Сформулюйте визначення закону Авогадро?
- Знайдіть значення числа молекул речовини виходячи з формули ν = Ν / ΝА.
(кожне завдання – 1 бал)
ІІІ рівень
- Яка маса магній оксиду кількістю речовини 3 моль?
- Відносна густина сульфур (VІ) оксиду за гелієм – 20. Обчисліть відносну молекулярну масу оксиду.
- Число молекул хлору становить 2,4 · 1023 молекул. Якій кількості речовини відповідає дане число молекул?
(кожне завдання – 1 бал)
IV рівень
- Який об'єм повітря кількістю речовини 0,8 моль?
(1 бал)
- Якій кількості речовини відповідає Na2CO3 масою 53 г? Обчисліть число молекул натрій карбонату у цій порції речовини.
(2 бали)
Варіант 3
І рівень
- Молярна маса кисню:
а) 32 л/моль; б) 32 г/моль; в) 32.
- Вираз D = M1 / М2 означає:
а) відношення маси до кількості речовини;
б) відношення молярної маси одного газу до молярної маси іншого газу за однакових умов;
в) відношення об’єму газу до молярного об’єму газу.
- Кількість речовини позначається символом:
а) ν; б) Ν; в) V.
(кожне завдання – 1 бал)
ІІ рівень
- Запишіть математичний вираз молярної маси.
- Закінчіть визначення: “ Кількість речовини – це фізична величина ......
- Знайдіть значення маси речовини, виходячи з формули:
ν = m / М.
(кожне завдання – 1 бал)
ІІІ рівень
- Якій кількості речовини кисню (О2) відповідає
1,8 · 1023 молекул кисню?
- Обчисліть відносну густину чадного газу (СО) за воднем.
- Знайдіть об'єм азоту кількістю речовини 0,6 моль.
(кожне завдання – 1 бал)
IV рівень
- Якій кількості речовини відповідає 9,6 · 1023 молекул нітратної кислоти (HNO3)?
(1 бал)
- Який об'єм метану (СН4) масою 3,2 г? Яке число молекул міститься в такому об’ємі метану?
(2 бали)
Варіант 4
І рівень
- Позначте твердження, що розкриває суть закону об’ємних відношень. Об’єми газів, що вступають у реакцію, відносяться один до одного і до об’ємів добутих газоподібних продуктів як:
а) добутки цілих чисел; б) невеликі цілі числа;
в) відносні густини цих газів; г) різниця цілих чисел.
- Стала Авогадро відповідає числу:
а) 6 · 1025 моль-1; б) 6 · 1022 моль-1; в) 6 · 1023 моль-1.
- Молярний об'єм газу – це відношення:
а) ν = V / Vм; б) Vм = V / ν; в) V = Vм · ν.
(кожне завдання – 1 бал)
ІІ рівень
- Вкажіть числове значення відносної молекулярної маси повітря:
а) 29; б) 32; в) 44.
- Закінчіть визначення: “Відносна густина газів – це величина, ....
- Вкажіть число молекул, яке за нормальних умов містить будь який газ об’ємом 22,4 л / моль.
ІІІ рівень
- Газ масою 2 г за нормальних умов займає об'єм 11,2 л. Визначте, який об'єм займе 5 г цього газу?
- Відносна густина нітроген (І) оксиду за киснем – 1,375. Яка його відносна молекулярна маса?
- Дано калій хлорид (КСl) кількістю речовини 0,8 моль. Яка його маса?
(кожне завдання – 1 бал)
IV рівень
- Обчисліть молярну масу азоту, якщо маса 1 л цього газу за нормальних умов становить 1,25 г.
(1 бал)
- Який об'єм займуть 1,5 · 1023 молекул ацетилену (С2Н2)?
Якій кількості речовини відповідає таке число молекул?
(2 бали)
Урок № 42. Класифікація неорганічних сполук, їхній склад і номенклатура.
1. Хімічний диктант (по 0,5 бала)
1. Речовини поділяються на _____ і _____.
2. Прості речовини поділяються на _____ й _____.
3. Складні неорганічні речовини класифікують на чотири групи: _____, _____, _____, _____.
4. Складні речовини, до складу яких входять два елементи, один з яких Оксиген – _____.
5. Назви оксидів походять від назви елемента й слова _____.
6. Складні речовини, до складу яких входять один або кілька атомів Гідрогену, здатних заміщуватися на атоми металів, і кислотні залишки – _____.
7. Складні речовини, утворені катіонами металічних елементів і аніонами кислотних залишків – _____.
8. Складні речовини, до складу яких входять катіони металічних елементів й один або кілька аніонів гідроксильних груп – _____.
(Відповіді: 1 – прості, складні; 2 – метали, неметали; 3 – оксиди, основи, кислоти, солі; 4 – оксиди; 5 – оксид; 6 – кислоти; 7 – солі; 8 – основи)
2. Тести (по 0,5 бала)
Варіант 1
1. Кислота – це сполука, до складу якої входять:
А) атом металу і кислотний залишок; Б) атом металу і Оксигену;
В) атом Гідрогену і кислотний залишок; Г) атом металу і гідроксильна група.
2. Вкажіть на оксид:
А) Ni(OH)2; Б) Cr2(SO4)3; В) HCl; Г) CuO.
3. Вкажіть на основу:
А) FeO; Б) H2S; В) Sn(OH)2; Г) FeCl3.
4. Вкажіть на кислоту:
А) Fe(OH)3; Б) Ca3(PO4)2; В) Cl2O7; Г) HPO3.
5. Вкажіть сіль:
А) BaCO3; Б) HNO3; В) N2O5; Г) Ba(OH)2.
Варіант 2
1. Основа – це сполука, до складу якої входять:
А) атом металу і кислотний залишок; Б) атом металу і Оксигену;
В) атом Гідрогену і кислотний залишок; Г) атом металу і гідроксильна група.
2. Вкажіть на оксид:
А) H2CO3; Б) SO3; В) Fe(OH)2; Г) KNO3.
3. Вкажіть на основу:
А) NaOH; Б) CO; В) BaCl2; Г) H2SO3.
4. Вкажіть на кислоту:
А) H3BO3; Б) SO2; В) Na2SiO3; Г) Ca(OH)2.
5. Вкажіть сіль:
А) MgCO3; Б) H2SiO3; В) CaO; Г) Al(OH)3;
Варіант 3
1. Оксид – це сполука, до складу якої входять:
А) атом металу і кислотний залишок; Б) атом металу і Оксигену;
В) атом Гідрогену і кислотний залишок; Г) атом металу і гідроксильна група.
2. Вкажіть на оксид:
А) CuCl2; Б) Be(OH)3; В) HF; Г) CO2.
3. Вкажіть на основу:
А) HNO2; Б) H2O; В) CaCO3; Г) LiOH.
4. Вкажіть на кислоту:
А) Na3PO4; Б) H3PO4; В) Ag2O; Г) Mg(OH)2.
5. Вкажіть сіль:
А) N2O; Б) H2S; В) KOH; Г) Al2(SO4)3.
Варіант 4
1. Сіль – це сполука, до складу якої входять:
А) атом металу і кислотний залишок; Б) атом металу і Оксигену;
В) атом Гідрогену і кислотний залишок; Г) атом металу і гідроксильна група.
2. Вкажіть на оксид:
А) Na2O; Б) Fe(OH)3; В) HCl; Г) CaCO3.
3. Вкажіть на основу:
А) H2SO3; Б) Zn(OH)2; В) BaO; Г) AlPO4.
4. Вкажіть на кислоту:
А) MgS; Б) K2O; В) Al(OH)3; Г) H2SO4.
5. Вкажіть сіль:
А) P2O5; Б) H2SiO3; В) KOH; Г) Zn(NO3)2.
3. Групова робота
Прокласифікуйте речовини (випишіть окремо зі списку):
|
Група 1 |
Група 2 |
Група 3 |
Група 4 |
|
Оксиди |
Кислоти |
Основи |
Солі |
|
Cr(NO3)2; KOH; H2SO4; BaO; Fe(OH)2; KNO2; HgO; Al(OH)3; H2SO3; Ca(OH)2; CrO3; Na2CO3; CuOH; H2SiO3; LiOH; HPO3; Mn2O7; MgCl2; H2CO3; N2O5; H3PO4; KI; SO2; NaBr; Na2S; NaOH; H3BO3; Ag2O. |
|||
4. Доповніть схему визначеннями та прикладами речовин.
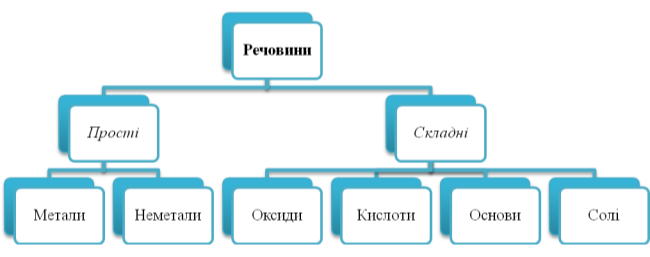
Урок 43. Склад і номенклатура оксидів.
1. Хімічний диктант (по 0,5 бала)
Вставте пропущені слова:
1. Оксиди – це _____ речовини, утворені двома елементами, одним з яких обов’язково є _____.
2. Назви оксидів складаються з назви елемента, валентності (якщо змінна) та слова _____.
3. Найважливішим природним оксидом є _____.
4. Оксиди поділяються на _____ та _____.
5. Солетвірні оксиди поділяють на _____, _____, _____.
6. Металічні елементи з Оксигеном утворюють _____ оксиди.
7. Неметалічні елементи з Оксигеном утворюють _____ оксиди.
8. Амфотерні оксиди мають властивості _____ і _____ оксидів.
(Відповіді: 1 – складні, Оксиген; 2 – оксид; 3– вода; 4 – солетворні, несолетворні; 5 – основні, кислотні, амфотерні; 6 – основні; 7 – кислотні; 8 – основних, кислотних.)
2. Групова робота
Група 1
1. Встановіть відповідність між формулою оксиду, його назвою та поширеністю:
А) SiO2; 1) ферум (ІІІ) оксид; α) складає основу сапфіру, рубіну;
Б) Al2O3; 2) кремнезем; β) входить до складу залізної руди;
В) Fe2O3. 3) алюміній оксид. γ) основна складова піску.
2. Між оксидом та його відносною молекулярною масою:
А) Sc2O3; 1) 105; Г) BeO; 4) 70;
Б) GeO2; 2) 223; Ґ) B2O3; 5) 44;
В) PbO2; 3) 138; Д) CO2. 6) 25.
3. Обчисліть відносну густину вуглекислого газу (карбон (IV) оксиду) за воднем.
Група 2
1. Встановіть відповідність між формулою оксиду, його назвою та поширеністю:
А) СаО; 1) вуглекислий газ; α) є харчовою добавкою Е530;
Б) MgO; 2) негашене вапно; β) поширений в атмосфері;
В) СО2. 3) палена магнезія. γ) входить до складу мармуру, вапняку.
2. Між оксидом та його відносною молекулярною масою:
А) As2O3; 1) 142; Г) Cl2O7; 4) 217;
Б) N2O5; 2) 198; Ґ) HgO; 5) 153;
В) P2O5; 3) 94; Д) BaO. 6) 183.
3. Обчисліть відносну густину чадного газу (карбон (ІІ) оксиду) за воднем.
Група 3
1. Між формулою оксиду, його назвою та поширеністю:
А) H2O; 1) уран (IV) оксид; α) розповсюджена копалина;
Б) СuO; 2) вода; β) використовується як ядерне паливо;
В) UO2. 3) купрум (ІІ) оксид. γ) найпоширеніша речовина на Землі.
2. Між оксидом та його відносною молекулярною масою:
А) NiO; 1) 60; Г) CoO; 4) 144;
Б) I2O5; 2) 75; Ґ) Cu2O; 5) 80;
В) SiO2; 3) 334; Д) SO3. 6) 75.
3. Обчисліть відносну густину бурого газу (нітроген (IV) оксиду) за воднем.
Група 4
1. Між формулою оксиду, його назвою та поширеністю:
А) B2O3; 1) ферум (ІІ) оксид; α) зустрічається як мінерал куприт;
Б) Cu2O; 2) бор (ІІІ) оксид; β) входить до складу борної кислоти;
В) FeO. 3) закис міді. γ) належить до залізних руд.
2. Між оксидом та його відносною молекулярною масою:
А) Na2O; 1) 160; Г) ZnO; 4) 81;
Б) V2O5; 2) 182; Ґ) Al2O3; 5) 254;
В) Fe2O3; 3) 62; Д) OsO4. 6) 102.
3. Обчисліть відносну густину сірчистого газу (сульфур (VI) оксиду) за воднем.
3. Тести (завдання 1-6 оцінюються по 1 балу, 7-8 – по 3 бали)
Варіант 1
1. Виберіть ряд в якому є лише оксиди:
А) K2O, SiO2, HCl; Б) H2O, Na2O, CH4; В) CO, CO2, CaO.
2. Виберіть ряд в якому є лише основні оксиди:
А) Na2O, ВаO, CaO; Б) K2O, MgO, SO2; В) Na2O, ZnO, Cr2O3.
3. Виберіть ряд в якому є лише кислотні оксиди:
А) P2O5, Al2O3, CO; Б) Cl2O7, Mn2O7, MgO; В) SO2, SO3, CO2.
4. Виберіть ряд в якому є лише амфотерні оксиди:
А) ZnO, Cr2O3, Al2O3; Б) SnO, PbO2, Li2O; В) PbO, Fe2O3, N2O.
5. В якому з оксидів валентність елемента найбільша:
А) NO2; Б) N2O3; В) N2O5.
6. В якому з оксидів валентність елемента найменша:
А) CrO; Б) CrO3; В) Cr2O3.
7. Складіть формули оксидів за їх назвою:
А) ферум (ІІ) оксид; Б) хлор (VII) оксид; В) станум (IV) оксид.
8. Назвіть оксиди
А) V2O5; Б) Ag2O; В) BaO
Варіант 2
1. Виберіть ряд в якому є лише оксиди:
А) HBr, MgO, SO2; Б) Na2O, CO2, CaS; В) Na2O, Al2O3, PbO.
2. Виберіть ряд в якому є лише основні оксиди:
А) Na2O, MgO, CaO; Б) CuO, SO2, K2O; В) MgO, Al2O3, CO2.
3. Виберіть ряд в якому є лише кислотні оксиди:
А) CO2, SeO3, NO2; Б) N2O5, SiO2, Li2O; В) Mn2O7, Cl2O5, HgO.
4. Виберіть ряд в якому є лише амфотерні оксиди:
А) Cu2O, BeO, SO3; Б) Cr2O3, BaO, PbO; В) SnO, Ga2O3, Fe2O3.
5. В якому з оксидів валентність елемента найбільша:
А) Cl2O7; Б) Cl2O5; В) Cl2O3.
6. В якому з оксидів валентність елемента найменша:
А) CaO; Б) SiO2; В) Al2O3.
7. Складіть формули оксидів за їх назвою:
А) нітроген (ІV) оксид; Б) купрум (II) оксид; В) берилій оксид.
8. Назвіть оксиди
А) MnO2; Б) B2O3; В) SO3
Варіант 3
1. Виберіть ряд в якому є лише оксиди:
А) N2O3, Li2O, Al2O3; Б) ZnO, Fe2O3, HF; В) SO2, Cr2O3, B2H6.
2. Виберіть ряд в якому є лише основні оксиди:
А) MnO, CuO, CO; Б) Li2O, CaO, BaO; В) CaO, MgO, P2O5.
3. Виберіть ряд в якому є лише кислотні оксиди:
А) MoO3 MgO, MnO; Б) N2O3, N2O5, Na2O; В) SO3, CO2, NO2.
4. Виберіть ряд в якому є лише амфотерні оксиди:
А) ZnO, SnO, Al2O3; Б) SnO, SO3, Cr2O3; В) Na2O, N2O, ZnO.
5. В якому з оксидів валентність елемента найбільша:
А) Al2O3; Б) V2O5; В) N2O5.
6. В якому з оксидів валентність елемента найменша:
А) ZnO; Б) SO3; В) K2O.
7. Складіть формули оксидів за їх назвою:
А) плюмбум (ІІ) оксид; Б) нітроген (V) оксид; В) літій оксид.
8. Назвіть оксиди
А) In2O3; Б) Au2O; В) P2O5.
Варіант 4
1. Виберіть ряд в якому є лише оксиди:
А) H2O, CO2, SO3; Б) HI, CaO, P2O5; В) NO2, Mn2O7, CaC2.
2. Виберіть ряд в якому є лише основні оксиди:
А) MgO, CaO, CO; Б) Li2O, Na2O, K2O; В) BaO, Cr2O3, SiO2.
3. Виберіть ряд в якому є лише кислотні оксиди:
А) NO2, CO2, SO2; Б) SO3, SeO3, Al2O3; В) CO2, ZnO, K2O.
4. Виберіть ряд в якому є лише амфотерні оксиди:
А) Cu2O, SiO2, HgO ; Б) Al2O3, V2O5, Cl2O7; В) MnO2, PbO, ZnO.
5. В якому з оксидів валентність елемента найбільша:
А) N2O; Б) SO2; В) CaO.
6. В якому з оксидів валентність елемента найменша:
А) CO; Б) Cr2O3; В) P2O5.
7. Складіть формули оксидів за їх назвою:
А) силіцій (ІV) оксид; Б) кобальт (ІІI) оксид; В) барій оксид.
8. Назвіть оксиди
А) CO; Б) MoO3; В) MnO2.
Урок 44. Склад і номенклатура основ
1. Хімічний диктант (по 0,5 бала)
Вставте пропущені слова:
1. Гідрати оксидів активних металів називаються _____.
2. Назви основ складаються з назви металу, валентності (якщо змінна) та слова _____.
3. Гідроксиди складаються з металу та одновалентних _____ груп (ОН), число яких дорівнює _____ металу.
4. За розчинністю у воді гідроксиди поділяють на _____ та _____.
5. Розчинні гідроксиди називають _____.
6. За числом гідроксильних груп основи поділяють на _____, _____, _____.
7. Луги можна добути при взаємодії _____ з водою.
8. Прикладами основ є: _____, _____, _____.
(Відповіді: 1 – основи; 2 – гідроксид; 3 – гідроксильних, валентності; 4 – розчинні, нерозчинні; 5 – лугами; 6 – однокислотні,двокислотні, трикислотні; 7 – активних металів; 8– NaOH, Ca(OH)2, Al(OH)3.)
2. Групова робота
Група 1
1. Розгадайте ребус:
 (Основа)
(Основа)
2. Вкажіть оксид, який утворить однокислотну основу:
А) Li2O; Б) Al2O3; В) CaO.
3. Вкажіть оксид, який утворить двокислотну основу:
А) BaO; Б) Rb2O; В) Cr2O3.
4. Вкажіть оксид, який утворить трикислотну основу:
А) TiO2; Б) SrO; В) Fe2O3.
5. Вкажіть оксид, який утворить розчинну основу:
А) Na2O; Б) FeO; В) Al2O3.
6. Вкажіть оксид, який утворить нерозчинну основу:
А) K2O; Б) Cr2O3; В) Cs2O.
Група 2
1. Розгадайте ребус:
 (Гідроксид)
(Гідроксид)
2. Вкажіть оксид, який утворить однокислотну основу:
А) ZnO; Б) Li2O; В) Fe2O3.
3. Вкажіть оксид, який утворить двокислотну основу:
А) K2O; Б) CaO; В) TiO2.
4. Вкажіть оксид, який утворить трикислотну основу:
А) Cr2O3; Б) Na2O; В) BaO.
5. Вкажіть оксид, який утворить розчинну основу:
А) Cr2O3; Б) Al2O3; В) SrO.
6. Вкажіть оксид, який утворить нерозчинну основу:
А) FeO; Б) Rb2O; В) CaO.
3. Самостійна робота (по 2 бали)
Варіант 1
1. Обчисліть масову частку Кальцію в кальцій гідроксиді.
2. Здійсніть перетворення: Na → Na2O → NaOH
3. Обчисліть масу ферум (ІІ) гідроксиду кількість речовини 0,25 моль.
4 Обчисліть кількість речовини калій гідроксиду об’ємом 6,72 л.
5. Запишіть формулу гідроксиду, що має такий склад: Ti – 41,4 %, O – 55,2%, H –3,4%.
Варіант 2
1. Обчисліть масову частку Натрію в натрій гідроксиді.
2. Здійсніть перетворення: Ca → CaO → Ca(OH)2
3. Обчисліть масу хром (ІІІ) гідроксиду кількість речовини 0,3 моль.
4 Обчисліть кількість речовини алюміній гідроксиду об’ємом 11,2 л.
5. Запишіть формулу гідроксиду, що має такий склад: Rb – 83,3 %, O 15,7 – %, H 1 –%.
Варіант 3
1. Обчисліть масову частку Калію в кальцій гідроксиді.
2. Здійсніть перетворення: Ba → BaO → Ba(OH)2
3. Обчисліть масу барій гідроксиду кількість речовини 0,05 моль.
4 Обчисліть кількість речовини купрум (ІІ) гідроксиду об’ємом 44,8 л.
5. Запишіть формулу гідроксиду, що має такий склад: Al – 34,6 %, O – 61,5%, H –3,9%.
Варіант 4
1. Обчисліть масову частку Барію в барій гідроксиді.
2. Здійсніть перетворення: K → K2O → KOH
3. Обчисліть масу ферум (ІІІ) гідроксиду кількість речовини 0,6 моль.
4 Обчисліть кількість речовини літій гідроксиду об’ємом 20,16 л.
5. Запишіть формулу гідроксиду, що має такий склад: Cs – 88,7 %, O – 10,7%, H –0,6%.
Урок 45. Склад і номенклатура кислот.
1. Хімічний диктант (по 0,5 бала)
Вставте пропущені слова:
1. Кислоти – це складні речовини, до складу яких входять один або кілька атомів _____, здатних заміщуватися на атоми металів, і _____.
2. Кислоти класифікують за: вмістом атомів _____ та за вмістом _____.
3. Валентність кислотних залишків визначається кількістю атомів _____, здатних заміщуватися на атоми металу.
4. За складом кислоти поділяються на _____ й _____.
5. За основністю кислоти поділяються на _____, _____, _____.
6. Під основністю кислот розуміють число атомів _____, здатних заміщуватися на атоми металу.
7. Назви кислот найкраще виводити від міжнародних назв _____ з додаванням слова «кислота».
8. Для кисневих кислот у випадку проявлення кислотоутворюючим елементом найвищої можливої валентності назва кислоти має закінчення _____.
9. Якщо кислотоутворюючий елемент проявляє в молекулі даної кислоти нижчу позитивну валентність, то назва кислоти має закінчення _____ або _____.
10. Назви безкисневих кислот у таких випадках мають закінчення _____ або _____.
(Відповіді: 1 – Гідрогену, кислотний залишок; 2 – Гідрогену, Оксигену; 3 – Гідрогену; 4 – оксигеновмісні, безоксигенові; 5 – одноосновні, двоосновні, триосновні; 6 – Гідрогену; 7 – кислотних залишків; 8 – -атна; 9 – -итна, -ітна; 10 – -идна, -ідна.)
2. Самостійна робота (по 2 бали)
Варіант 1
1. З наведених нижче формул випишіть окремо формули кислот різної основності: H3PO4, H2SO4, HNO2, HI, H2CO3, HPO3, H2S,
2. Укажіть валентність кислотних залишків, що входять до складу солей, які виражаються формулами: MgBr2, Ca3(PO4)2, KMnO4, Na2CO3.
3. Знайдіть масову частку Гідрогену в кислотах: А) хлоридній; Б) сульфітній.
4. Обчисліть масу карбонатної кислоти, об’ємом 448мл.
5. Розрахуйте яку масу борної кислоти (H3BO3) потрібно взяти щоб приготувати 200мл 10%-ого розчину.
Варіант 2
1. З наведених нижче формул випишіть окремо формули кислот різної основності: H4SiO4, H2SiO3, HNO2, H4P2O7, HMnO4, H2SO3, HCl,
2. Укажіть валентність кислотних залишків, що входять до складу солей, які виражаються формулами:Fe(NO3)3, Al2S3, PbCl4, KI.
3. Знайдіть масову частку Гідрогену в кислотах: А) сульфідній; Б) карбонатній.
4. Обчисліть масу хлоридної кислоти, об’ємом 672мл.
5. Розрахуйте яку масу селенатної кислоти (H2SeO4) потрібно взяти щоб приготувати 250мл 20%-ого розчину.
Варіант 3
1. З наведених нижче формул випишіть окремо формули кислот різної основності: HNO3, HBr, H3BO3, H2SO3, HF, HIO3, HClO3,
2. Укажіть валентність кислотних залишків, що входять до складу солей, які виражаються формулами: AlPO4, CuSO4, CaS, Na2SO3.
3. Знайдіть масову частку Гідрогену в кислотах: А) нітратній; Б) силікатній.
4. Обчисліть масу сульфатної кислоти, об’ємом 560мл.
5. Розрахуйте яку масу ренієвої кислоти (HReO4) потрібно взяти щоб приготувати 100мл 15%-ого розчину.
Варіант 4
1. З наведених нижче формул випишіть окремо формули кислот різної основності: H3AsO4, HReO4, HClO3, HNCS, HCN, H2SeO4, H3PO3,
2. Укажіть валентність кислотних залишків, що входять до складу солей, які виражаються формулами: K3PO4, BaCl2, Na2SiO3, Ca3(PO4)2.
3. Знайдіть масову частку Гідрогену в кислотах: А) карбонатній; Б) бромідній.
4. Обчисліть масу нітратної кислоти, об’ємом 784мл.
5. Розрахуйте яку масу ортофосфатної кислоти (H3PO4) потрібно взяти щоб приготувати 300мл 25%-ого розчину.
3. Тести (по 0,5 бала)
Варіант 1
1. Кислотою є:
А) H2SO4; Б) K2SO4; В) KOH.
2. Безоксигеновою кислотою є:
А) H2SO3; Б) HPO3; В) HBr.
3. Оксигеновмісною кислотою є:
А) HI; Б) H2SiO3; В) H2S.
4. Одноосновною кислотою є:
А) HNO3; Б) H2SO4; В) H3BO3.
5. Двоосновною кислотою є:
А) H2CO3; Б) HNO2; В) HF.
6. Триосновною кислотою є:
А) HPO3; Б) H3PO4; В) H2SiO3.
Варіант 2
1. Кислотою є:
А) H2O2; Б) СaSO4; В) H2SO3
2. Безоксигеновою кислотою є:
А) HCl; Б) HNO3; В) HNO2
3. Оксигеновмісною кислотою є:
А) HBr; Б) H2SO4; В) H2S.
4. Одноосновною кислотою є:
А) H3PO4; Б) H2CO3; В) HI.
5. Двоосновною кислотою є:
А) H2SiO3; Б) HPO3; В) HF.
6. Триосновною кислотою є:
А) HCl; Б) H3BO3; В) H2SO4.
Варіант 3
1. Кислотою є:
А) KBr; Б) NaBr; В) HBr.
2. Безоксигеновою кислотою є:
А) H2S; Б) H2SO4; В) H2SO3.
3. Оксигеновмісною кислотою є:
А) HI; Б) HNO2; В) HCl.
4. Одноосновною кислотою є:
А) HPO3; Б) H2SiO3; В) H3BO3.
5. Двоосновною кислотою є:
А) HBr; Б) H3PO4; В) H2CO3.
6. Триосновною кислотою є:
А) H3BO3; Б) HNO3; В) H2SiO3.
4. Групова робота на швидкість
Розгадайте кросворд, записавши у відповідні клітинки назви кислот.
По горизонталі: 2. H2SO4. 4. HI. 5. HNO3. 6. HBr. 7. H2SO3. 8. H3BO3. 12. H2CO3.
По вертикалі: 1. H2S. 3. HCl. 7. H2SiO3. 9. HF. 10. HNO2. 11. H3PO4.
Урок 46. Склад і номенклатура солей.
1. Хімічний диктант (по 0,5 бала)
Вставте пропущені слова:
1. Солі – це складні речовини, утворені катіонами _____ і аніонами _____.
2. За міжнародною номенклатурою назва солі складається з назви _____ й назви _____.
3. Назва солі безоксигенової кислоти має суфікс _____.
4. Назва солі оксигеновмісної кислоти в разі максимальної валентності кисло утворювального елемента має суфікс _____, і в разі нижчої його валентності – _____.
5. Солі, утворені внаслідок заміщення всіх атомів Гідрогену в кислоті на катіони металічних елементів, називають _____.
(Відповіді: 1 – металів, кислотними залишками; 2 – металу, кислотного залишку;
3 – -ид (-ід); 4 – -ат, -іт; 5 – середніми)
2. Групова робота
Складіть формули таких солей:
Група 1

Група 2

Група 3

3. Тести (по 0,5 бала)
Варіант 1
1. Валентність кислотного залишку у солі Al2(SO4)3:
А) І; Б) ІІ; В) ІІІ.
2. Валентність кислотного залишку у солі CaCl2:
А) І; Б) ІІ; В) ІІІ.
3. Валентність кислотного залишку у солі FePO4:
А) І; Б) ІІ; В) ІІІ.
4. Валентність кислотного залишку у солі CaSO3:
А) І; Б) ІІ; В) ІІІ.
5. Валентність кислотного залишку у солі Na2CO3:
А) І; Б) ІІ; В) ІІІ.
6. Валентність кислотного залишку у солі Fe2S3:
А) І; Б) ІІ; В) ІІІ.
Варіант 2
1. Валентність кислотного залишку у солі Na2S:
А) І; Б) ІІ; В) ІІІ.
2. Валентність кислотного залишку у солі FeBr3:
А) І; Б) ІІ; В) ІІІ.
3. Валентність кислотного залишку у солі Ba3(PO4)2:
А) І; Б) ІІ; В) ІІІ.
4. Валентність кислотного залишку у солі K2SiO3:
А) І; Б) ІІ; В) ІІІ.
5. Валентність кислотного залишку у солі : FeCO3
А) І; Б) ІІ; В) ІІІ.
6. Валентність кислотного залишку у солі K2SO3:
А) І; Б) ІІ; В) ІІІ.
Варіант 3
1. Валентність кислотного залишку у солі PbS:
А) І; Б) ІІ; В) ІІІ.
2. Валентність кислотного залишку у солі Zn(NO3)2:
А) І; Б) ІІ; В) ІІІ.
3. Валентність кислотного залишку у солі Na2SiO3:
А) І; Б) ІІ; В) ІІІ.
4. Валентність кислотного залишку у солі CaSO4:
А) І; Б) ІІ; В) ІІІ.
5. Валентність кислотного залишку у солі ZnI2:
А) І; Б) ІІ; В) ІІІ.
6. Валентність кислотного залишку у солі Mg3(PO4):
А) І; Б) ІІ; В) ІІІ.
4. Вірю – не вірю (по 0,5 бала)
Поставте знак «+», якщо формула записана вірно, або «–», якщо не вірно.
1) барій хлорид BaCl2
2) кальцій фосфат CaPO4
3) натрій сульфат Na2SO4
4) калій сульфід K2S
5) цинк бромід ZnBr
6) алюміній нітрат Al(NO3)2
(Відповіді: 1) +, 2) –, 3) +, 4) +, 5) –, 6) –)
5. Самостійна робота (по 2 бали)
Варіант 1
1. Запишіть формули таких солей та обчисліть їх відносну молекулярну масу:
А) магній карбонат;
Б) калій силікат.
2. Обчисліть масові частки натрію в:
А) натрій сульфаті;
Б) натрій сульфіті.
3. Обчисліть масу цинк хлориду, кількістю речовини 1,5 моль.
4. Кухонну сіль (натрій хлорид) масою 1 г розчинили у 250 мл води. Обчисліть масову частку утвореного розчину.
Варіант 2
1. Запишіть формули таких солей та обчисліть їх відносну молекулярну масу:
А) цинк сульфат;
Б) алюміній сульфід.
2. Обчисліть масові частки кальцію в:
А) кальцій карбонаті;
Б) кальцій нітраті.
3. Обчисліть масу ферум (ІІІ) фосфату, кількістю речовини 0,25 моль.
4. Кальцій бромід масою 1,5 г розчинили у 300 мл води. Обчисліть масову частку утвореного розчину.
Варіант 3
1. Запишіть формули таких солей та обчисліть їх відносну молекулярну масу:
А) калій нітрат;
Б) кальцій сульфат.
2. Обчисліть масові частки барію в:
А) барій карбонаті;
Б) барій хлориді.
3. Обчисліть масу натрій фосфату, кількістю речовини 1,5 моль.
4. Натрій силікат масою 3 г розчинили у 200 мл води. Обчисліть масову частку утвореного розчину.
Урок 47. Фізичні властивості оксидів.
1. Хімічний диктант (по 0,5 бала)
Вставте пропущені слова:
1. Оксиди в природі перебувають у _____ агрегатних станах.
2. Оксиди утворюють _____, _____ та _____ кристалічні ґратки.
3. Деякі оксиди мають _____ або можуть бути прозорі.
4. Температури плавлення й кипіння оксидів змінюються в діапазоні.
5. Оксиди металів являють собою _____ речовини.
6. Оксиди неметалів – це, навпаки, переважно леткі речовини і_____.
(Відповіді: 1 – трьох; 2 – молекулярні, атомні, йонні; 3 – забарвлення; 4 – широкому; 5 – кристалічні; 6 – гази)
2. Тести (по 0,5 бала)
Варіант 1
1. Вкажіть основний оксид:
А) N2O5; Б) CaO; В) P2O5.
2. Вкажіть кислотний оксид:
А) MgO; Б) K2O; В) CO2.
3. Серед поданих оксидів газоподібним є:
А) NO2; Б) ZnO; В) CuO.
4.Серед поданих оксидів рідиною є:
А) CoO; Б) Al2O3; В) H2O.
5. Серед поданих оксидів у твердому стані перебуває:
А) SO2; Б) Cr2O3; В) CO2.
6. Серед поданих отруйним оксидом є:
А) CO; Б) FeO; В) Fe2O3.
Варіант 2
1. Вкажіть основний оксид:
А) SO2; Б) ZnO; В) CO2.
2. Вкажіть кислотний оксид:
А) P2O5; Б) Na2O; В) CuO.
3. Серед поданих оксидів газоподібним є:
А) BaO; Б) H2O; В) SO2.
4.Серед поданих оксидів рідиною є:
А) Fe2O3; Б) SO3; В) MgO.
5. Серед поданих оксидів у твердому стані перебуває:
А) SO3; Б) CO; В) Al2O3.
6. Серед поданих отруйним оксидом є:
А) CaO; Б) SiO2; В) NO2.
Варіант 3
1. Вкажіть основний оксид:
А) MgO; Б) SO3; В) Cl2O7.
2. Вкажіть кислотний оксид:
А) N2O5; Б) SrO; В) HgO.
3. Серед поданих оксидів газоподібним є:
А) MnO; Б) Ag2O; В) CO2.
4.Серед поданих оксидів рідиною є:
А) H2O; Б) Na2O; В) SrO.
5. Серед поданих оксидів у твердому стані перебуває:
А) NO2; Б) CO2; В) K2O.
6. Серед поданих отруйним оксидом є:
А) BaO; Б) BeO; В) SO2.
3. Самостійна робота (по 2 бали)
Варіант 1
1. Запишіть формули таких оксидів: ванадій (V) оксид, нікель (ІІ) оксид, кадмій оксид. Обчисліть їх відносні молекулярні маси.
2. Обчисліть масову частку Оксигену в оксидах:
А) ферум (ІІІ) оксид;
Б) хлор (VII) оксид.
3. Обчисліть масу літій оксиду, кількістю речовини 2,5 моль.
4. Обчисліть об’єм, який займе карбон (ІІ) оксид, кількістю речовини 0,25 моль.
5. Білі кристали барій оксиду масою 1,5 г розчинили у 100 г води. Обчисліть масову частку утвореного розчину.
Варіант 2
1. Запишіть формули таких оксидів: фосфор (V) оксид, реній (VІІ) оксид, арґентум (І) оксид. Обчисліть їх відносні молекулярні маси.
2. Обчисліть масову частку Оксигену в оксидах:
А) титан (ІV) оксид;
Б) манган (VII) оксид.
3. Обчисліть масу купрум (ІІ) оксиду, кількістю речовини 0,5 моль.
4. Обчисліть об’єм, який займе карбон (ІV) оксид, кількістю речовини 0,15 моль.
5. Безбарвні кристали оксиду бору масою 2,2 г розчинили у 100 г води за температури 20ºС. Обчисліть масову частку утвореного розчину.
Варіант 3
1. Запишіть формули таких оксидів: хром (VІ) оксид, фосфор (ІІІ) оксид, купрум (І) оксид. Обчисліть їх відносні молекулярні маси.
2. Обчисліть масову частку Оксигену в оксидах:
А) кобальт (ІІІ) оксид;
Б) алюміній оксид.
3. Обчисліть масу плюмбум (ІІ) оксиду, кількістю речовини 1,25 моль.
4. Обчисліть об’єм, який займе нітроген (ІV) оксид, кількістю речовини 0,75 моль.
5. Білий порош магній оксиду масою 86 г розчинили у 1000 г води. Обчисліть масову частку утвореного розчину.
Варіант 4
1. Запишіть формули таких оксидів: хлор (V) оксид, манган (ІІ) оксид, станум (ІV) оксид. Обчисліть їх відносні молекулярні маси.
2. Обчисліть масову частку Оксигену в оксидах:
А) силіцій (ІV) оксид;
Б) хром (VI) оксид.
3. Обчисліть масу меркурій (ІІ) оксиду, кількістю речовини 1,05 моль.
4. Обчисліть об’єм, який займе сульфур (ІV) оксид, кількістю речовини 1,25 моль.
5. Темно-червоні кристали хром (VІ) оксиду масою 169 г розчинили у 100 г води за температури 25ºС. Обчисліть масову частку утвореного розчину.
Урок 48. Хімічні властивості основних та кислотних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.
1. Хімічний диктант (по 0,5 бала)
Вставте пропущені слова:
1 Основним оксидам відповідають _____.
2. Основні оксиди реагують з _____, _____, _____.
3. Під час реакцій з кислотами основні оксиди утворюють _____.
4. Кислотним оксидам відповідають _____.
5. Кислотні оксиди вступають у хімічну взаємодію з _____ (виняток SiO2), _____, _____. 6. Продуктами взаємодії кислотних оксидів з основами є _____.
7. Основні й кислотні оксиди взаємодіють між собою з утворенням _____.
8. Амфотерні оксиди проявляють властивості _____ і _____ оксидів.
(Відповіді: 1 – основи; 2 – водою, кислотами, кислотними оксидами; 3 – солі; 4 – кислоти; 5 – водою, основними оксидами, основами; 6 – солі; 7– солей; 8 – основних, кислотних)
2. Тести (по 0,5 бала)
Варіант 1
1. Вкажіть на кислотний оксид:
А) CaO; Б) N2O5; В) Na2O.
2. Вкажіть на основний оксид:
А) CO2; Б) K2O; В) Cl2O7.
3. Вкажіть несолетворний оксид:
А) CO; Б) Fe2O3; В) SiO2.
4. Який оксид при взаємодії з водою утворить кислоту:
А) SrO; Б) CO2; В) HgO.
5. Який оксид при взаємодії з водою утворить основу:
А) SO2; Б) CO2; В) MgO.
6. Який оксид при взаємодії з водою утворить луг:
А) Ag2O; Б) Na2O; В) Cr2O3.
7. Який оксид реагуватиме з кальцій оксидом:
А) CuO; Б) CrO; В) SO3.
8. Який оксид реагуватиме з фосфор (V) оксидом:
А) XeO3; Б) SeO3; В) Li2O.
9. Який оксид реагуватиме з натрій гідроксидом:
А) P2O5; Б) BaO; В) Ag2O.
10. Який оксид реагуватиме з хлоридною кислотою:
А) K2O; Б) Mn2O7; В) Cl2O7.
Варіант 2
1. Вкажіть на кислотний оксид:
А) Fe2O3; Б) HgO; В) SiO2.
2. Вкажіть на основний оксид:
А) Cl2O7; Б) K2O; В) Cl2O7.
3. Вкажіть несолетворний оксид:
А) TiO2; Б)N2O; В) Sc2O3.
4. Який оксид при взаємодії з водою утворить кислоту:
А) SO3; Б) Al2O3; В) Cr2O3.
5. Який оксид при взаємодії з водою утворить основу:
А) SeO3; Б) BeO; В) P2O5.
6. Який оксид при взаємодії з водою утворить луг:
А) K2O; Б) MgO; В) ZnO.
7. Який оксид реагуватиме з кальцій оксидом:
А) NO2; Б) FeO; В) MnO.
8. Який оксид реагуватиме з фосфор (V) оксидом:
А) SO2; Б) CO2; В) ZnO.
9. Який оксид реагуватиме з натрій гідроксидом:
А) Fe2O3; Б) TiO2; В) NO2.
10. Який оксид реагуватиме з хлоридною кислотою:
А) P2O5; Б) SO3; В) Na2O.
Варіант 3
1. Вкажіть на кислотний оксид:
А) N2O3; Б) MgO; В) SrO.
2. Вкажіть на основний оксид:
А) NO2; Б) BaO; В) P2O5.
3. Вкажіть несолетворний оксид:
А) NO; Б) CrO ; В) Li2O.
4. Який оксид при взаємодії з водою утворить кислоту:
А) CaO; Б) Cr2O3; В) NO2.
5. Який оксид при взаємодії з водою утворить основу:
А) CO2; Б) SO3; В) CaO.
6. Який оксид при взаємодії з водою утворить луг:
А) BaO; Б) ZnO; В) Fe2O3.
7. Який оксид реагуватиме з кальцій оксидом:
А) MgO; Б) Al2O3; В) N2O3.
8. Який оксид реагуватиме з фосфор (V) оксидом:
А) SeO3; Б) CO2; В) Na2O.
9. Який оксид реагуватиме з натрій гідроксидом:
А) Li2O; Б) Cr2O3; В) SeO3.
10. Який оксид реагуватиме з хлоридною кислотою:
А) Sc2O3; Б) SO3; В) P2O5.
3. Самостійна робота (по 3 бали)
Варіант 1
1. Запишіть назви даних оксидів. Обчисліть масові частки Оксигену в кожному оксиді.
А) Co2O3; Б) As2O5; В) SeO3.
2. Допишіть продукти реакцій та урівняйте рівняння реакцій:
А) CaO + SiO2 =
Б) CO2 + H2O =
В) K2O + H2O =
3. Здійсніть перетворення: Na→Na2O→NaOH→Na2CO3
4. Алюміній оксид провзаємодіяв з фосфор (V) оксидом. Обчисліть масу утвореної солі, якщо її кількість речовини становить 0,25 моль.
Варіант 2
1. Запишіть назви даних оксидів. Обчисліть масові частки Оксигену в кожному оксиді.
А) Fe2O3; Б) P2O5; В) TiO2.
2. Допишіть продукти реакцій та урівняйте рівняння реакцій:
А) Na2O + H2O =
Б) SO3 + H2O =
В) MgO + NO2 =
3. Здійсніть перетворення: K→K2O→KOH→K2SO4
4. Цинк оксид провзаємодіяв з сульфур (VI) оксидом. Обчисліть масу утвореної солі, якщо її кількість речовини становить 1,5 моль.
Варіант 3
1. Запишіть назви даних оксидів. Обчисліть масові частки Оксигену в кожному оксиді.
А) Co2O3; Б) As2O5; В) SeO3.
2. Допишіть продукти реакцій та урівняйте рівняння реакцій:
А) CaO + SiO2 =
Б) CO2 + H2O =
В) K2O + H2O =
3. Здійсніть перетворення: Zn→ZnO→Zn(OH)2→ZnCl2
4. Натрій оксид провзаємодіяв з карбон (ІV) оксидом. Обчисліть масу утвореної солі, якщо її кількість речовини становить 1,25 моль.
Варіант 4
1. Запишіть назви даних оксидів. Обчисліть масові частки Оксигену в кожному оксиді.
А) Co2O3; Б) As2O5; В) SeO3.
2. Допишіть продукти реакцій та урівняйте рівняння реакцій:
А) CaO + SiO2 =
Б) CO2 + H2O =
В) K2O + H2O =
3. Здійсніть перетворення: Al→Al2O3→Al(OH)→AlPO4
4. Кальцій оксид провзаємодіяв з нітроген (ІV) оксидом. Обчисліть масу утвореної солі, якщо її кількість речовини становить 0,5 моль.
Урок 49. Хімічні властивості амфотерних оксидів: взаємодія з кислотами, лугами.
- Опорний конспект до уроку.
здатність виявляти подвійні
хімічні властивості (основні та кислотні)
![]()
![]() Амфотерність
Амфотерність
характерна для
![]()
![]()
оксидів гідроксидів
![]()
![]()
хімічних елементів (Zn, AI, Be, Cr (III), Fe (III), Pb, Sn)
2. «Хрестики – нулики»
Виграшний шлях: амфотерні оксиди.
|
К2О |
Fe2O3 |
P2O5 |
|
SO3 |
АІ2O3 |
CO2 |
|
CO |
ZnO |
Cu2O |
Виграшний шлях: амфотерні оксиди.
|
Cr2O3 |
Fe2O3 |
SnO2 |
|
Li2O |
PbO2 |
SO2 |
|
CI2O7 |
К2О
|
BeO |
3. Вставте пропущені слова, щоб вираз став завершений:
1. Амфотерність – це здатність оксидів та гідроксидів виявляти хімічні властивості
______________ і _____________ .
2. Алюміній оксид і алюміній гідроксид у реакціях з кислотами поводить себе як
________ .
3. Кислотні властивості оксиду і гідроксиду цинку виявляються у реакціях з __________ .
4. Амфотерними є оксиди і гідроксиди таких елементів: ________________________ .
5. Оксиди і гідроксиди перелічених елементів відносять до групи _____________ .
4. Заповнити схему хімічні властивості амфотерних сполук:
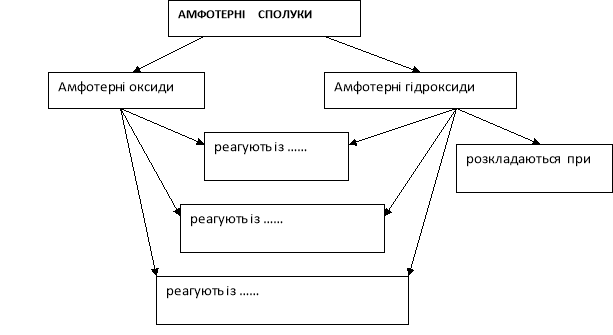
5. Самостійна робота:
І варіант.
І рівень.
1. Zn, AI, Be, Cr (III), Fe (III), Pb, Sn– це елементи, оксиди і гідроксиди яких
виявляють ______ властивості.
2. Позначте формулу амфотерного гідроксиду:
А. Са(ОН)2. Б. NaОН. В. Ва(ОН)2. Г. АІ(ОН)3 .
3. Запишіть формули оксидів і гідроксидів таких елементів: АІ, Zn, Be.
ІІ рівень.
1. Позначте дві формули амфотерних оксидів:
А. СаО. Б. ВеО. В. ВаО. Г. АІ2О3 .
2. Допишіть продукти реакцій, поставте коефіцієнти:
А. AI(OH)3 + H2SO4 → ______ + H2O Б. AI(OH)3 + NaOH → ______ + H2O
3. Цинк гідроксид масою 49,5 г повністю прореагував з хлоридною кислотою. Яка
маса солі утворилася?
А. 68. Б. 34. В. 78. Г. 87.
ІІІ рівень.
1. Напишіть рівняння реакцій між речовинами: NaOH i AI2O3; H2SO4 і AI2O3
а) _______________________ б)_____________________
2. Як можна розпізнати білі порошки гідроксидів Магнію та Цинку, використавши
відмінності в їх хімічних властивостях?
3. Амфотерний гідроксид має відносну формульну масу 103. Що це за сполука?
IV рівень.
1. Під час розкладу алюміній гідроксиду масою 39 г утворився алюміній оксид масою 20 г. Чи повністю розклалася сполука?
2. Напишіть рівняння реакцій між речовинами: а) ферум (ІІІ) гідроксидом та нітратною кислотою; б) цинк оксидом та натрій гідроксидом.
а)_________________________ б)______________________
ІІ варіант.
І рівень.
1. Амфотерність – це здатність оксидів та гідроксидів виявляти хімічні властивості
______________ і _____________ .
2. Позначте формулу амфотерного оксиду:
А. СаО. Б. Na2О. В. ВаО. Г. PbО2 .
3. Запишіть формули оксидів і гідроксидів таких елементів: Cr (III), Fe (III), Pb.
ІІ рівень.
1. Позначте дві формули амфотерних гідроксидів:
А. АІ(ОН)3 . Б. Ве(ОН)2. В. Ва(ОН)2. Г. Са(ОН)2.
2. Допишіть продукти реакцій, поставте коефіцієнти:
А. Cr(OH)3 + HNO3 → ______ + H2O Б. Cr(OH)3 + KOH → ______ + H2O
3. Алюміній гідроксид масою 39 г повністю прореагував з сульфатною кислотою. Яка
маса солі утворилася?
А. 86,5. Б. 64. В. 78,5. Г. 85,5.
ІІІ рівень.
1. Напишіть рівняння реакцій між речовинами: КOH i Fe2O3; H2SO4 і ZnO.
а) _______________________ б)_____________________
2. Як можна розпізнати білі порошки гідроксидів Барію та Цинку, використавши
відмінності в їх хімічних властивостях?
3. Амфотерний гідроксид має відносну формульну масу 78. Що це за сполука?
IV рівень.
1. Яка маса ферум (ІІІ) оксиду містить стільки йонів, скільки молекул міститься в
11г карбон (IV) оксиду?
2. Напишіть рівняння реакцій між речовинами: а) ферум (ІІІ) гідроксидом та
сульфатною кислотою; б) плюмбум (ІІ) оксидом та натрій гідроксидом.
а)_________________________ б)______________________
Урок 50. Фізичні властивості основ. Заходи безпеки під час роботи з лугами.
Розрахункові задачі: 5. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції.
1. Вправа «Мікрофон»:
Яких правил ми повинні дотримуватися під час роботи з лугами?
2. Гра «Вірю – не вірю»:
Вчитель читає твердження, учні дають одну з відповідей: «так» або «ні»
1.Луги та їхні розчини милкі на дотик.
2.Луги можна брати руками і пробувати на смак.
3.Розчини лугів роз’їдають багато матеріалів.
4.Луги спричиняють серйозні опіки шкіри, слизових оболонок, сильно вражають очі.
5. Працюючи з лугами та їхніми розчинами, треба бути особливо обережними.
6. Якщо розчин лугу потрапив на руку, то робити не треба нічого.
7. Якщо розчин лугу потрапив на руку, то треба негайно змити його великою
кількістю проточної води і звернутися за допомогою до вчителя чи лаборанта.
8. Для знешкодження залишків лугу використовують розчин питної соди.
9. Для знешкодження залишків лугу використовують розчин оцтової кислоти.
3. Вставте пропущені слова, щоб вираз став завершеним:
1. Основи – складні речовини, до складу яких входить атом __________ і одна чи
кілька _______________ груп.
2. Кількість гідроксильних груп визначає _____________ металу.
3. Назви основ походять від назви відповідного ________ з додаванням слова ________.
4. Змінна валентність металу вказується __________ цифрою, взятою в ________.
5. Основи за розчинністю класифікуються на ___________ і ____________.
6. Розчинні основи називають __________.
7. Розчинні основи утворюють _____________ і ____________ метали.
8. Ферум(ІІІ) гідроксид відносять до ____________ основ.
9. Розчин калій гідроксиду називають _____________.
10.Розчинна чи нерозчинна у воді основа визначають за _________ розчинності.
4. Хімічний ланцюжок.
А. Складіть формули основ, які відповідають запропонованим оксидам.
Б. Встановіть послідовний ланцюжок зростання кількості гідроксильних груп.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
5. Робота зі схемою «Фізичні властивості основ»
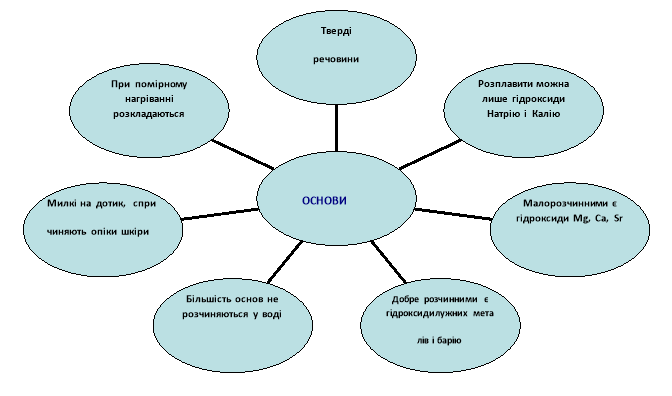
6. Розрахункові задачі: 5. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції.
Алгоритм розв’язування розрахункових задач.
1. Записуємо скорочену умову задачі.
2. Складаємо хімічне рівняння.
3. Готуємо запис для складання пропорції:
а) під формулами сполук записуємо відповідно до умови кількість речовини
(масу чи об’єм), враховуючи коефіцієнти;
б) над формулами – наведені в умові задачі кількість речовини (масу чи об’єм), а невідому речовину позначаємо через х.
4. Складаємо пропорцію і розв’язуємо її.
І рівень.
1. Спалили карбон(ІІ) оксид кількістю речовини 0,5 моль. Який об’єм карбон(IV)
оксиду (н. у.) виділиться при цьому?
2. На спалювання певної кількості фосфору витратили кисень об’ємом 5,6 л (н. у.).
Визначити масу фосфор (V) оксиду, що утворився.
3. Яку кількість речовини водню потрібно використати на відновлення хром(ІІІ)
оксиду масою 60,8 г ?
4. Який об’єм водню (н. у.) згорів у кисні, якщо утворилася вода масою 72 г?
5. Яку масу залізної окалини можна відновити воднем об’ємом 40,32 л (н. у.).
ІІ рівень.
1. Нагріли меркурій (ІІ) оксид кількістю речовини 0,4 моль до повного його розкладу. Яка маса ртуті та об’єм кисню утворилися?
2. Спалили карбон(ІІ) оксид кількістю речовини 2,5 моль. Обчислити об’єм
карбон(IV) оксиду (н. у.), що виділиться при цьому і масу кисню, яка була
використана?
3.У результаті спалювання метану (СН4) одержали воду масою 39,6 кг. Який об’єм
метану (н. у.) спалили? Яка кількість речовини кисню витратилась на реакцію?
4. Яку кількість речовини водню потрібно використати на відновлення хром(ІІІ)
оксиду масою 30,4 г ? Яка маса хрому утворилася?
5. На барій оксид масою 30,9 г подіяли водою, взятою у надлишку. Яка маса та
кількість речовини барій гідроксиду утворилася?
ІІІ рівень.
1. Водень масою 9г згорів в атмосфері кисню. Яку масу кальцій оксиду можна
розчинити у воді, що утворилася? Якій кількості речовини відповідає така маса
кальцій оксиду?
2. Сульфур(VІ) оксид масою 32 г пропустили через воду. Яку масу ферум(ІІ) оксиду
можна розчинити в утвореній кислоті? Якій кількості речовини відповідає така
маса ферум(ІІ) оксиду?
3. Фосфор(V) оксид масою 14,2 г розчинили у воді. Яка маса калій гідроксиду може
вступити у реакцію з утвореною кислотою? Якій кількості речовини відповідає
така маса?
4. Нітроген(V) оксид масою 10,2 г пропустили через воду. Яку масу кальцій оксиду
можна розчинити в утвореній кислоті? Якій кількості речовини відповідає така
маса кальцій оксиду?
5. Чи вистачить кисню об’ємом 40 л (н. у.) для спалювання метану кількістю 1,8
моль?
ІV рівень.
1. На суміш порошків цинку та цинк оксиду масою 40 г подіяли надлишком
сульфатної кислоти. Утворилася вода масою 36 г. Які маси речовин у суміші?
2. В якому випадку виділиться більше газу і у скільки разів: під час реакції
розкладу калій хлорату 122,5 г чи калій перманганату кількістю речовини
0,2 моль?
3. На меркурій (ІІ) оксид подіяли хлоридною кислотою кількістю 5 моль. Обчисліть,
яка кількість речовини та маса меркурій (ІІ) оксиду прореагувала? Яке число
молекул в отриманій порції меркурій (ІІ) оксиду?
4. В якому випадку виділиться більше газу і у скільки разів: під час реакції
розкладу гідроген пероксиду масою 34 г чи натрій нітрату кількістю речовини
2,5 моль?
5. Кальцій оксид розчинили у воді кількістю 4,5 моль. Обчислити кількість речовини
та масу утвореного кальцій гідроксиду. Яке число молекул відповідає такій
кількості кальцій гідроксиду?
Урок 51. Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Реакція нейтралізації.
- Опорний конспект до уроку.
Хімічні властивості розчинних основ (лугів)
![]()
+Н кисл.зал. Ме кисл.зал. + Н2О
![]() Ме ОН (кислота) (сіль)
Ме ОН (кислота) (сіль)
Розчинні
![]() основи + Ме кисл.зал. Ме ОН↓ + Ме кисл.зал.
основи + Ме кисл.зал. Ме ОН↓ + Ме кисл.зал.
(луги) (Ме, що утвор. ( нерозч. ін. сіль
нерозч.основу) основа)
![]() + Нем. О (кисл. оксид) Ме кисл.зал. + Н2О
+ Нем. О (кисл. оксид) Ме кисл.зал. + Н2О
(сіль)
![]() + індикатор: лакмус з фіолетового на синій
+ індикатор: лакмус з фіолетового на синій
![]() фенолфталеїн з безбарвного на малиновий
фенолфталеїн з безбарвного на малиновий
![]()
![]() метилоранж з оранжевого на жовтий
метилоранж з оранжевого на жовтий
2. «Хрестики – нулики»
Виграшний шлях: розчинні основи.
|
КОН |
Fe(OН)3 |
Cu(OН)2 |
|
Cr(OH)3 |
Li OH |
Mg(OH)2 |
|
Ni(OH)2 |
Zn(OH)2 |
Ba(OH)2 |
Виграшний шлях: нерозчинні основи.
|
Cr(OH)3 |
NaOH |
Sn(OH)2 |
|
Fe(OH)3 |
LiOH |
Ba(OH)2 |
|
Fe(OH)2 |
CsОH
|
Be(OH)2 |
3. Хімічний ланцюжок.
А. Складіть формули лугів і малорозчинних основ, які відповідають
запропонованим оксидам.
Б. Встановіть послідовний ланцюжок зростання їхніх молекулярних мас.
![]()
![]()
![]()
![]() І варіант.
І варіант.
ІІ варіант.
![]()
![]()
![]()
![]()
4. Напишіть рівняння реакцій, які відбуваються між натрій гідроксидом і
запропонованими у схемі речовинами.
![]()
![]()
![]()
 HNO3
HNO3
+ +
![]()
![]()
![]()
![]()
 SO3 + +
SO3 + +
![]()
![]() + NaOH +
+ NaOH +
![]()
![]()
![]() H2SO4
H2SO4
![]() + +
+ +
![]()
![]()
![]()


+ + +
![]()
![]()
![]()
5. Тренувальні вправи.
І рівень.
1. Вкажіть пару речовин, які вступають у хімічну взаємодію з калій гідроксидом:
А. CO2, FeCI3. Б. AICI3, H2O. В. CaO, Cr(OH)2. Г. MgO, HCI.
2. Позначте реакцію взаємодії калій гідроксиду з нітратною кислотою:
А.. MgO + 2HCI → MgCI2 + H2O. Б. AICI3 + 3KOH → AI(OH)3 + 3KCI.
В. KOH + HNO3 → KNO3 + H2O. Г. CO2 + 2NaOH →Na2CO3 + H2O.
3. Як зміниться колір фенолфталеїну у розчині натрій гідроксиду:
А. Синій. Б. Рожевий. В. Малиновий. Г. Жовтий.
ІІ рівень.
1. Вкажіть дві схеми реакцій, які характеризують хімічні властивості лугів:
А. CO2 + FeО → . Б. AI(OH)3 → . В. NaOH + H3PO4 →. Г. KOH + SO3 → .
2. Допишіть продукти реакцій, поставте коефіцієнти:
А.. Mg(OH)2 + HCI → Б. SO3 + KOH →
В. KOH + HNO3 → Г. CO2 + LiOH →
3. Обчисліть масу натрій карбонату, що утвориться в результаті реакції натрій гідроксиду з карбон(IV) оксидом об’ємом 5,6 л.
ІІІ рівень.
1. Вкажіть суму коефіцієнтів у рівнянні реакції: AICI3 + KOH → AI(OH)3 + KCI.
А. 6 Б. 5 В. 8 Г. 9
2. Напишіть рівняння реакцій між речовинами поданими формулами: H2SO4, NaOH,
BaO, Mg(OH)2, H3PO4.
IV рівень.
1. Напишіть всі можливі рівняння реакцій між речовинами: хлоридна кислота, вода,
магній оксид, карбон(ІV) оксид, барій гідроксид, нітратна кислота, натрій
гідроксид. Укажіть типи реакцій.
2. Здійсніть перетворення подані схемою:
калій перманганат → кисень → кальцій оксид → кальцій гідроксид → кальцій хлорид.
3. Магній гідроксид масою 11,6 г повністю нейтралізували розчином хлоридної
кислоти. Обчисліть масу і кількість речовини продуктів реакції.
Урок 52. Хімічні властивості нерозчинних основ: взаємодія з кислотами і
розкладання внаслідок нагрівання.
1. Опорний конспект до уроку.
Хімічні властивості нерозчинних основ:
![]()
![]() + Н кисл.зал. Ме кисл.зал. + Н2О
+ Н кисл.зал. Ме кисл.зал. + Н2О
Ме ОН (кислота) (сіль)
Нерозчинні
основи
![]() розкладання при t0 Ме О + Н2О
розкладання при t0 Ме О + Н2О
![]() (основний
(основний
оксид)
2. «Третій зайвий»
В – І 1. KОН, NaOН, Ca(OН)2.
2. Sn(OН)2, AI(ОН)3, КОH.
3. Ca(OН)2, LiOH, RbOH.
4. Cr(OH)3, Fe(OH)2, CsOH.
В – ІІ 1. Cr(OH)3, Mg(OH)2, Ca(OH)2.
2. Fe(OH)3, Ba(OH)2, KOH.
3. LiOH, Cu(OH)2, Cr(OH)3.
4. Pb(OH)2, Zn(OH)2, Ba(OH)2.
3. Скласти формули сполук за схемою:
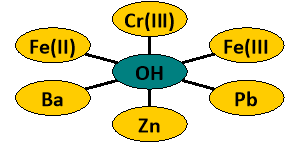
4. Складіть формули запропонованих сполук: калій оксид, цинк гідроксид, натрій гідроксид, хром(ІІ) оксид, алюміній оксид, сульфур (VI) оксид, карбон (ІV) оксид, ферум(ІІІ) оксид, барій гідроксид, купрум(ІІ) гідроксид, хром ((VI) оксид, кальцій оксид, цинк оксид, плюмбум (ІІ) гідроксид, літій оксид. Класифікуйте їх за таблицею:
|
оксиди |
основи |
|||
|
основні |
кислотні |
амфотерні |
луги |
нерозчинні |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Заповнити схему хімічні властивості основ:
![]()
![]()
![]()
![]()
![]()

![]()

![]()
![]()

![]()
![]()
6. Тренувальні вправи.
І рівень.
1. Які сполуки утворюються при нагріванні нерозчинних основ
А. Сіль і вода. Б. Оксид і вода. В. Луг і вода. Г. Сіль і оксид.
2. Серед запропонованих хімічних сполук: НСІ, CO2, Fe(ОН) 3 , MgO, Cr(OH)2, Ca(OН)2,
AICI3, випишіть формули основ. Назвіть їх.
3. Поставте коефіцієнти у рівняннях реакцій:
А.. Pb(OН)2 + HCI →PbCI2 + H2O Б. AI(ОН)3 → АІ2О3 + Н2О
ІІ рівень.
1. Вкажіть дві схеми реакцій, які характеризують хімічні властивості нерозчинних
основ:
А. Fe(ОН)2 → . Б. AI(OH)3 + НСІ→ . В. NaOH + H3PO4 →. Г. KOH + SO3 → .
2. Допишіть продукти реакцій, поставте коефіцієнти:
А. Mg(OН)2 + HCI → Б. AICI3 + KOH →
В. Fe(OH)3 → Г. Zn(OH)2 →
3. Сульфатну кислоту кількістю 5 моль нейтралізували натрій гідроксидом.
Обчислити масу солі, що утворилася.
ІІІ рівень.
1. Поясніть, які зміни відбуваються, якщо до розчину купрум (ІІ) сульфату долити розчин калій гідроксиду, а до утвореної речовини – розчину хлоридної кислоти. Відповідь підтвердіть рівняннями реакцій.
2. Напишіть рівняння реакцій між речовинами поданими формулами: HNO3, KOH,
MgO, Fe(OH)3, H2SO4.
IV рівень.
1. Напишіть всі можливі рівняння реакцій між речовинами: сульфатна кислота,
ферум (ІІІ) оксид, калій гідроксид, барій оксид, нітратна кислота, натрій
гідроксид. Укажіть типи реакцій.
2. Здійсніть перетворення подані схемою: калій хлорат → кисень → цинк оксид → цинк хлорид → цинк гідроксид → цинк нітрат.
![]()
цинк оксид
Урок 53. Контроль знань з теми «Основні класи неорганічних сполук (І частина)»
(Завдання І рівня – 0.5б кожне, ІІ рівня – 1бал, ІІІ рівень – 2 бали, IVрівень – 2 бали)
В-1
І рівень.
1. Оксиди – це ...
а) здатність атомів сполучатися з Оксигеном;
б) сполуки, утворені двома елементами, одним із яких є Оксиген.
в) сполуки, утворені трьома елементами, одним з яких є Оксиген.
2. Основи поділяють на:
а) розчинні і нерозчинні ;
б) розчинні – луги і нерозчинні ;
в) розчинні – луги, малорозчинні і нерозчинні.
3. Запишіть загальну формулу основ, утворених одновалентними металічними
елементами.
4. Дайте хімічні назви оксидам: PbO, SO3, Na2O.
5. Запишіть формули гідроксидів хімічних елементів з порядковими номерами
4 і 56.
6. Запишіть хімічні формули оксидів елементів : Літію, Брому, Барію, Нітрогену(V).
ІІ рівень.
1.Класифікуйте формули перелічених оксидів: FeO, ZnO, K2O, P2O5, SO3, Al2O3 за схемою:
А.Основні_________________________;
Б. Кислотні________________________;
В. Амфотерні_______________________.
2. Установіть відповідність:
А.. MgO + HCI → 1. MgCI2 + H2O.
Б. AICI3 + KOH →. 2. Mg(ОН)2 + H2O
3. AI(OH)3 + KCI
3. На кальцій оксид подіяли нітратною кислотою, внаслідок чого утворився кальцій
нітрат масою 16,4 г. Яка маса кальцій оксиду прореагувала?
ІІІ рівень.
1. Вкажіть суму коефіцієнтів у рівнянні реакції: AICI3 + KOH → AI(OH)3 + KCI.
А. 6 Б. 5 В. 8 Г. 9
2. Здійсніть перетворення подані схемою:
![]() KCIO3→ O2 → ZnO → ZnCI2 → Zn(OH)2 → Zn(NO3)2
KCIO3→ O2 → ZnO → ZnCI2 → Zn(OH)2 → Zn(NO3)2
ІV рівень. ( Одне із завдань за вибором учня)
1.Напишіть всі можливі рівняння реакцій між речовинами: сульфатна кислота,
ферум (ІІІ) оксид, калій гідроксид, барій оксид, нітратна кислота.
2. Внаслідок реакції між барій гідроксидом та сульфатною кислотою, випав осад
масою 46,6 г. Які маси та кількості речовин реагентів узято? Скільки молекул
міститься в такій порції сульфатної кислоти?
В-2
І рівень.
1. Назва оксиду складається із двох слів:
а) назва елемента і слово «оксид» (для елементів зі сталою валентністю);
б) назва елемента (змінна валентність) і слово «оксид»;
в) слово «оксид» і назва елемента.
2. Виберіть визначення основ:
а) сполуки, які складаються із катіонів Гідрогену і гідроксид-аніонів;
б) сполуки, які складаються із катіонів металічного елемента і гідроксид-аніонів;
в) сполуки, які складаються із катіонів металічного елемента і аніонів кислотного
залишку
3. Запишіть загальну формулу основ, утворених двовалентними металічними
елементами.
4. Дайте хімічні назви оксидам: BaO, AI2O3, K2O.
5. Запишіть гідроксидів хімічних елементів з порядковими номерами
19 і 82.
6. Запишіть хімічні формули оксидів елементів : Натрію, Берилію, Сульфуру(VI), Хлору.
ІІ рівень.
1 Класифікуйте формули перелічених оксидів: BeO, ВаО, СrO3, CaO, P2O5, Fe2O3. за схемою:
А.Основні_________________________;
Б. Кислотні________________________;
В. Амфотерні_______________________.
2. Установіть відповідність:
А. KOH + HNO3 → 1. Na2CO3 + H2O.
Б. CO2 + NaOH → 2. КСІ + Н2О
3. KNO3 + H2O.
3. Ферум(ІІ) гідроксид кількістю речовини 0,25 моль нагріли. Яка маса ферум(ІІ)
оксиду утворилася?
ІІІ рівень.
1. Вкажіть суму коефіцієнтів у рівнянні реакції: НCI + KOH → KCI + Н2О.
А. 3 Б. 5 В. 4 Г. 9
2. Здійсніть перетворення подані схемою:
KNO3→ O2 → MgO → MgBr2 → Mg(OH)2 → Mg(NO3)2
ІV рівень. (Одне із завдань за вибором учня)
1. Напишіть всі можливі рівняння реакцій між речовинами: хлоридна кислота,
ферум(ІІІ) оксид, натрій гідроксид, барій оксид, нітратна кислота.
2. За дії нітратної кислоти на ферум(ІІ) гідроксид масою 28,8 г, утворилася сіль і
вода. Які маси та кількості речовин продуктів реакції? Яка маса нітратної кислоти
витратилась?
В-3
І рівень.
1.Оксиди класифікують на:
а) основні, кислотні, амфотерні;
б) несолетворні і солетворні, які в свою чергу поділяють на основні, кислотні і
амфотерні;
в) основні, кислотні і несолетворні.
2.Луги уворюють::
а) металічні елементи головної підгрупи І групи та барію;
б) металічні елементи головної підгрупи ІІ групи;
в) металічні елементи головної підгрупи І групи та ІІІ групи.
3. Запишіть загальну формулу основ, утворених трьоxвалентними металічними
елементами.
4. Дайте хімічні назви оксидам: CuO, P2O3, Li2O.
5. Запишіть гідроксидів хімічних елементів з порядковими номерами
3 і 29.
6. Запишіть хімічні формули оксидів елементів : Калію, Силіцію, Алюмінію,
Фосфору(ІІІ).
ІІ рівень.
1. Класифікуйте формули перелічених оксидів: B2O3, MgО, Сr2O3, PbO2 P2O5, FeO. за схемою:
А.Основні_________________________;
Б. Кислотні________________________;
В. Амфотерні_______________________.
2. Установіть відповідність:
А. Ва(OН)2 + HCI → 1. ВaСІ2 + H2O.
Б. Fe(OH)3 → 2. КСІ + Н2О
3. Fe2O3 + H2O.
3. На купрум (ІІ) оксид подіяли хлоридною кислотою, масою 142 г. Яка кількість
купрум (ІІ) оксиду прореагувала?
ІІІ рівень.
1. Вкажіть суму коефіцієнтів у рівнянні реакції: AI(OH)3 → AI2O3 + Н2О.
А. 6 Б. 4 В. 7 Г. 3
2. Здійсніть перетворення подані схемою:
K2MnO4→ O2 → Fe2O3 → Fe2(SO4)3 → Fe(OH)3 → FeCI3
ІV рівень. (Одне із завдань за вибором учня)
1. Напишіть всі можливі рівняння реакцій між речовинами: нітратна кислота,
хром (ІІІ) оксид, барій гідроксид, кальцій оксид, сульфатна кислота.
2. Через натрій гідроксид масою 16 г пропустили карбон (IV) оксид до повної
нейтралізації лугу. Яка маса та кількість речовини солі утворилася? Скільки
молекул міститься в такій порції солі?
В-4
І рівень.
1.Основні оксиди – це …:
а) оксиди металів;
б) оксиди неметалів;
в) оксиди металів з валентністю до пʼяти.
2 Малорозчинними є::
а) гідроксиди натрію, кальцію, стронцію;
б) гідроксиди магнію, алюмінію, стронцію ;
в) гідроксиди магнію, кальцію, стронцію.
3. Запишіть загальну формулу оксидів, утворених одновалентними металічними
елементами.
4. Дайте хімічні назви оксидам: MgO, CrO3, P2O5.
5. Запишіть гідроксидів хімічних елементів з порядковими номерами
12 і 19.
6. Запишіть хімічні формули оксидів елементів : Кальцію, Стануму, Хрому(ІІІ),
Карбону.
ІІ рівень.
1. Класифікуйте формули перелічених оксидів: Rb2O, SnO2, Na2O, P2O5, SO2, Al2O3 за схемою:
А.Основні_________________________;
Б. Кислотні________________________;
В. Амфотерні_______________________.
2. Установіть відповідність:
А. LiOH + H2 SO3 → 1. Na2CO3 + H2O.
Б. Zn(OH)2 → 2. ZnO + Н2О
3. Li2SO3 + H2O.
3. Розклали ферум (ІІІ) гідроксид масою 32,1 г. Яка кількість ферум (ІІІ) оксиду
утворилася?
ІІІ рівень.
1. Вкажіть суму коефіцієнтів у рівнянні реакції: AI(ОН)3 + KOH → КAIO2 + Н2О.
А. 6 Б.7 В. 5 Г. 4
2. Здійсніть перетворення подані схемою:
H2O2→ O2 → AI2O3→ AICI3 → AI(OH)3 → AI2O3
ІV рівень. (Одне із завдань за вибором учня)
1. Напишіть всі можливі рівняння реакцій між речовинами: сульфатна кислота,
магній оксид, калій гідроксид, барій оксид, нітратна кислота.
2. Внаслідок реакції між барій гідроксидом та ортофосфатною кислотою, випав осад
масою 60,1 г. Які маси та кількості речовин реагентів узято? Скільки молекул
міститься в такій порції ортофосфатної кислоти?
В-5
І рівень.
1.Кислотні оксиди – це …:
а) оксиди неметалів;
б) оксиди неметалів;
в) оксиди неметалів і оксиди металів з валентністю більше або рівне п’яти.
2.Оксиди, яким відповідають основи називають:
а) основні;
б) кислотні;
в) амфотерні.
3. Запишіть загальну формулу оксидів, утворених двовалентними металічними
елементами.
4. Дайте хімічні назви оксидам: ZnO, CO2, Cr2O3.
5. Запишіть гідроксидів хімічних елементів з порядковими номерами 11 і 20.
6. Запишіть хімічні формули оксидів елементів: Магнію, Бору, Хрому(VI), Цинку.
ІІ рівень.
1. Класифікуйте формули перелічених оксидів: BaO, ZnO, Li2O, N2O5, SO3, Al2O3 за схемою:
А.Основні_________________________;
Б. Кислотні________________________;
В. Амфотерні_______________________.
Випишіть назви простих і складних речовин з даного переліку:
глюкоза, хлор, натрій, магній оксид.
2. Установіть відповідність:
А. KOH + HNO3 → 1. Na2SO3 + H2O.
Б. SO2 + NaOH → 2. Na2SO4 + Н2О
3. KNO3 + H2O.
3. На магній оксид масою 240 г подіяли хлоридною кислотою. Яка кількість
речовини магній хлориду утворилася?
ІІІ рівень.
1. Вкажіть суму коефіцієнтів у рівнянні реакції: NaOH + H2SO4 → Na2SO4 + H2O.
А. 9 Б. 5 В. 8 Г. 6
2. Здійсніть перетворення подані схемою:
HgO→ O2 → CuO → Cu(NO3)2 → Cu(OH)2 → CuO
ІV рівень. (Одне із завдань за вибором учня)
1. Напишіть всі можливі рівняння реакцій між речовинами: хлоридна кислота,
цинк оксид, калій гідроксид, гідроген оксид, нітратна кислота.
2. Через натрій гідроксид масою 120 г пропустили сульфур(IV) оксид до повної
нейтралізації лугу. Яка маса та кількість речовини солі утворилася? Скільки
молекул міститься в такій порції солі?
В-6
І рівень.
1. Амфотерні оксиди утворюють:
а) метали: Алюміній, Цинк, Берилій, Ферум(ІІІ). Хром(ІІІ),
Плюмбум, Станум;
б) метали: Алюміній, Цинк, Барій, Ферум(ІІІ). Хром(ІІІ) ;
в) метали: Алюміній, Цинк, Берилій, Ферум(ІІІ). Натрій, Плюмбум.
2. Хімічна назва основи складається із:
а) назви металічного елемента і слова «оксид»;
б) назви неметалічного елемента і слова «гідроксид»;
в) назви металічного елемента і слова «гідроксид».
3. Запишіть загальну формулу оксидів, утворених трьохвалентними металічними
елементами.
4. Дайте хімічні назви оксидам: Fe2O3, SiO2, BeO.
5. Запишіть гідроксидів хімічних елементів з порядковими номерами
13 і 30.
6. Запишіть хімічні формули оксидів елементів : Купруму(І), Стронцію, Фосфору(V), Сульфуру(IV).
ІІ рівень.
1. Класифікуйте формули перелічених оксидів: BeO, ZnO, K2O, P2O5, Cs2O, CrO3 за схемою:
А.Основні_________________________;
Б. Кислотні________________________;
В. Амфотерні_______________________.
2. Установіть відповідність:
А. Cu(OH)2 + HNO3 → 1. CuCO3 + H2O.
Б. Pb(OH)2 → 2. PbO + Н2О
3. Cu(NO3)2 + H2O.
3. Натрій гідроксид масою 120 г прореагував з сульфатною кислотою. Яка кількість
сульфатної кислоти витратилась?
ІІІ рівень.
1. Вкажіть суму коефіцієнтів у рівнянні реакції: Cr(OH)3 + H2SO4 → Cr2(SO4)3 + H2O.
А. 10 Б. 5 В. 12 Г. 9
2. Здійсніть перетворення подані схемою:
NaNO3→ O2 → Cr2O3→ CrCI3 → Cr(OH)3 → Cr2O3
ІV рівень. (Одне із завдань за вибором учня)
1. Напишіть всі можливі рівняння реакцій між речовинами: хлоридна кислота,
ферум(ІІІ) оксид, літій гідроксид, барій оксид, нітратна кислота.
2. За дії нітратної кислоти на ферум(ІІІ) гідроксид масою 10,7 г, утворилася сіль і
вода. Які маси та кількості речовин продуктів реакції? Яка маса нітратної кислоти
витратилась?
Урок 54. Фізичні властивості кислот. Заходи безпеки під час роботи з кислотами. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції.
1. Вправа «Мікрофон»:
Яких правил ми повинні дотримуватися під час роботи з кислотами?
2. Гра «Вірю – не вірю»:
Вчитель читає твердження, учні дають одну з відповідей: «так» або «ні»
1.Більшість кислот – токсичні речовини.
2.Кислоти спричиняють серйозні отруєння.
3.Кислоти не викликають опіків шкіри.
4.Працювати з кислотами треба дуже обережно.
5.При потраплянні розчину кислоти на шкіру слід змити його проточною водою,
потім обробити розбавленим розчином оцту.
6. Якщо розчин кислоти потрапив на шкіру, слід змити його проточною водою,
потім обробити розбавленим розчином соди.
7. Для знешкодження залишків кислоти використовують розчин питної соди .
8. Для знешкодження залишків кислоти використовують розчин оцту.
3. Вставте пропущені слова, щоб вираз став завершеним:
1. Кислоти – складні речовини, до складу яких входить атом __________ і
_______________ залишок.
2. За кількістю атомів Гідрогену кислоти класифікують на _____, _____ і _____
основні.
3. За наявністю атомів Оксигену кислоти класифікують на ________ і ____________.
4. За хімічною активністю кислоти поділяють на ___________ і _________ .
5. HF, H2SO3, H3PO4, HNO2 – кислоти __________ сили.
6. Хімічні назви кислот складаються з ___________ слів.
7. Корінь першого слова походить від назви __________, що утворює ___________ .
8. Перше слово назви безоксигенової кислоти має суфікс «___» або «___».
9. Якщо кислотворний елемент виявляє у сполуці найвищу валентність, то
використовують суфікс «____» .
10. Якщо кислотворний елемент виявляє у сполуці нижчу валентність, то
використовують суфікс «____» або «____» .
11. Кількість атомів Гідрогену визначають за _______________ кислотного залишку.
4. Хімічний ланцюжок.
а) А. Складіть формули кислот, які відповідають запропонованим оксидам.
Б. Встановіть послідовний ланцюжок зростання валентності кислотного залишку.
![]()
![]()
![]()
б) А. Складіть формули кислот, які відповідають запропонованим оксидам.
Б. Встановіть послідовний ланцюжок зростання кількості всіх атомів у молекулі
кислоти.
![]()
![]()
![]()
![]()
5. Робота зі схемою «Фізичні властивості кислот»
6. Використовуючи підручник, заповніть таблицю:
|
№з/п |
Фізичні властивості |
Характерні ознаки / кислоти |
|
1. |
Агрегатний стан: |
|
|
|
рідкий |
|
|
|
леткий |
|
|
|
твердий |
|
|
2. |
Температури плавлення |
|
|
3. |
Розчинність у воді |
|
|
4. |
Густина ( відносно води) |
|
|
5. |
Електропровідність |
|
|
|
|
|
7. Розрахункові задачі: 5. Розрахунки за хімічними рівняннями маси,
об’єму, кількості речовини реагентів та продуктів реакції.
І рівень.
1. Яка кількість речовини купрум(ІІ) гідроксиду вступає в реакцію із нітратною
кислотою масою 25,2 г ?
2. Водень об’ємом 11,2 л (н. у.) прореагував з хлором. Яка кількість речовини хлору
прореагувала?
3. На арґентум нітрат масою 340 г подіяли хлоридною кислотою. Яку маса солі
випала в осад?
4. Який об’єм сульфур (IV) оксиду (н. у.) розчинили у воді, якщо утворилася кислота
масою 164 г?
5. Для нейтралізації барій гідроксиду масою 17,1 г використали нітратну кислоту.
Яка маса кислоти прореагувала?
ІІ рівень.
1. На порошок магнію подіяли розчином сульфатної кислоти, внаслідок реакції
утворилася сіль кількістю речовини 1.5 моль. Які маси речовин прореагували?
2. Карбон (IV) оксид прореагував з натрій гідроксидом кількістю речовини 2,5 моль.
Обчислити об’єм карбон(IV) оксиду (н. у.), що прореагував, і масу натрій
гідроксиду, яка була використана ?
3. На купрум(ІІ) хлорид кількістю речовини 0,5 моль подіяли калій гідроксидом. Які
маси речовин утворилися в результаті реакції?
4. Яку кількість речовини водню потрібно використати на реакцію з бромом
масою 320 г. Якій масі це відповідає? Який об’єм бромоводню (н. у.) утвориться?
5. На барій гідроксид масою 51,3 г подіяли хлоридною кислотою. Яка маса та
кількість речовини хлоридної кислоти прореагувала?
ІІІ рівень.
1. Через розчин кальцій гідроксиду пропустили карбон (IV) оксид об’ємом 112 л до
утворення середньої солі. Сіль, що випала в осад, відфільтрували і розчинили в
хлоридній кислоті. Яка маса хлоридної кислоти витратилася? Якій кількості
речовини відповідає така маса кислоти?
2. Сульфур(VІ) оксид масою 160 г пропустили через воду. Яку масу ферум(ІІ)
гідроксиду можна розчинити в утвореній кислоті? Якій кількості речовини
відповідає така маса ферум(ІІ) гідроксиду?
3. Фосфор(V) оксид масою 14,2 г розчинили у воді. Яка маса натрій гідроксиду
може вступити у реакцію з утвореною кислотою? Якій кількості речовини
відповідає така маса?
4. Силікатну кислоту добули при взаємодії натрій силікату масою 122 г з хлоридною
кислотою. Осад, який утворився, нагріли. Яка маса утвореного силіцій(IV) оксиду?
5. Спалили метан кількістю 1,8 моль, карбон (IV) оксид, що утворився при цьому,
пропустили через розчин калій гідроксиду. Яка маса солі утвориться? Якій
кількості речовини відповідає така маса?
ІV рівень.
1. На суміш порошків цинку та цинк оксиду масою 40 г подіяли надлишком
сульфатної кислоти. Виділився газ об’ємом 11,2 л. Які маси речовин у суміші?
2. В якому випадку виділиться більше газу і у скільки разів: при дії сульфатної
кислоти на цинк масою 65 г чи на магній кількістю речовини 1,5 моль?
3. На ферум(ІІІ) гідроксид подіяли хлоридною кислотою кількістю 5 моль.
Обчисліть, яка кількість речовини та маса ферум(ІІІ) гідроксиду прореагувала? Яке
число молекул в отриманій порції ферум(ІІІ) гідроксиду?
4. Суміш порошків цинку з міддю масою 64,1 г обробили розчином сульфатної
кислоти, взятої у надлишку. Виділився газ об’ємом 8,96 л. Які масові частки
металів у суміші?
5. Кальцій оксид розчинили у воді кількістю 4,5 моль. Кальцій гідроксид, що при
цьому утворився, пропустили через розчин хлоридної кислоти. Обчислити
кількість речовини та масу утвореної солі. Яке число молекул відповідає такій
кількості солі?
Урок 55. Хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами, солями.
1. Опорний конспект до уроку.
Хімічні властивості кислот:
![]()
![]() + Ме (до Н2 ) Ме кисл.зал. + Н2
+ Ме (до Н2 ) Ме кисл.зал. + Н2
(виняток НNO3) (сіль)
![]() + Ме О Ме кисл.зал. + Н2О
+ Ме О Ме кисл.зал. + Н2О
(основний оксид) (сіль)
+ Ме ОН (основа) Ме кисл.зал. + Н2О
![]() (реакція нейтралі- (сіль)
(реакція нейтралі- (сіль)
Н кисл.зал. зації )
(кислота)
![]() + Ме кисл.зал. Ме кисл.зал. + Н кисл. зал.
+ Ме кисл.зал. Ме кисл.зал. + Н кисл. зал.
(сіль) (ін. сіль) (ін.. кислота)
розкладання при t0 Нем. О + Н2О
![]() (кисл. оксид)
(кисл. оксид)
![]() + індикатор: лакмус з фіолетового на червоний
+ індикатор: лакмус з фіолетового на червоний
![]() метилоранж з оранжевого на рожевий
метилоранж з оранжевого на рожевий
2. «Хрестики – нулики»
Виграшний шлях: оксигеновмісні кислоти.
|
НCI |
H2CO3 |
Н2S |
|
H3PO4 |
HNO3 |
H2SO4 |
|
HBr |
HI |
H2SiO3 |
Виграшний шлях: сульфуровмісні кислоти.
|
Н2S |
HF |
H2CO3 |
|
H3PO4 |
H2SO3 |
HI |
|
НCI |
HNO3
|
H2SO4 |
3. Хімічний ланцюжок.
А. Складіть формули кислот, які відповідають запропонованим оксидам.
Б. Встановіть послідовний ланцюжок зростання їхніх молекулярних мас.
![]()
![]()
![]()
![]() І варіант.
І варіант.
ІІ варіант.
![]()
![]()
![]()
![]()
4. Напишіть рівняння реакцій, які відбуваються між сульфатною кислотою і
запропонованими у схемі речовинами.
![]()
![]()
![]()
 АІ
АІ
+ +
![]()
![]()
![]()
![]()
 Fe + +
Fe + +
![]()
![]() + H2SO4 +
+ H2SO4 +
![]()
![]()
![]() KOH
KOH
![]() + +
+ +
![]()
![]()


![]()
LiOH
+ + +
![]()
![]()
![]()
5. Напишіть рівняння реакцій, які відбуваються між хлоридною кислотою і
запропонованими у схемі речовинами.
![]()
![]()
![]()
 Mg
Mg
+ +
![]()
![]()
![]()
![]()
 Fe2O3 + +
Fe2O3 + +
![]()
![]() + HCI +
+ HCI +
![]()
![]()
![]() CsOH
CsOH
![]() + +
+ +
![]()
![]()


![]()
Li2O
+ + +
![]()
![]()
![]()
6. Заповнити схему «Хімічні властивості кислот»:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
7. Тренувальні вправи.
І рівень.
1. Вкажіть пару речовин, які вступають у хімічну взаємодію з ортофосфатною
кислотою:
А. FeCI3 , H2O Б. AICI3 . CO2, . В. CaO, HCI Г. MgO, Cr(OH)2. .
2. Позначте реакцію взаємодії хлоридної кислоти з магній оксидом:
А. CO2 + 2NaOH →Na2CO3 + H2O. Б. AICI3 + 3KOH → AI(OH)3 + 3KCI.
В. KOH + HNO3 → KNO3 + H2O. Г. MgO + 2HCI → MgCI2 + H2O.
3. Як зміниться колір метилоранжу у розчині нітратної кислоти:
А. Жовтий. Б. Рожевий. В. Червоний. Г. Синій.
ІІ рівень.
1. Вкажіть дві схеми реакцій, які характеризують хімічні властивості кислот:
А. FeО + НСІ → . Б. AI(OH)3 → . В. NaOH + H3PO4 →. Г. KOH + SO2 → .
2. Допишіть продукти реакцій, поставте коефіцієнти:
А.. MgO + HCI → Б. KOH + H3PO4 →
В. K2О + HNO3 → Г. LiOH + H2SO4→
3. На алюміній оксид кількістю речовини 1,5 моль подіяли надлишком розчину сульфатної кислоти. Яка маса та кількість речовини сульфатної кислоти прореагували.
ІІІ рівень.
1. Допишіть рівняння реакції та вкажіть суму коефіцієнтів у рівнянні реакції:
AI(OH)3 + H2SO4 →.
А. 8 Б. 11 В. 12 Г. 9
2. Напишіть рівняння реакцій між речовинами поданими формулами: H3PO4, NaOH,
BaO, Fe, HNO3.
IV рівень.
1. Напишіть всі можливі рівняння реакцій між речовинами: хлоридна кислота, вода,
цинк, сульфур(VІ) оксид, алюміній гідроксид, кальцій, сульфатна кислота, натрій
гідроксид. Укажіть типи реакцій.
2. Здійсніть перетворення подані схемою:
А. Барій → барій оксид → барій гідроксид → барій хлорид.
Б. Ферум → ферум(ІІІ) оксид → ферум (ІІІ) сульфат → ферум (ІІІ) гідроксид →
ферум(ІІІ) оксид → ферум(ІІІ) нітрат.
В. Азот → нітроген (ІІ) оксид → нітроген (І ) оксид → нітратна кислота → кальцій
нітрат.
3. Внаслідок реакції достатньої кількості хлоридної кислоти із сумішшю порошків
срібла і цинку масою 10 г виділилось 0,7 л водню (н.у.). Обчисліть масову
частку срібла у суміші.
Урок 56. Ряд активності металів. Реакції заміщення й обміну
1. Повторення: «Мікрофон»
Запитання:
- Яка кислота і де виробляється нашим організмом? (хлоридна кислота, в шлунку).
- Які кислоти ми використовуємо в їжі? (органічні: щавлева, оцтова, яблучна, лимонна).
- Яку кислоту ми п’ємо разом з газованими напоями? (карбонатну кислоту).
- Якою кислотою ми лікуємось, понижуючи температуру тіла? (ацетилсаліциловою, аспірин).
- Яку кислоту ми використовуємо як вітамін? (аскорбінову).
- У три склянки з безбарвними розчинами, вносимо в кожний індикаторний папірець. Спостерігаємо: у І склянці папірець став рожевим, в ІІ – синій, в ІІІ - забарвлення папірця не змінилося. Висновок: І - кислота; ІІ - луг; ІІІ - сіль.
- Які речовини викликають хімічні опіки? Як від них захиститись? (кислоти та луги, індивідуальні засоби захисту: окуляри, гумові рукавички, фартух, халат).
- Яка реакція відбувається в склянці (луг + фенолфталеїн = малинове забарвлення, потім +кислота = забарвлення зникає). Реакція нейтралізації.
- Між якими класами речовин відбувається ця реакція? (сода + кислота = газ) реакція між сіллю нестійкої кислоти та сильною кислотою. Виділився вуглекислий газ.
- Коли вдома ми використовуємо цю реакцію? Коли знімаємо накип в чайнику, або коли гасимо соду оцтом.
- Який тип реакції? Між якими речовинами вона проходить? (купрум(ІІ)хлорид + луг = нерозчинна речовин голубого кольору).
Реакція обміну між сіллю та лугом, з утворенням нерозчинної основи.
2. Виправ помилки у правилах техніки безпеки при роботі з кислотами
1. Кислоти - не їдкі речовини, тому поводитися з ними слід безпечно.
2. Не читайте етикетки на склянках
3. Речовини для дослідів беріть не більше 10- 20 мл. (наливайте багато!)
4. Залишайте склянки з кислотами відкритими.
5. Виливайте залишки реактивів з пробірки назад у склянку, з якої він був узятий
6. Якщо випадково кислота потрапила на руки чи на одяг - негайно змийте її великою кількістю іншої кислоти, нейтралізуйте розчином соди і знову змийте водою
7. Якщо потрібно розбавити сульфатну кислоту, потрібно доливати воду до кислоти.
3. Хімічні вправи:
1. Про що свідчить зміна забарвлення чайної заварки при додавання до чаю лимона?
2. Випишіть із запропонованих формул кислоти:
HCl, KOH, CaO, ZnO, SO3, HI, NaOH, H2SO4, H2O, MnO, H3PO4, AlCl3, HMnO4,
3. Складіть рівняння хімічної реакції за схемою:
а) Cl2 → HCl → MgCl2
б) P→ P2O5 → H3PO4 → Zn3(PO4)2
4. В атмосфері далекої планети була виявлена речовина, яка містить елементи: Гідроген та Хлор в масових частках 2,8% та 97,2% відповідно. Визнач хімічну формулу речовини. Дай поради мандрівникам, які збираються в подорож на цю планету щодо одягу, засобів пересування, знаряддя.
Урок 57. Фізичні властивості середніх солей. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції.
1. З наведеному переліку випишіть окремо у чотири стовпчики формули оксидів, кислот, основ та солей:
NaOH, HCL, CaBr2, H2SO4, Ca(OH)2, CuO, H3PO4, H2S, ZnO, Fe(OH)3, K2SO4, SO3, Cl2O7, Mg(OH)2, SiO2, H2SiO3, CaO, CO2, H2SO4.
2. Самостійна робота на карточках
І варіант
1. Яку з речовин можна виявити, користуючись розчином лакмусу фіолетового:
а) натрій хлорид;
б)натрій нітрат;
в)нітратну кислоту.
2. Що таке витискувальний ряд металів?
3. Напишіть рівняння та тип реакцій:
А) Al+H2SO4= ;
Б)ZnO+HNO3= ;
В)Cu+HCl= ;
Г)H2S+NaOH= .
4. У дві пробірки насипте на дно порошки магнію і заліза. Долийте розчин хлоридної кислоти однакової концентрації. Порівняйте перебіг реакцій. Зробіть висновок.
5. Напишіть рівняння реакцій, що лежать в основі схеми:
H2O2→A→SO2 →SO3→H2SO4→CuSO4
↓
Al2(SO4)3 Назвіть речовину А.
ІІ варіант
1.Які продукти реакції взаємодії сульфатної кислоти з натрій гідроксидом.
2. Сформулюйте визначення реакцій заміщення.
3. Напишіть рівняння та тип реакцій:
А) MgO+HCl= ;
Б) H3PO4+KOH= ;
В) Zn+ H2SO4 = ;
Г) Ag+HCl= .
4. Магній кількістю речовини 0,6 моль повністю прореагував з розчином сульфатної кислоти. Який об'єм водню виділився?
5. Напишіть рівняння реакцій, що лежать в основі схеми:
KMnO4→A→P2O5→ H3PO4→Na3PO4
↓
HPO3 →Ca(PO3)2 Назвіть речовину А.
3. Тестовий контроль:
- До складу кислот завжди входить:
а) атоми Гідрогену; б) атоми Оксигену;
в) молекули водню; г) атоми Сульфуру.
- Формула магній хлориду:
а) MgCl2; б) MgO;
в) Mg(OH)2; г) MgO2.
- Найпоширеніший оксид у природі:
а) Fe2O3; б) Al2O3;
в) CaO; г) H2O.
- Вкажіть розчинну у воді сіль:
а) аргентум хлорид; б) барій сульфат;
в) кальцій нітрат; г) купрум сульфід.
- Знайдіть відповідність між назвою речовини та її формулою:
а) берилій гідроксид; 1) MnO2
б) ортосилікатна кислота; 2) Be(OH)2
в) манган (ІV) оксид; 3) KHSO3
г) калій гідрогенсульфіт. 4) H4SiO4
4. Знайди помилку:
- Ряд активності склав М. М. Бекетов.
- Унаслідок взаємодії Купруму з хлоридною кислотою виділяється водень.
- Метали, які розташовані ліворуч від водню в ряді активності металів, не витискують Гідроген із молекул кислот.
- Реакція взаємодії магнію з хлоридною кислотою є реакцією обміну.
- Метали, які розміщені праворуч від водню, не витискують Гідроген із кислот.
- Аурум не витісняє Гідроген із кислот, бо розмішений праворуч від водню в ряді активності металів.
- Метали, розташовані ліворуч від водню у витискувальному ряді, витискують Гідроген із молекул кислот.
- Нітратна кислота не реагує з Купрумом.
- Калій витискує Гідроген із молекул води.
Урок 58. Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями.
1. Написати можливі реакції взаємодії даної солі з речовинами:
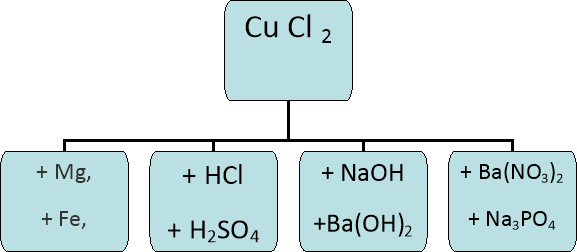
- Самостійна п’ятихвилинка:
1 варіант
- Складіть рівняння за схемою:
Fe → Fe2O3 → FeCl3 → Fe(OH)3 → Fe2(SO4)3→ Fe
2. В реакцію з алюмінієм вступив кисень об’ємом 4,48л (н.у.). Визначити масу алюмінію, що вступила в реакцію та кількість речовини алюміній оксиду, який утворився.
2 варіант
- Складіть рівняння за схемою:
Mg → Mg O → MgBr2 → Mg(OH)2 → MgSO4 → Mg
2. Обчисліть об’єм водню, який виділиться під час розчинення алюмінію масою 10,8 г в надлишку хлоридної кислоти (н. у.).
3 варіант
1. Записати рівняння реакцій таких перетворень:
Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu
2. Обчисліть кількість речовини води, що виділиться внаслідок термічного розкладання купрум(ІІ) гідроксиду масою 9,8 г.
Урок 59. Поняття про амфотерні гідроксиди.
1. Вправи та завдання:
1. З якими із речовин реагуватиме ферум(ІІ) хлорид: кальцій карбонат, натрій гідроксид, аргентум нітрат, цинк, вода? Написати рівняння реакцій
2. Який об’єм водню виділиться при взаємодії 10 г металу з кислотою? Яка кількість речовини солі при цьому утвориться?
|
|
НСІ |
H2SO4 |
H2SO3 |
H3PO4 |
|
Mg |
1 |
2 |
3 |
4 |
|
Zn |
5 |
6 |
7 |
8 |
|
Al |
9 |
10 |
11 |
12 |
|
Fe (II) |
13 |
14 |
15 |
16 |
|
Pb (II) |
17 |
18 |
19 |
20 |
Варіанти завдань, що виділені червоним кольором – складніші.
- Хімічне лото. Перед вами в будь-якому порядку зашифровані хімічні терміни. Знайдіть їх, будь ласка, дайте їм визначення, наведіть приклад.
|
0 |
С |
Н |
0 |
В |
И |
Ю |
М |
X |
Ж |
І |
К |
|
Ф |
К |
И |
С |
Л |
0 |
Т |
И |
Я |
Ю |
Ь |
А |
|
0 |
І |
С |
О |
Л |
І |
П |
Р |
Є |
Ї |
3 |
Т |
|
Р |
Т |
А |
И |
І |
Л |
О |
С |
Б |
Я |
Ю |
А |
|
И |
І |
Г |
И |
Д |
У |
0 |
А |
Ф |
В |
П |
Л |
|
М |
К |
Л |
Д |
Н |
И |
А |
Б |
В |
0 |
З |
І |
|
О |
Ї |
Й |
X |
І |
М |
І |
Я |
0 |
А |
0 |
3 |
|
Л |
У |
Б |
X |
Д |
Ф |
0 |
Р |
М |
У |
Л |
А |
|
Ь |
0 |
В |
Г |
Ж |
3 |
Й |
И |
X |
Р |
0 |
Т |
Відповідь:
Хімічне лото
|
0 |
С |
Н |
0 |
В |
И |
Ю |
М |
X |
Ж |
І |
К |
|
Ф |
К |
И |
С |
Л |
0 |
Т |
И |
Я |
Ю |
Ь |
А |
|
0 |
І |
С |
О |
Л |
І |
П |
Р |
Є |
Ї |
3 |
Т |
|
Р |
Т |
А |
И |
І |
Л |
О |
С |
Б |
Я |
Ю |
А |
|
И |
І |
Г |
И |
Д |
У |
0 |
А |
Ф |
В |
П |
Л |
|
М |
К |
Л |
Д |
Н |
И |
А |
Б |
В |
0 |
З |
І |
|
О |
Ї |
Й |
X |
І |
М |
І |
Я |
0 |
А |
0 |
3 |
|
Л |
У |
Б |
X |
Д |
Ф |
0 |
Р |
М |
У |
Л |
А |
|
Ь |
0 |
В |
Г |
Ж |
3 |
Й |
И |
X |
Р |
0 |
Т |
3. Вправи на закріплення знань:
1. У чому полягає суть амфотерності? Поясни на конкретному прикладі.
2. Як здійснити такі перетворення:
Zn → ZnO → Zn(N03)2 → Zn(OH)2 → Na2Zn02?
Напиши відповідні рівняння реакцій і зазнач назви продуктів реакції.
3. Для добування цинк гідроксиду можна використати реакцію, що відбувається за схемою
ZnO + Н20 =
ZnCl2 + NaOH =
нестача
ZnCl2 + NaOH =
надлишок
ZnO + NaOH =
розчин
4*. На сплавляння берилій гідроксиду з лугом витрачено калій гідроксид масою 28 г. Кількість речовини калій берилату, що утворився при цьому, становить
а) 1 моль; б) 0,5 моль; в) 0,25 моль; г) 0,125 моль.
Урок 60. Практична робота №1. Дослідження властивостей основних класів неорганічних сполук.
- Вправи:
«Так чи ні»
- К2О – основа.
- В даному переліку оксидів немає: KOH, CuSO4, CaO, NaCl, Mg, Mn(NO3)2.
- Валентність кислотного залишку визначається по числу атомів Гідрогену в кислоті.
- В даному переліку переважають безоксигенові кислоти: HNO3, HCl, H3PO4, H2CO3, H2S, HF.
- H2S – формула сульфітної кислоти.
- Сu(NO3)2 – сіль, яка має назву купрум (ІІ) нітрат.
- Основи – складні речовини, у яких атом металічного елемента з’єднаний з кислотним залишком.
- NaOH – розчинна основа (луг).
- Кислотні оксиди – це оксиди, яким відповідають кислоти.
- Кислоти – складні речовини, які містять один або декілька атомів Гідрогену і кислотний залишок.
- В даному переліку переважають солі: BaSO4, CuCl2, NaOH, MgO, H3PO4, Al2(SO4)3.
- NaCl – усім відома кухонна сіль.
«Вірна відповідь одна»
- Позначте формулу лугу: а) КСІ; б) Ва(ОН)2; в) СаО; г) Cu(OH)2.
- Позначте формулу оксиду: а) СН4; б) H2CO3; в) СО2; г) СаСО3.
- Позначте формулу солі: а) К2СО3; б) КОН; в) ВаО; г) H3BO3.
- Речовина НРО3 належить до: а) оксидів; б) основ; в) кислот; г) солей.
- Речовина H2S має назву: а) сульфітна кислота; б) сульфатна кислота; в) сульфурна кислота; г) сульфідна кислота.
- Позначте формулу гідроксиду, який відповідає калій оксиду:
а) CaCO3; б) Ca(OH)2; в) CaOH; г) КОН.
- Назва речовини, що має формулу NO2: а) нітроген оксид; б) нітроген (ІІ) оксид; в) нітроген (ІV) оксид; г) нітроген (І) оксид.
- Формула калій сульфату: а) СаСО3; б) К2СО3; в) СаSO4; г) K2SO4.
2 варіант
«Так чи ні»
- Оксиди – складні речовини, утворені двома елементами, одним з яких обов’язково є Оксиген.
- В даному переліку переважають оксиди: NaOH, Na2O, NaNO3, N2O5, HNO3, Al(NO3)3.
- Основи – складні речовини у яких атом неметалічного елемента з’єднується з однією або кількома гідроксильними групами (ОН).
- В даному переліку переважають кислоти: HNO3, KOH, HCl, K3PO4, Ca(OH)2, H3PO4.
- H2SO4 – формула сульфатної кислоти.
- СаСО3 – сіль, що має назву кальцій карбонат.
- Основні оксиди – це оксиди, яким відповідають основи.
- СаО – калій оксид.
- SО2 – сульфур (ІV) оксид.
- Кислоти – складні речовини, які містять один або декілька атомів металів, здатних заміщувати атоми Гідрогену та кислотний залишок.
- АІ2О3 – основа.
- Солі – складні речовини, які складаються з атомів металічного елемента та кислотного залишку.
«Вірна відповідь одна»
- Позначте формулу оксиду: а) HNO3; б) NaOH; в) K2CO3; г) CuO.
- Позначте формулу лугу: а) Zn(OH)2; б) Fe(OH)2; в) Ba(OH)2; г) CaO.
- Позначте формулу кислоти: a) Н2SO3; б) MgO; в) K2O; г)H2O.
- Оксиду SO3 відповідає кислота: а) H2S; б) H2SO3 в) H2CO3; г) H2SO4.
- K2О належить до класу: а) оксидів; б) основ; в) кислот; г) солей.
- Речовина FeSO4 має назву: а) ферум (ІІ) сульфід; б) ферум (ІІ) сульфіт; в) ферум (ІІ) сульфат; г) ферум (ІІ) силікат.
- Оксиду СаО відповідає гідроксид: а) СаСО3; б) Са(ОН)2; в) СаОН; г) CaS.
- Речовина СО2 має назву: а) карбон (ІІ) оксид; б) карбон (ІV) оксид; в) карбонатна кислота; г) карбонова кислота.
Урок 61. Загальні способи добування оксидів, кислот.
- Завдання «Кислотно-основні взаємодії»
|
Варіант 1 |
Варіант 2 |
Варіант 3 |
|
AI(OH)3 + HCI = NaOH + H3PO4 = KOH + CO2 = LiOH + HCI = Mg(OH)2 + HNO3 = NaOH + SiO2= |
NaOH + P2O5 = Ca(OH)2 + HNO3 = Pb(OH)2 + HCI = Sr(OH)2 + H2SO4 = Fe(OH)2 = FeO+ HBr = |
Ba(OH)2 + H2SO4 = KOH + H3PO4 = Mg(OH)2 + HCI = Cr2О3 + H2SО4 = CaO + HCI = KOH + SO3=
|
|
Варіант 4 |
Варіант 5 |
|
|
Fe2О3 + HCI = SnO + HF = FeO + HCI = Fe2О3 + H2SО4 = PbO + HNО3 = KOH + SiO2 = |
Li2О + H3PО4 = CuO + H2SО4 = Cr2О3 + HCI = Fe2О3 + HNО3 = ZnO + H3PО4 Sr(OH)2 + HNO3 = |
2. Гра „Хто більше”
З хімічних елементів К, S, О, Н, С, Р, Аl, Zn, Cl, Са складіть усі можливі формули складних речовин і назвіть їх.
3. «Бліц - турнір»
Гравці кожної команди по черзі відповідають на запитання вчителя. Закінчіть фразу.
- Оксиди класифікуються на кислотні, амфотерні й... (Основні)
- Складна речовина, що складається з атомів металу й кислотного залишку, — ... (Сіль)
- Кислотні оксиди не взаємодіють з... (Кислотами)
- Реакція взаємодії між кислотами й основами називається... (Нейтралізація)
- За кількістю атомів Гідрогену кислоти поділяються на... (Одно-, дво-, триосновні)
- У лужному середовищі фенолфталеїн набуває кольору... (Малинового)
- Складні речовини, що складаються з атомів металу й Оксигену, називаються... (Оксидами)
- У результаті взаємодії кислотного й основного оксидів утворюється... (Сіль)
- Розчинні у воді основи називаються... (Лугами)
- Основні оксиди не взаємодіють з... (Основами)
- За вмістом Оксигену кислоти поділяються на безоксигенові й... (Оксигеновмісні)
- Складні речовини, що складаються з атомів металу й однієї або кількох гідроксильних груп, називаються... (Основами)
- Унаслідок розчинення кислотних оксидів у воді утворюється... (Кислота)
- Нерозчинні основи внаслідок нагрівання розкладаються на... (Оксиди й воду)
- Метиловий оранжевий набуває червоного кольору в середовищі... (Кислому)
- Унаслідок розчинення основних оксидів у воді утворюється... (Основа)
- Хімічні реакції, з допомогою яких можна визначити речовини, називаються.;. (Якісними реакціями)
- Гідроксиди, що взаємодіють і з кислотами, і з основами, називаються... (Амфотерними)
Урок 62. Загальні способи добування основ і середніх солей.
1. Вправа „Продовж речення”
1) Основи - це складні речовини…
2) Основи ще називають…
3) За кислотністю основи класифікують…
4) Наприклад…
5) За розчинністю їх поділяють…
6) Розчинні основи ще називають…
2. Здійснити перетворення:
![]()
![]()
![]()
![]() СаО Са(ОН)2 СаSO4 H2SO4 СаSO4
СаО Са(ОН)2 СаSO4 H2SO4 СаSO4
CaO + H2O = Ca(OH)2
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
SO3 + H2O = H2SO4
H2SO4 + Са(ОН)2 = СаSO4 + H2O
3. Фронтальна робота (розв'язати задачі):
1)Дано:
m(BaO) = 306г
H2O
Знайти:
m (Ва(ОН)2)?
2)Дано:
m (Mg)=48г
O2
Знайти:
V(O2)?
3) Дано:
m(BaO)=48г
H2O
Знайти
m (BaOH)2?
4. Конкурс „ Чи знаєте ви терміни?" Групова робота (команди)
Якщо відповідь неправильна, відповідають учні інших груп (команд).
Команда 1
- Які класи складних неорганічних сполук вам відомі?
- Дайте визначення оксидів.
- Формула їдкого калі.
- Які типи хімічних реакцій вам відомі.
- Дайте визначення кислот і розкажіть про їх класифікацію.
Команда 2
- Як класифікують оксиди?
- Який оксид є найпоширенішим у природі?
- Що таке луги?
- Які типи хімічних реакцій вам відомі?
- Дайте назви кислотним залишкам за таблицею розчинності.
Команда З
- Дайте визначення солям.
- Які сполуки називають основами?
- Як класифікують основи?
- Які ви знаєте індикатори?
- Опишіть фізичні властивості солей.
5. «Морський бій»
Дайте назви відповідним речовинам.
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
А |
NaOH |
K2CO3 |
FeSO4 |
H2SO4 |
Ca(NO3)2 |
Na2SO4 |
|
Б |
NaNO3 |
CaO |
K2SiO3 |
Al2O3 |
CaCO3 |
KOH |
|
В |
AlCl3 |
CaBr2 |
P2O3 |
Fe(NO3)3 |
CaS |
HNO3 |
|
Г |
KCl |
K2SO3 |
HBr |
Na2S |
P2O5 |
AgNO3 |
|
Д |
H3PO4 |
HCl |
Al(NO3)3 |
H2SiO3 |
FeO |
H2SO3 |
Урок 63, 64, 65. Генетичні зв’язки між класами неорганічних сполук.
- Самостійна робота
І варіант
І рівень
Обрати одну вірну відповідь (кожна вірна відповідь – 0,5 б.)
1. Укажіть, яким стане колір індикатора лакмусу у кислому середовищі:
А) синій Б) жовтий В) фіолетовий Г) червоний
2. Укажіть формулу амфотерного гідроксиду:
А) NaOH Б) Си(ОН)2 В) Zn(ОН)2 Г) LiОН
3.Укажіть формулу основного оксиду:
А) FeО Б) V2О5 В) Сl2О7 Г) N2О5
4. Укажіть формулу хлоридної кислоти:
А) Н2S Б) НСl В) НNO3 Г) НСlО4
5. Укажіть ряд сполук, в якому є лише солі:
А) KPO3, NaCl, СаSO3 Б) Na3РО4, MgO, LiОН В) Zn(ОН), FeО, NaCl
6. Укажіть метал, який не взаємодіє з хлоридною кислотою:
А) Zn Б) Fe В) Си Г) Аl.
ІІ рівень
Обрати вірну відповідь (кожна вірна відповідь – 1 б.)
7. Складіть формули таких речовин:
А) Магній оксид, Б) Натрій сульфат, В) Купрум (ІІ) гіроксид, Г) Нітратна кислота.
8. Молярна маса сульфур (ІV) оксиду дорівнює:
А) 64 Б) 48 В) 32 Г) 24
9. Дописати рівняння та визначити тип реакцій:
1) Са+Н2SO4→ 2)ЅО3 + Νа2О →.
ІІІ рівень
Завдання 10 має кілька правильних відповідей (1б).
10. Укажіть речовини, з якими може взаємодіяти ŚO3
А Н2О Б ŚO2 В КОН Г НСl
11. Установіть відповідність між назвою й формулою сполуки (1б):
А) Кобальт (ІІ) бромід 1. Со(ОН)3
Б) Кобальт (ІІІ) оксид 2. СоВr2
В) Кобальт (ІІІ) гідроксид 3. Со2О3
Г) Кобальт (ІІ) ортофосфат 4. Со3(РО4)2
5. Со(РО4)2
12. Розв`язати задачу (1б)
Укажіть кількість речовини водню, який виділиться під час взаємодії ортофосфатної кислоти з цинком кількістю речовини 0,2 моль.
ІV рівень
13. Розв`язати задачу (1б)
Яка маса алюмінію вступить у реакцію з хлоридною кислотою, якщо при цьому виділилось 2,24 л водню за н.у.
14. Здійснити перетворення. (2б)
Аl → Аl2O3 → Аl(ОН)3 → АlСl3
↓
КАlO2
ІІ варіант
І рівень
Обрати одну вірну відповідь (кожна вірна відповідь – 0,5 б.)
1. Укажіть, яким стане колір індикатора лакмусу лужному середовищі:
А) синій Б) жовтий В) фіолетовий Г) червоний
2. Укажіть формулу амфотерного гідроксиду:
А) NaOH Б) Си(ОН)2 В) Аl (ОН)3 Г) LiОН
3.Укажіть формулу основного оксиду:
А) СаО Б) V2О5 В) Сl2О7 Г) N2О5
4. Укажіть формулу нітратної кислоти:
А) Н2S Б) НСl В) НNO3 Г) НСlО4
5. Укажіть ряд сполук, в якому є лише оксиди:
А) KPO3, NaCl, СаSO3 Б) Na2О, MgO, Li2О В) Zn(ОН), FeО, NaCl
6. Укажіть метал, який взаємодіє з хлоридною кислотою:
А) Аg Б) Fe В) Си Г) Аu
ІІ рівень
Обрати вірну відповідь (кожна вірна відповідь – 1 б.)
7. Складіть формули таких речовин;
А) калій оксид, Б) сульфітна кислота В) купрум (ІІ) гідроксид, Г) кальцій карбонат
8. Молярна маса хлоридної кислоти дорівнює:
А) 56 Б) 36,5 Г) 219 Д) 57
9. Дописати рівняння та визначити тип реакцій:
1) Nа + Н2SO4→ 2) ЅО2 + Νа2О →
ІІІ рівень
Завдання 10 має кілька правильних відповідей (1б).
10. Укажіть речовини, з якими може взаємодіяти ŚO2
А) Н2О Б) ŚO2 В) КОН Г) НСl
11. Установіть відповідність між назвою й формулою сполуки (1б):
А) Ферум (ІІ) бромід 1. Fe(ОН)3
Б) Ферум (ІІІ) оксид 2. Fe Вr2
В) Ферум (ІІІ) гідроксид 3. Fe 2О3
Г) Ферум (ІІ) ортофосфат 4. Fe 3(РО4)2
5. Fe (РО4)2
12. Розв`язати задачу (1б)
Укажіть кількість речовини водню, який виділиться під час взаємодії сульфатної кислоти з цинком кількістю речовини 0,5 моль.
ІV рівень
13. Розв`язати задачу (1б)
Яка маса магнію вступить у реакцію з хлоридною кислотою, якщо при цьому виділилось 4.48 л водню за н.у.
14. Здійснити перетворення. (2б)
Си → СиО → СиСl2 → СиSO4 → Си(ОН)2
- Прийом «Міні-практикум» (І варіант)
Скласти формули сполук за їх назвами:
1) калій оксид,
2) ферум (ІІІ) сульфат;
3) барій йодид;
4) магній гідроксид;
5) кальцій карбонат;
6) хром (ІІІ) нітрат;
7) силікатна кислота;
8) літій сульфіт;
9) манган (ІІ) сульфід.
- Прийом «Міні-практикум» (ІІ варіант)
Дати назви речовин за формулами. Розподілити речовини за класами:
1) К2S
2) NаОН
3) СаВr2
4) Сr(NO3)2
5) Н2SO4
6) Са(ОН)2
7) MgCO3
8) FеО
9) НNO3
Урок 66. Практична робота №2. Розв'язування експериментальних задач.
Урок 67. Поширеність у природі та використання оксидів, кислот, основ і середніх солей.
Методична теорія.
Кластер — виділення смислових одиниць тексту та їх графічне оформлення у вигляді пучка. Включає ключові слова, ідеї, подані в логічній послідовності текстових суб’єктів, котрі створюють цілісну й наочну картину. Походить з англійської мови (cluster).
Сluster (іменник) — група однакових або подібних елементів, зібраних разом або близько один до одного; в’язка, пучок, жмуток, рій, скупчення (чогось oднopiднoгo).
Сluster (дієслово) — асоціюватися, рости гронами, збиратися групами, товпитися.
Створення кластерів сприймається школярами як творча робота, у якій є можливою реалізація власного бачення проблеми, власний підхід, варіативність як засіб самореалізації, самоутвердження. Можливість індивідуальної, парної, групової та колективної роботи створює психологічний комфорт у навчальному процесі.
Засоби роботи з кластерами є:
- складання нового кластера;
- складання короткої розповіді за готовим кластером з використанням слів, які входять до його складу;
- корекція і вдосконалення готового кластера;
- аналіз і завершення неповного кластера:
- без головного терміна, з якого починається кластер, і визначення цього головного терміна;
- без одного або кількох термінів і визначення цих термінів.
Організаційні форми:
1) самостійно під час виконання домашньої роботи;
2) самостійно на практичному занятті;
3) у складі малої групи з наступним конкурсом на кращий кластер за заданим учителем головним терміном;
4) у складі навчальної групи за участі вчителя, який спрямовує роботу й допомагає створити кластер;
5) під час виконання контрольної роботи на складання кластера чи визначення термінів неповного кластера.
Методика складання кластеру:
1. Запис ключового слова чи речення у середині аркуша чи на дошці;
2. Запис слів, або речень навколо основного слова, які приходять на думку з даної теми. Вони з’єднуються з основним словом чи реченням.
3. Кожне нове слово створює собою нове ядро, яке викликає подальші асоціації. Таким чином створюються асоціативні лінії.
Види кластерів: класичний кластер, зворотний кластер, кластер-образ, предметний кластер, кластер з нумерацією слів, мультимедійний кластер з візуальними, аудіо- та відео ефектами.
1. Скласти класичний кластер. Зобразіть на схемі-кластері 10 способів добування солей.
2. Скласти зворотній кластер. Визначити назву кислоти, кластер використання якої зображено на схемі.
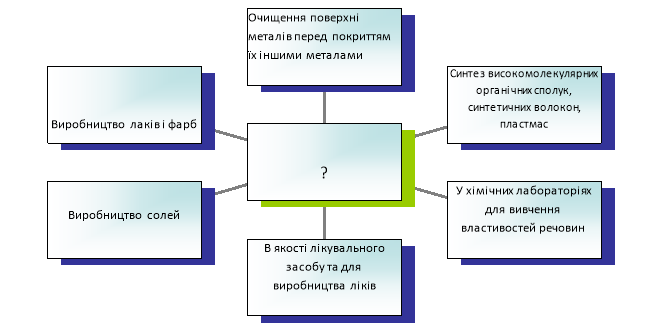
3. Скласти класичний кластер класифікації оксидів та написати по 3 формули кожного з видів оксидів.

4. Скласти зворотній кластер. Визначити назву солей, кластер поширення яких зображено на схемі.
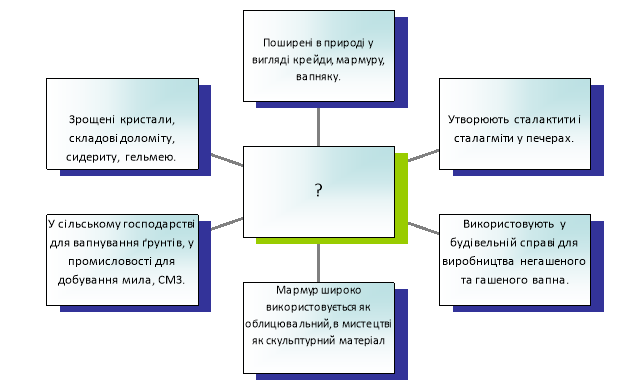
5. Скласти зворотній кластер. Визначте назву класу складних речовин, класифікація яких представлена в даному кластері та напишіть формули представників в кожну колонку.

6. Скласти рівняння хімічних реакцій, які підтверджують даний класичний кластер, який відображає генетичний зв'язок.
Урок 68. Контрольна робота №2 з теми «Основні класи неорганічних речовин. Кислоти і солі».
Варіант №1
І рівень
- Вкажіть кислоту, яка належить до оксигеновмісних:
а) H2SO4; б) HCl; в) H2S.
- У формулах солей підкресліть кислотний залишок:
K3PO4, MgS, CaSO4.
3. Назвіть речовину, формула якої Al2(SO4)3 :
а) алюміній сульфат; б) алюміній гідроксид;
в) алюміній оксид.
(кожне завдання – 1 бал)
ІІ рівень
- Які речовини називають кислотами?
- Вкажіть формулу нерозчинної у воді основи:
а) КОН; б) Zn(OH)2; в) Ва(ОН)2.
- В якому ряду розміщені тільки формули солей:
а) Mg(OH)2, KCl, Fe2O3; б) Na2S, CaCO3, Ba(NO3)2.
(кожне завдання – 1 бал)
ІІІ рівень
- Складіть формули солей:
ІІІ ІІ
а) CrSO3; б) LiPO4; в) PbNO3.
(1 – бал)
2. Допишіть рівняння. Поставте коефіцієнти.
а) КОН + SO2 = ; б) Zn(OH)2 = ; в) FeCl3 + NaOH = .
(2 бали)
IV рівень
- Напишіть рівняння реакцій, що лежать в основі схеми:
Mg(OH)2 → Mg3(PO4)2
↓
MgO (1 бал)
- Кальцій гідроксид масою 29,6 г нейтралізували сульфатною кислотою. Обчисліть маси речовин, що утворились.
(2 бали)
Варіант №2
І рівень
1. До якого ряду хімічних формул не увійшли формули кислот:
а) HCl, Mg(OH)2, Fe(OH)3 ; б) SiO2, F2, CaCO3.
- Вкажіть відповідність між формулою і назвою солей:
а) NaCl 1. барій сульфат
б) Ca(NO3)2 2. натрій хлорид
в) BaSO4 3. кальцій нітрат
- Розчинні у воді основи називають:
а) солі; б) кислоти; в) луги.
(кожне завдання – 1 бал)
ІІ рівень
- Які речовини називаються солями?
- Який з гідроксидів - розчиняється у воді:
а) LiOH; б) Mg(OH)2; в) Al(OH)3?
- Яка з сполук називається калій карбонатом:
а) СаСО3; б) СuСО3; в) К2СО3?
(кожне завдання – 1 бал)
ІІІ рівень
- Назвіть сполуки, подані формулами:
а) Ba3(PO4)2; б) AlCl3; в) MgCO3.
(1 бал)
- Допишіть рівняння реакцій. Поставте коефіцієнти.
а) Cr(OH)3 = ; б) Ba(OH)2 + H3PO4 = ; в) MnSO4 + KOH =.
(2 бали)
IV рівень
- Напишіть рівняння реакцій, що лежать в основі схеми.
Fe(OH)3 → Fe2O3
↓
Fe2(SO4)3 (1 бал)
- На кальцій карбонат масою 25 г подіяли розчином хлоридної кислоти. Яка маса утвореної солі? Який об'єм карбон (IV) оксиду виділився при цьому?
(2 бали)
Варіант №3
І рівень
- До складу солей входять:
а) атоми металів і кислотні залишки;
б) атоми Гідрогену і кислотні залишки;
в) атоми металів і гідроксильні групи.
- Вкажіть назву речовини, формула якої Fe(OH)3 :
а) ферум (ІІІ) оксид, б) ферум (ІІІ) гідроксид,
в) ферум (ІІ) гідроксид.
- Вкажіть відповідність між класами сполук і формулами:
А) SO3 1. сіль
Б) H2S 2. основа
В) Be(OH)2 3. оксид
Г) LiNO3 4. кислота
(кожне завдання – 1 бал)
ІІ рівень
- Які основи називають лугами?
- Напишіть формули основ, яким відповідають оксиди:
CaO, Cr2O3, Li2O.
- Однією рискою підкресліть формули солей, двома основ:
AgCl, HCl, Al(OH)3, Na2SiO3 .
(кожне завдання – 1 бал)
ІІІ рівень
- Напишіть формули сполук: а) алюміній сульфат;
б) кальцій силікат; в) ферум (ІІ) сульфід.
(1 бал)
- Допишіть рівняння реакцій. Поставте коефіцієнти.
а) Fe(OH)3 + HNO3 = ; б) LiOH + H2SiO3 = ; в) Sn(OH)2 =.
(2 бали)
IV рівень
- Напишіть рівняння реакцій, що лежать в основі схеми:
AlCl3 → Al(OH)3 → Al(NO3)3
(1 бал)
- Через натрій гідроксид масою 80 г пропустили сульфур (IV) оксид до повної нейтралізації лугу. Яка маса та кількість речовини солі утворилася?
(2 бали)
Варіант №4
І рівень
- До якого ряду формул не увійшли формули солей:
а) KOH, Mg(OH)2, SO3 б) K2CO3, ZnSO4, CO.
2. Визначте валентність металу у формулі Cr2(SO4)3:
а) І ; б) ІІ ; в) ІІІ .
- Назвіть речовину, формула якої Zn(NO3)2:
а) цинк гідроксид; б) цинк нітрат; в) цинк оксид.
(кожне завдання – 1 бал)
ІІ рівень
- Які реакції називають реакціями нейтралізації?
- Фенолфталеїн у лужному середовищі змінює забарвлення на: а) жовте; б) синє; в) малинове.
- Як називаються солі сульфітної кислоти?
(кожне завдання – 1 бал)
ІІІ рівень
1. Напишіть формули сполук:
а) барій гідроксид;
б) хром (ІІІ) гідроксид; в) купрум (ІІ) гідроксид.
(1 бал)
- Допишіть рівняння реакцій. Поставте коефіцієнти.
а) Fe(OH)3 = ; б) Ca(OH)2 + H3PO4 = ; в) MgCl2 + NaOH = .
(2 бали)
IV рівень
- Напишіть рівняння реакцій, що лежать в основі схеми:
СаСО3 → СаО
↓
Ca(NO3)2
(1 бал)
- На нейтралізацію розчину, що містить калій гідроксид масою 11,2 г подіяли ортофосфатною кислотою. Обчисліть масу і кількість речовини калій ортофосфату?
(2 бали)
Урок 69. Представлення результатів навчальних проектів.
4. Сполуки основних класів у будівництві й побуті.
5. Хімічний склад і використання мінералів.
6. Вирощування кристалів солей.
7. Вплив хімічних сполук на довкілля і здоров'я людини.
Урок 70. Підсумковий урок. Вплив речовин на довкілля.
- Ситуаційні задачі
Ситуаційні задачі – це задачі без алгебраїчних дій, це питання, на які потрібно дати розгорнуту відповідь. Для вирішення таких задач необхідні знання з декількох предметів. Вони обов'язково повинні містити лаконічну назву і проблемні запитання. під час розв'язування таких задач учень усвідомлює, що хімічні реакції відбуваються скрізь. Також розширюються світогляд і ерудованість учня.
Ситуаційні задачі спрямовані на формування життєвої і соціальної компетенції учнів, екологічної культури, навичок безпечного поводження з речовинами в побуті і на виробництві.
Задача 1. Туман
Осіннього туманного ранку підемо в ліс. Як тільки почнуться з'являтися перші сонячні промені, одразу можна спостерігати цікаве явище. Туман освітлюється сонцем і відбувається розсіювання сонячних променів. Як можна пояснити це явище ?
Відповідь. Це явище можна пояснити за допомогою ефекту Стендаля. Світло, яке проходить крізь неоднорідне середовище, розсіюється. Розсіювання світла, як правило, спостерігають у вигляді конусу, який добре видно на темному фоні. У цьому випадку неоднорідним середовищем був туман – грубо дисперсна суміш крапля води, що були рівномірно розподілені в повітрі.
Задача 2. Знезараження води
Хлор використовується на фільтрувальних станціях для знезаражування питної води. Багато хто вважає, що саме хлор знезаражує воду, але це неправильно. Під час взаємодії хлору з водою відбувається декілька хімічних реакцій з утворенням речовини, яка й чинить отруйний ефект на всі організми. Яка це речовина?
Відповідь. Під час розчинення хлору у воді відбувається реакція:
Cl2 + Н2О = НClО + НCl
Утворюється нестійка гіпохлоритна кислота - НClО. Кислота поступово розкладається з утворенням атомарного кисню: НClО= НCl + О. Саме атомарний кисень є дуже активним і вбиває мікроорганізми. Також ефективним аналогом хлорує озон, який також може розкладатись з утворенням атомарного кисню.
Задача 3. Таємничі вогні
Іноді вночі, на болотах можна побачити блакитне полум`я над водою. під час горіння невідомої речовини, як правило, поширюється неприємний запах, який нагадує гнилу рибу. Здавна люди лякалися цього явища і вірили, що це прояви потайбічної сили. Феномен» породив багато легенд і міфів, пронизаних містикою. Що ж насправді відбувається на болотах?
Відповідь. Під час розкладу органічних речовин на дні болота утворюється газ – фосфін РН3. Ця речовина має досить неприємний запах, що нагадує запах гнилої риби. Особливою властивістю цієї речовини є те, що вона здатна самозайматись на повітрі. Горить фосфін блакитним полум`ям.
Задача 4. Розчинені гази
Усім відомо, щоб позбутися розчиненого хлору у воді, воду треба прокип'ятити. Однак воду, яку заливають у акваріум, кип'ятити не бажано. Чому?
Відповідь. Розчинність газів у рідинах під час підвищення температури зменшується. Коли вода кипить, розчинність хлору зменшується й газ випаровується з води. Так само випаровується кисень, що розчинений у воді. Тому кип'ячена вода дуже бідна на розчинений кисень. Саме таку воду не варто заливати в акваріум, бо його мешканцям просто не буде чим дихати!
Задача 5. Навіщо ми дихаємо?
Поставте питання «Навіщо ми дихаємо?» своїм друзям. Ви одержите такі відповіді: «щоби жити», «щоб кров кисень розносила», «так улаштовано в природі». Чи правильні ці відповіді? Під час дихання утворюється велика кількість енергії, яка необхідна для функціонування живого організму. Спробуйте пояснити істинну функцію дихання всього живого.
Відповідь. Нам відомо, що Оксиген, з якого складаються молекули кисню, - сильний окисник. Процеси окиснення відбуваються з виділенням енергії. Якщо є окисник, то повинні бути й речовини, які окиснюються, - відновники. Ці продукти харчування, в яких містяться білки, жири й вуглеводи. Саме ці речовини окиснюються киснем в організмі, внаслідок чого виділяється енергія. Якщо є окисник, то повинні бути і речовини, що окислюються, - відновники. Це продукти харчування, в яких містяться білки, жири й вуглеводи. Саме ці речовини окислюються киснем в організмі, внаслідок чого виділяється енергія. окиснення відбувається безпосередньо в живих клітинах. Тож дихаємо ми перш за все для того, щоб у організмі відбувались окисно-відновні реакції між киснем та іншими речовинами.
Задача 6. Демеркуризація.
Всім відомо, що коли розбивається ртутний термометр, ртуть скупчується у вигляді блискучих кульок. Також усі знають, що випари цієї речовини отруйні й можуть нашкодити. Однак не всі знають, яким чином можна зібрати або нейтралізувати розлиту ртуть. Яким чином це можна зробити?
Відповідь. Ртуть не змочує більшості поверхонь, перебуваючи на яких у вигляді рухливих крапель, але змочує поверхні багатьох металів. Механічний спосіб – зібрати на мідну монету. Хімічний спосіб – затерти місце, де було розлито ртуть, сіркою або залити розчином ферум(ІІІ) хлориду. Під час реакції ртуті з цими речовинами утворюються нерозчинні сполуки Меркурію, які не мають шкідливих випарів.
Задача 7. Вода
Вода – найпоширеніша речовина на планеті. З точки зору будови речовини, вода за звичайних умов повинна бути газом! Однак природа вирішила інакше, завдяки чому й виникло життя на нашій планеті. відомо, що лід плаває поверхнею води. Поясніть, чому. Які наслідки спіткали б живі організми, якщо лід осідав би на дно водойм?
Відповідь. Вода за звичайних умов рідка завдяки водневим зв'язкам, які утримують маленькі молекули води одна біля одної й не дають їм розлітатися, як це відбувається у газуватих речовин. Лід плаває поверхнею води, тому що його густина менша за густину рідкої води. Це пояснюється тим, що у твердому стані молекула води об'єднуються у правильні шестигранники й середину шестигранника заповнює повітря. Якби густина льоду була, навпаки, більшою за густину води, тоді лід тонув би й осідав на дно. Водойми промерзли б повністю. Оскільки на значних глибинах температура води цілорічно майже однакова, лід не розмерзався б ніколи. Звичайно, що за таких умов у водоймах живих організмів було би менше.
Задача 8. Термочутливі фарби
У різноманітних температурних індикаторах досить часто використовують термочутливі фарби. Це речовини, які змінюють своє забарвлення за певною температури. таким чином, про зміну температури індикатор сигналізує візуально, змінюючи своє забарвлення, наприклад, із жовтого на червоне за певної температури. Спробуйте пояснити з точки зору хімії, що відбувається з речовиною
Відповідь. Відомо, що під час нагрівання багато речовин, які мають кристалічну гратку, зазнають змін у будові кристалу. Структурні частинки ґратки займають зовсім інше положення, відмінне від попереднього. Змінена кристалічна гратка речовини обумовлює і зміну властивостей речовини. Зазвичай такі зміни відбуваються за досить високих температур. Однак є винятки – термочутливі фарби. Деякі з цих речовин змінюють своє забарвлення за температури 40-1000С, і відбувається це внаслідок зміни будови кристалічної гратки.
Задача 9. Забарвлення від чистої колби
Учень проводив експеримент за участі індикатора метиленового блакитного. Після завершення дослідів увесь посуд був ретельно вимито водою, колба не містила залишків реагентів. У наступному експерименті в колбу було налито оцтову кислоту, розчин забарвився в синій колір! Що відбулося? Виходить, що минулого разу учень колбу вимив неретельно?
Відповідь. Справа в тому, що існують речовини, які здатні адсорбуватись склом. Саме такою речовиною є метиленовий блакитний. Під час додавання оцтової кислоти відбувається вимивання індикатору зі стінок колби, саме тому і спостерігаємо забарвлення розчину в синій колір.
Задача 10. Гримучий газ
На початку XX століття водень активно використовували як пальне для дирижаблів. Цей газ має дві гарні для цього властивості: по-перше, водень, легкий, по друге – горючий. Однак, 1937 року дирижабль Гінденбург вибухнув у місті Лейкхерст (США). Усі пасажири дирижаблю загинули. Після цього популярність дирижаблів почала стрімко знижуватись. Чому стався вибух?
Відповідь. Якщо підпалити чистий водень без домішок, він горить спокійним, майже безбарвним полум'ям. Однак суміш водню з киснем є вибухонебезпечною й має назву «гримучий газ». Під час заправки дирижаблю не було дотримано правил техніки безпеки. У резервуарі містилася воднево-киснева суміш, яка вибухнула. Парадоксальним є те, що результатом цього вибуху є вода. Вода народжується з полум'я!
Використана література:
- Буринська Н.М. Хімія, 8 кл.: Підручник для серед. загальноосвіт. шк.. – 3-тє вид., випр. і доп. – Київ; Ірпінь: ВТФ «Перун», 2000.
- Дробишев Є.Ю. Як зацікавити учнів на уроках хімії /Є.Ю. Дробишев.- Х.: Вид.група «Основа», 2016.- 96 с. – (Б-ка журн. «Хімія»; Вип. 11 (167)).
- Савчин М.М. Хімія. Вимірники навчальних досягнень: Діагностично-тренувальні та контрольно-оцінювальні завдання. 8 клас. – Львів: ВНТЛ, 2001.
- Савчин М.М. Хімія: Підручник для 8 класу загальноосвітніх навчальних закладів. – Київ: Грамота, 2016.
- https://uk.wikipedia.org
ЗМІСТ
Пояснююча записка ……………………………………………………………………... 3
Календарно-тематичне планування ……………………………………………………. 4
Урок 1 ……………………………………………………………………………………. 11
Урок 2 ……………………………………………………………………………………. 17
Урок 3 ……………………………………………………………………………………. 20
Урок 4 ……………………………………………………………………………………. 21
Урок 5 ……………………………………………………………………………………. 23
Урок 6 ……………………………………………………………………………………. 24
Урок 7 ……………………………………………………………………………………. 27
Урок 8 ……………………………………………………………………………………. 30
Урок 9 ……………………………………………………………………………………. 32
Урок 10 …………………………………………………………………………………... 34
Урок 11 …………………………………………………………………………………... 34
Урок 12 …………………………………………………………………………………… 35
Урок 13 …………………………………………………………………………………… 36
Урок 14 …………………………………………………………………………………… 37
Урок 15 …………………………………………………………………………………… 39
Урок 16 …………………………………………………………………………………… 40
Урок 17 …………………………………………………………………………………… 41
Урок 18 …………………………………………………………………………………… 42
Урок 19 …………………………………………………………………………………… 44
Урок 20 …………………………………………………………………………………… 44
Урок 21 …………………………………………………………………………………… 46
Урок 22 …………………………………………………………………………………… 46
Урок 23 …………………………………………………………………………………… 47
Урок 24 …………………………………………………………………………………… 48
Урок 25 …………………………………………………………………………………… 49
Уроки 26, 27 ……………………………………………………………………………… 51
Урок 28 …………………………………………………………………………………… 54
Урок 29 …………………………………………………………………………………… 56
Урок 30 …………………………………………………………………………………… 56
Урок 31 ……………………………………………………………………………………. 58
Урок 32 ……………………………………………………………………………………. 59
Урок 33 ……………………………………………………………………………………. 60
Урок 34 ……………………………………………………………………………………. 62
Урок 35 ……………………………………………………………………………………. 63
Урок 36 ……………………………………………………………………………………. 65
Урок 37 ……………………………………………………………………………………. 66
Урок 38 ……………………………………………………………………………………. 66
Урок 39 ……………………………………………………………………………………. 67
Урок 40 ……………………………………………………………………………………. 68
Урок 41 ……………………………………………………………………………………. 73
Урок 42 ……………………………………………………………………………………. 76
Урок 43 ……………………………………………………………………………………. 78
Урок 44 ……………………………………………………………………………………. 80
Урок 45 ……………………………………………………………………………………. 82
Урок 46 ……………………………………………………………………………………. 84
Урок 47 ……………………………………………………………………………………. 87
Урок 48 ……………………………………………………………………………………. 89
Урок 49 ……………………………………………………………………………………. 92
Урок 50 ……………………………………………………………………………………. 94
Урок 51 …………………………………………………………………………………… 97
Урок 52 …………………………………………………………………………………… 99
Урок 53 …………………………………………………………………………………… 101
Урок 54 …………………………………………………………………………………… 106
Урок 55 …………………………………………………………………………………… 109
Урок 56 …………………………………………………………………………………… 112
Урок 57 …………………………………………………………………………………… 114
Урок 58 …………………………………………………………………………………… 115
Урок 59 …………………………………………………………………………………… 116
Урок 60 …………………………………………………………………………………… 117
Урок 61 …………………………………………………………………………………… 119
Урок 62 …………………………………………………………………………………… 120
Уроки 63, 64, 65 ………………………………………………………………………….. 121
Урок 66 …………………………………………………………………………………… 123
Урок 67 …………………………………………………………………………………… 123
Урок 68 …………………………………………………………………………………… 126
Урок 69 …………………………………………………………………………………… 128
Урок 70 …………………………………………………………………………………… 128
Використана література …………………………………………………………………. 132
1


про публікацію авторської розробки
Додати розробку
