Конспект уроку "Атомні й молекулярні спектри. Спектральний аналіз та його застосування. Спектрометр. Рентгенівське випромінювання"
Урок 49 «Атомні й молекулярні спектри. Спектральний аналіз та його застосування. Спектрометр. Рентгенівське випромінювання»
Мета уроку:
Навчальна:Ознайомити учнів з лінійчастими й молекулярними спектрами випромінювання.
Розвивальна. Розвивати творчий підхід до навчання як засіб виховання стійкого інтересу до предмета.
Виховна. Виховувати уважність, зібраність, спостережливість.
Тип уроку: урок засвоєння нових знань.
Наочність і обладнання: навчальна презентація, комп’ютер, підручник.
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
II. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ ТА ВМІНЬ
Самостійна робота
Тема «Історія вивчення атома. Ядерна модель атома. Квантові постулати Бора. Випромінювання та поглинання світла атомами»
Варіант 1
- Що собою являла модель атома Томсона
- позитивно заряджену сферу, в яку вкраплені електрони;
- негативно заряджена сфера, в яку вкраплені протони;
- нейтрально заряджена сфера, в яку вкраплені електрони;
- позитивно заряджена сфера, в яку вкраплені нейтрони.
- В цілому якого знака є атом
- негативного;
- позитивного;
- нейтрального;
- не заряджений.
- А́льфа-части́нка (α-частинка) являє собою хімічний елемент
-
 ;
;
-
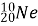 ;
;
-
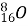 ;
;
-
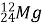 .
.
- Основний стан атома – це
- стан з мінімальною енергією;
- стан без енергії;
- стан з максимальною енергією;
- стан з додатковою енергією.
- Лінійні розміри ядра та розміри атома
- 10-15 – 10-14 м; 10-10 м;
- 1015 – 1014 м; 1010 м;
- 10-10 – 10-4 м; 10-10 м;
- 10-15 – 10-14 м; 10-15 м;
-
Обчисліть кількість електронів, протонів, нейтронів, нуклонів в атомах
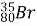 ,
, 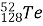 ,
,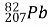 ;
;
-
Ядро Натрію
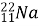 випустило електрон. Запишіть рівняння відповідної реакції.
випустило електрон. Запишіть рівняння відповідної реакції.
- Під час переходу атома водню з другого енергетичного стану в четвертій випромінюються фотони . Визначити енергію цих фотонів, спектр та довжину хвилі.
Самостійна робота
Тема «Історія вивчення атома. Ядерна модель атома. Квантові постулати Бора. Випромінювання та поглинання світла атомами»
Варіант 2
- Яку назву мала модель атома Томсона
- банановий пудинг;
- кекс з горішками;
- пиріг з родзинками;
- кекс з родзинками.
- А́льфа-части́нка (α-частинка) заряджена
- позитивно;
- негативно;
- нейтрально;
- не заряджена.
- В чому полягала суть досліду Резерфорда?
-
потік
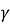 – частинок проникає крізь тонку срібну фольгу товщиною приблизно 10000 атомів;
– частинок проникає крізь тонку срібну фольгу товщиною приблизно 10000 атомів;
- потік α – частинок проникає крізь тонку цинкову фольгу товщиною приблизно 10000 атомів;
- потік α – частинок проникає крізь тонку золоту фольгу товщиною приблизно 10000 атомів;
-
потік
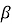 – частинок проникає крізь тонку цинкову фольгу товщиною приблизно 10000 атомів;
– частинок проникає крізь тонку цинкову фольгу товщиною приблизно 10000 атомів;
- Весь позитивний заряд атома і майже вся його маса зосереджені в
- електроні;
- ядрі;
- між електроном і ядром;
- протоні.
- Енергія , якою володіє атомний електрон в певному стаціонарному стані
- енергетичний рівень;
- енергетичний стан;
- основний стан;
- проміжний рівень.
-
Обчисліть кількість електронів, протонів, нейтронів, нуклонів в атомах
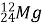 ,
, 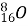 ,
,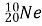 ;
;
-
Відбувся
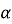 - розпад радію
- розпад радію 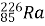 випустило електрон. Запишіть рівняння відповідної реакції.
випустило електрон. Запишіть рівняння відповідної реакції.
- Під час переходу атома водню Визначити енергію цих фотонів, спектр та довжину хвилі.
IІІ. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
- Лінійчасті спектри випромінювання
Численні дослідження довели, що внаслідок нагрівання до високої температури пари будь-якої хімічної речовини випромінюють світло, вузький пучок якого призма розкладає на кілька пучків.
Лінійчасті спектри – оптичні спектри випущення й поглинання, що складаються з окремих спектральних ліній.
Лінійчастий спектр випускання будь-якого конкретного хімічного елемента не збігається зі спектром випускання інших хімічних елементів.
Зворотнім явищем є випадок пропускання білого світла через пару речовини, спостерігається виникнення темних ліній на тлі суцільного спектра. Розміщені вони точно в тих місцях, де б повинні були світлі лінії спектра випускання цього хімічного елемента. Такий спектр називають лінійчастим спектром поглинання.
- Атомні та молекулярні спектри
 Спектри молекулярних газів відрізняються від атомних спектрів і виглядають як система смуг із численних і дуже близьких одна до одної ліній. Така спектральна картина пояснюється двома причинами: коливаннями атомів усередині молекули та обертанням молекули.
Спектри молекулярних газів відрізняються від атомних спектрів і виглядають як система смуг із численних і дуже близьких одна до одної ліній. Така спектральна картина пояснюється двома причинами: коливаннями атомів усередині молекули та обертанням молекули.
Електронні та коливальні рівні енергії молекули розбиваються на множину обертальних підрівнів. Кількість можливих переходів різко збільшується, що на практиці зумовлює виникнення величезної кількості ліній спектра, які зливаються в широкі смуги.
- Рентгенівське випромінювання
 Відкриття особливого проникного випромінювання німецький фізик: Вільгельм Конрад Рентген здійснив 8 листопада 1895 р. Рентгенівське випромінювання виникає внаслідок взаємодії швидких електронів з атомами катода в рентгенівській трубці.
Відкриття особливого проникного випромінювання німецький фізик: Вільгельм Конрад Рентген здійснив 8 листопада 1895 р. Рентгенівське випромінювання виникає внаслідок взаємодії швидких електронів з атомами катода в рентгенівській трубці.
Якщо енергія електронів достатньо значна, то може відбуватися вивільнення електронів із внутрішніх оболонок атомів із великим порядковим номером. «Повернення» електронів супроводжуватимуться випусканням дискретного спектра рентгенівського випромінювання, подібного до спектра у видимому діапазоні. Це випромінювання називають характеристичним рентгенівським випромінюванням. Крім того, у рентгенівській трубці відбувається гальмування швидких заряджених частинок під час їхньої взаємодії з електричними полями атомних ядер – гальмівне рентгенівське випромінювання.
Значний внесок у дослідження рентгенівського випромінювання зробив видатний учений українського походження Іван Павлович Пулюй.
- Спектральний аналіз та його застосування. Спектрометр
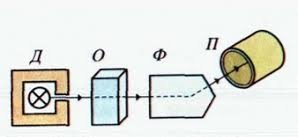 Вивчення атомних і молекулярних спектрів випромінювання і поглинання покладено в основу спеціального методу дослідження складу і будови речовини — спектрального аналізу. Він грунтується на кількісних і якісних методах дослідження спектрів електромагнітного випромінювання речовин, які спостерігають за допомогою спеціальних приладів — спектрографів і спектрометрів.
Вивчення атомних і молекулярних спектрів випромінювання і поглинання покладено в основу спеціального методу дослідження складу і будови речовини — спектрального аналізу. Він грунтується на кількісних і якісних методах дослідження спектрів електромагнітного випромінювання речовин, які спостерігають за допомогою спеціальних приладів — спектрографів і спектрометрів.
![]() Принцип дії цих приладів грунтується на їх здатності виокремлювати в просторі і часі з усього світлового потоку певні ділянки випромінювання. їх можна фіксувати фотографічним способом або вимірювати різні їхні характеристики — зміну світлового потоку, довжину хвилі спектральної лінії тощо.
Принцип дії цих приладів грунтується на їх здатності виокремлювати в просторі і часі з усього світлового потоку певні ділянки випромінювання. їх можна фіксувати фотографічним способом або вимірювати різні їхні характеристики — зміну світлового потоку, довжину хвилі спектральної лінії тощо.
Метод визначення в тілах якісного складу і кількісного вмісту речовини за її спектром називають спектральним аналізом.
За допомогою атомного спектрального аналізу визначають елементний склад зразка, зіставляючи його спектр зі спектральними лініями хімічних елементів, що наводяться у спеціальних таблицях і атласах. Для одержання спектра випромінювання досліджувану речовину потрібно перевести в газоподібний стан і активізувати, тобто перевести її атоми у збуджений стан. Найпростіше це можна зробити за допомогою нагрівання досліджуваного зразка, наприклад помістити його в полум'я.
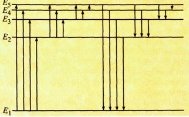 Кожен хімічний елемент має власний набір спектральнихліній, притаманний лише йому одному. Для одержання спектра випромінювання атоми речовини слід перевести у збуджений стан, наприклад нагріти тіло до високої температури. За високих температур атоми переходять у збуджений стан Е2, E3, Е4, Е5, в якому можуть перебувати недовго (рис. 3). З часом вони повертаються у свій основний, стабільний стан E1.
Кожен хімічний елемент має власний набір спектральнихліній, притаманний лише йому одному. Для одержання спектра випромінювання атоми речовини слід перевести у збуджений стан, наприклад нагріти тіло до високої температури. За високих температур атоми переходять у збуджений стан Е2, E3, Е4, Е5, в якому можуть перебувати недовго (рис. 3). З часом вони повертаються у свій основний, стабільний стан E1.
 Кожний хімічний елемент має свій, властивий лише йому набір спектральних ліній — атомний спектр. За лініями атомного спектра речовини за допомогою спеціальних таблиць, в яких наведено серії довжин хвиль спектрів випромінювання різних речовин, визначають хімічний склад зразка.
Кожний хімічний елемент має свій, властивий лише йому набір спектральних ліній — атомний спектр. За лініями атомного спектра речовини за допомогою спеціальних таблиць, в яких наведено серії довжин хвиль спектрів випромінювання різних речовин, визначають хімічний склад зразка.
У гірничодобувній промисловості за допомогою спектрального аналізу визначають хімічний склад зразків корисних копалин.
Спектр молекули є її однозначною характеристикою, за якою ідентифікують речовини. Кількісний вміст речовини визначається за інтенсивністю випромінювання смугастого спектра. Зокрема, застосування сучасних фотоелектричних приладів сумісно з обчислювальною технікою дає змогу визначати склад речовин за досить малих їх мас — до 1 мкг і менше. Тому цей метод знайшов широке застосування в науці і техніці. Зокрема, у металургійному виробництві за його допомогою контролюють вміст домішок у сплавах, щоб отримувати матеріали із заданими властивостями.
Застосування спектрального аналізу в астрофізиці дає змогу визначати хімічний склад і рух небесних тіл, які знаходяться далеко за межами нашої галактики.
ІV. ЗАКРІПЛЕННЯ НОВИХ ЗНАНЬ І ВМІНЬ
- Чим відрізняється атом, що перебуває в стаціонарному стані, від атома в збудженому стані?
- Електрон в атомі Гідрогену перейшов із четвертого енергетичного рівня на другий. Як при цьому змінилася енергія атома? Чому?
-
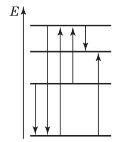 Визначте, який з переходів (рис. 4.) відповідає:
Визначте, який з переходів (рис. 4.) відповідає:
а) випромінюванню з найбільшою довжиною хвилі? б) поглинанню з найбільшою частотою?
![]() V. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
V. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
Бесіда за питаннями
- Що називають лінійчастим спектром випромінювання?
- Що називають лінійчастим спектром поглинання?
- Назвіть характерні риси спектрального випромінювання молекул.
- Який внесок зробив І.П. Пулюй у дослідження та використання рентгенівського випромінювання?
- Як за допомогою вимірювання атомних та рентгенівських спектрів можна одержати інформацію про елементний склад речовини?
VI. Домашнє завдання
Опрацювати § 51, Вправа № 37 (3)



про публікацію авторської розробки
Додати розробку
