Конспект уроку для дистанційного навчання (для роботи з учнями). Тема: Кількісний склад розчину. Масова частка розчиненої речовини. Виготовлення розчину.
Конспект уроку для дистанційного навчання
(для роботи з учнями)
Тема: Кількісний склад розчину. Масова частка розчиненої речовини.
Виготовлення розчину.
Мета для учня:
Знаннєвий компонент:
- повторити поняття розчин, розчинник, розчинена речовина;
- знати як відображають кількісний склад розчину, формулу для визначення масової частки розчиненої речовини в розчині;
- наводити приклади розчинів.
Діяльнісний компонент:
- визначати і розрізняти компоненти розчину: розчинник і розчинену речовину;
- обчислювати масову частку розчиненої речовини в розчині, масу розчиненої речовини і масу розчинника
- виготовляти розчини з певною масовою часткою розчиненої речовини;
- використовувати здобуті знання та навички в побуті для раціонального використання води та збереження довкілля;
Ціннісний компонент:
- обґрунтувати значення розчинів у природі та житті людини.
І. Актуалізація опорних знань.
1. Повторити § 32, (Ярошенко О.Г. Хімія 7 клас) або відповідний
§ підручника, за яким навчаються діти
2. Дати відповіді на питання:
1. Сформулюйте визначення поняття «розчин» і назвіть його компоненти? Наведіть приклади розчинів у природі.
2. Як класифікують розчини за кількісним співвідношенням компонентів? Наведіть приклади розбавлених і концентрованих розчинів.
3. Які розчини називаються насиченими, а які ненасичені? Наведіть приклади.
4. Поміркуйте, як можна з насиченого розчину, зробити ненасичений?
5. А чи можна з ненасиченого розчину зробити насичений?
6. Чи може розбавлений розчин бути насиченим?
2. Виконати завдання.
- Перевірити свої знання, виконуючи тести за посиланням:
https://naurok.com.ua/test/rozchin-i-yogo-komponenti-147072.html (завдання для ознайомлення вчителю)
https://naurok.com.ua/test/start/147072 (посилання для виконання учням того ж самого тесту)
- Завдання для допитливих*.
https://learningapps.org/4149974
Для вивчення нової теми пригадаємо з курсів математики та хімії:
- Як знайти частину від цілого?
- Що таке частка від числа і в чому вона може бути виражена?
- Як знайти частку від числа?
- Що таке відсотки?
- Як знаходять відсотки від числа і число за його відсотками?
- Чи використовували раніше ви ці знання на уроках хімії? Якщо так, то при розв’язуванні яких задач?
- Для чого і як обчислюють масові частки хімічних елементів у сполуці?
- Розв’яжіть задачу
Задача. Визначити масові частки елементів у магній оксиді.
|
Знайти: |
Розв'язання
Mr (MgO) = Ar (Mg)+ Ar(O) Mr (MgO) = 24+16 =40
Або W(O)=1- W(Mg) = 1-0,6=0,4 Масова частка елементів в даному випадку виражена у частках від одиниці. Але ж масова частка може бути виражена і у відсотках.
|
||||||||||||||||||||||||
|
W(Мg ) - ? W(О)-? |
|||||||||||||||||||||||||
|
Дано |
|||||||||||||||||||||||||
|
МgО Ar(Mg) = 24 Ar(O) = 16 |
|||||||||||||||||||||||||
Ваші знання допоможуть нам у вивченні нової теми.
ІІ. Мотивація навчальної діяльності
Людина в своєму житті використовує дуже багато різних розчинів, наприклад:




![]()
![]()
![]() 5% 10% 9% 33 3%
5% 10% 9% 33 3%
![]()
- Як ви вважаєте, що означають записи відсотків на етикетках? І навіщо вони потрібні?
Спробуємо розібратись.
ІІІ. Вивчення нового матеріалу.
Важливою характеристикою будь-якого розчину є його склад. Склад розчину можна описати з двох позицій: якісний (з яких речовин складається розчини) і кількісний (скільки він містить розчинника і розчиненої речовини).
Існує кілька способів вираження кількісного складу розчинів, але найчастіше використовують масову частку розчиненої речовини (W).
З поняттям «масова частка» ми вже знайомі і сьогодні його застосовували, тільки йшлося про масову часту елемента в складній речовині. Повернемося до задачі, яку сьогодні виконували і звернемо увагу ще раз на формулу для визначення масової частки елемента в складній речовині.
А тепер ми будемо вчитися визначати масову частку розчиненої речовини в розчині.
Відношення маси розчиненої речовини до загальної маси розчину називають масовою часткою розчиненої речовини ( позначають W) і розраховують за формулою, виражають в частках від одиниці.
|
W(реч) = |
m (розчиненої речовини) |
(у частках від одиниці) |
|
m (розчину) |
де W - масова частка розчиненої речовини;
m(речовини) – маса розчиненої речовини;
m(розчину) – маса розчину.
В результаті відповідних розрахунків одержуємо результат у частках одиниці.
Проте, у прикладах розчинів, які було наведено (3% розчин гідроген пероксиду, 9% розчин оцту тощо), чисельні значення масової частки розчиненої речовини в розчині зазначені у відсотках, та і на побутовому рівні зручніше використовувати відсотки. Тому формула набуває такого вигляду:
|
W(реч) = |
m (розчиненої речовини) |
*100% |
(у відсотках) |
|
m (розчину) |
Масова частка розчиненої речовини в розчині, що виражена у відсотках, показує масу речовини в 100 г розчину
Наприклад, розчин солі з масовою часткою 3 % - це розчин, у 100 г якого міститься 3 г солі.
З яких компонентів складається розчин? (розчинник і розчинена речовина), отже m (розчину) = m (р-ка) + m (р.р).
Тому формула може набувати і такого вигляду:
|
W(реч) = |
m (розчиненої речовини) |
*100% |
(у відсотках) |
|
m (р-ка) + m(р.р.) |
Знаючи масу розчину і масу розчиненої речовини, можна знайти масу розчинника за формулою:
m (розчинника ) = m(розчину) - m (розч. речовини)
Повернемося до попереднього прикладу.
Що означає запис: 3% розчин солі?
Ми можемо зробити висновок, що у 100г розчину маса розчиненої речовини – солі становить 3 г, а маса розчинника – води - 97 г (100 г - 3 з = 97 г)
Для формування стійкого уміння обчислювати масову частку розчиненої речовини в розчині, масу розчиненої речовини і масу розчинника пропоную
- переглянути відео за посиланням:
https://www.youtube.com/watch?v=Z7SDF-OMN-Y.
- підкріпити інформацію з відео опрацювавши інформацію за підручником, а саме, опрацювавати приклади розв’язання задач в підручнику § 33 (О.Г. Ярошенко. Хімія 7 клас) або у відповідних підручниках, за якими працюєте.
Посилання на підручники : https://imzo.gov.ua/pidruchniki/elektronni-versiyi pidruchnikiv/elektronni-versiyi-pidruchnikiv-dlya-uchniv-7-h-klasiv-2/himiya-7-klas/
При опрацюванні алгоритму розв’язування задачі:
- прочитайте текст задачі;
- запишіть скорочено умову задачі;
- запишіть формулу для обчислення масової частки речовини в розчині, маси розчиненої речовини чи маси розчинника;
- підставте в отриманий вираз чисельні дані з умови задачі та здійсніть розрахунки;
- напишіть відповідь.
За зразком у підручнику розв'яжіть задачі .
- Обчисліть масову частку розчиненої речовини в розчині, який утворюється в результаті змішування 20 г цукру і 180 г води (10%).
- Обчисліть масу йоду, необхідного для приготування 150 грамів його спиртового розчину з масовою часткою йоду 5% (7,5 г)
Якщо б ми проводили урок в класі, то обов’язково виконували б лабораторну роботу по виготовленню розчинів, так як людина за життя постійно використовує або готує розчини:
Наочні приклади використання розчинів у побуті та житті людини зображені на малюнку:

І тому потрібно знати як виготовляти розчини і вміти це робити кожному
Оскільки, урок дистанційний то знайомимось з алгоритмом дій, що викладений у інструкції до лабораторної роботи по виготовленню розчинів.
Виготовлення розчину.
- Опрацюйте § 35 (О.Г. Ярошенко. Хімія 7 клас)
- Переглянте демонстрацію за посиланням
https://www.youtube.com/watch?v=ZFC73sABqrM
Повторення правил техніки безпеки під час проведення хімічного експерименту - приготування розчинів.
Для виготовлення розчину з певною масовою часткою розчиненої речовини необхідно:
- речовина, яку розчиняють;
- розчинник;
- посуд для виготовлення розчину (хімічний стакан, колба, мірний циліндр);
- ложечка для насипання речовин;
- скляна паличка для перемішування розчину (прискорити розчинення речовини);
- терези, різноважки;
- мірний циліндр
- за необхідності фільтрувальний папір, лійка, ступка з товкачиком

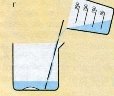
Щоб приготувати розчин необхідно провести обчислення маси розчиненої речовини та розчинника, потім визначити об’єм розчинника. На терезах зважити масу розчиненої речовини, мірним циліндром відміряти певний об’єм розчинника. Розчинену речовину висипати у хімічний стакан, долити розчинник. Для прискорення розчинення суміш перемішати скляною паличкою. Перед виготовленням розчинів тверді речовини зазвичай подрібнюють. За потреби (поясніть, коли вона виникає) готовий розчин фільтрують.
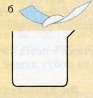
Задача. Виготовити 20 г розчину кухонної солі (натрій хлориду) з масовою часткою розчиненої речовини 5%.
План виготовлення розчину
|
Послідовність роботи |
Обчислення |
|
m(солі) = 20 х 0, 05 = 1 г |
|
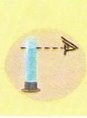
а) m (р-ка) = m(р-ну) - m (р. р.) m(Н₂О) = 20 – 1 = 19 (г) б) ρ(Н₂О) = 1 г/мл V(Н₂О) = m:ρ = 19 г : 1 г/мл = 19 мл |
|
|
|
|
|
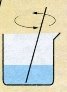
5. Для прискорення розчинення суміш перемішуємо скляною паличкою
|
|
У хімічних лабораторіях навчальних закладів порції твердих речовин зважують на терезах із погрішністю (для навчальних цілей) не більш 0,1-1 г. У хімічних і фармацевтичних лабораторіях використовують високоточні електронні терези. Розчинення здійснюють у чистому посуді, який не взаємодіє з розчином.
Виготовлення розчинів потребує точності, акуратності й попереднього проведення правильних математичних розрахунків. Усі ці якості та вміння знадобляться вам не лише під час виконання лабораторних дослідів по приготуванню розчинів, а й у повсякденному житті.
Запам'ятайте! Тривале й неправильне зберігання може призвести до псування розчину аж до повної непридатності - появи пластівців і каламуті, зміни кольору й складу, тощо.
ІV. Закріплення
Теоретичні завдання: відповісти на теоретичні питання в кінці §33 . (О.Г. Ярошенко. Хімія 7 клас), або відповідного § підручника, за яким працюєте.
Посилання на підручники https://imzo.gov.ua/pidruchniki/elektronni-versiyi pidruchnikiv/elektronni-versiyi-pidruchnikiv-dlya-uchniv-7-h-klasiv-2/himiya-7-klas/
Практичні завдання:
Виконати тести за посиланням:
https://naurok.com.ua/test/kilkisniy-sklad-rozchinu-masova-chastka-rozchineno-rechovini-163867.html - посилання на завдання для вчителя
https://naurok.com.ua/test/start/163867 - посилання для виконання завдань учням
Творчі завдання:
- Домашній експеримент .
Виготовлення водного розчину кухонної солі. (О.Г. Григорович Хімія. 7 клас с. 159 ) .
Посилання на підручники https://imzo.gov.ua/pidruchniki/elektronni-versiyi pidruchnikiv/elektronni-versiyi-pidruchnikiv-dlya-uchniv-7-h-klasiv-2/himiya-7-klas/


про публікацію авторської розробки
Додати розробку