Конспект уроку "Ковалентний зв'язок та його утворення. Полярний і неполярний ковалентний зв'язок"
Урок розроблений учасником Всеукраїнського конкурсу «Учитель року – 2020» у номінації «Хімія» (лавреатом (ІІ місце) першого туру у м. Кропивницький) та проведений 22.11.2019 у рамках конкурсу.
Мета уроку: поглибити знання учнів про види хімічного зв'язку на прикладі ковалентного зв'язку, пояснити механізм його утворення, навести приклади речовин із ковалентним (полярним і неполярним) хімічним зв'язком; розвивати самостійність, вміння аналізувати, формувати критичне мислення, удосконалювати навички й уміння складати формули речовин; формувати інтерес до хімії, науковий світогляд.
Регіональний центр професійної освіти ім. О.С. Єгорова
Конспект уроку з хімії (8 клас)
на тему:
«Ковалентний зв'язок
та його утворення.
Полярний і неполярний ковалентний зв'язок»
Підготувала:
Іщенко Ольга Василівна
 викладач хімії і біології,
викладач хімії і біології,
учасник конкурсу
«Учитель року – 2020»
у номінації «Хімія»
Дата проведення уроку: 22.11.2019
»
Тема програми: Хімічний зв'язок і будова речовини.
Тема уроку: Ковалентний зв'язок та його утворення. Полярний і неполярний ковалентний зв'язок».
Мета уроку:
- поглибити знання учнів про види хімічного зв’язку на прикладі ковалентного зв’язку, пояснити механізм його утворення, навести приклади речовин із ковалентним (полярним і неполярним) хімічним зв’язком,
- розвивати самостійність, вміння аналізувати, формувати критичне мислення, удосконалювати навички й уміння складати формули речовин.
- формувати інтерес до хімії, науковий світогляд.
Тип уроку: комбінований урок.
Методи та методичні прийоми: прийоми «Девіз творчих і винахідливих», «Зірка уроку», «Історична довідка» та «Лайк», ігри «Перший мільйон» та «Хімічний куб», робота біля дошки, пояснення викладача, фізхвилинка, складання схеми, відгадування загадок, вправа «Відповідність».
Базові поняття: ковалентний зв'язок, неполярний зв'язок, полярний зв'язок.
Засоби навчання: інтерактивна дошка, презентація викладача, інструктивні картки, дидактичні засоби до прийомів та ігор.
Ключові компетентності: основні компетентності у природничих науках і технологіях, спілкування державною мовою, уміння вчитись впродовж життя, ініціативність.
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ МОМЕНТ
Привітання викладача, перевірка присутніх та готовності учнів до уроку, створення робочої атмосфери.
Прийом «Девіз творчих і винахідливих» (позитивне налаштування) (слайд 1)
Викладач. Ну що ж, починаємо урок, а на уроці ми…
Уважні!
Розумні!
 Організовані!
Організовані!
Кмітливі!
Прийом «Зірка уроку» (слайд 2)
Викладач. Сьогодні ми будемо визначати «Зірку уроку». Хто за результатами нашої роботи буде мати найбільшу кількість зірочок, отримає статус «Зірка хімії».
ІІ. ПЕРЕВІРКА ДОМАШНЬОГО ЗАВДАННЯ
 Гра «Перший мільйон» (слайд 3)
Гра «Перший мільйон» (слайд 3)
- Швидке тестування за допомогою вправи на LearningApps.org (використати посилання за QR-кодом: зісканувати код мобільним пристроєм і перейти до вправи).
- Учні за допомогою ґаджетів або фронтально на інтерактивній дошці виконують вправу.
https://learningapps.org/display?v=pqh8g1xxt19
ІІІ. Мотивація навчально-ПІЗНАВАЛЬНОЇ діяльності
Прийом «Історична довідка» (слайд 4)
Випереджувальне завдання, повідомлення учня
Учень. Тривалий час дослідники намагались пояснити, яким чином атоми елементів об’єднуються в молекули та утворюють речовини.
1907 року вчений Микола Олександрович Морозов, а 1916 року американський фізико-хімік Джек Льюїс висловили припущення, що хімічний зв’язок може утворюватись, якщо виникає спільна пара електронів, що одночасно належить двом атомам.
У 1927 році німецькі дослідники фізик-теоретик Фрик Лондон та фізик і хімік-теоретик Вальтер Гейтлер розрахували, що під час зближення атомів, електрони яких мають спіни, направлені в протилежні боки, наростає сила притягання, але до певного моменту, доки наступить відштовхування ядер.
Викладач. Чи вірними були припущення дослідників про те, що хімічний зв'язок виникає в результаті утворення спільної електронної пари ми з’ясуємо на уроці.
ІV. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Гра «Хімічний куб» (слайд 5)
Умова полягає в тому, що Вам пропонується завдання («Будова атома»). Бажаючий повинен підкинути куб. Залежно від того, на яку цифру Ви натрапите, таку відповідь Ви повинні дати.
Завдання: дати відповідь на запитання.
![]() – правило октету
– правило октету
![]() – завершений енергетичний рівень
– завершений енергетичний рівень
![]() – причина потреби атома в завершеності зовнішнього рівня
– причина потреби атома в завершеності зовнішнього рівня
![]() – елементи, які мають повністю завершений зовнішній рівень
– елементи, які мають повністю завершений зовнішній рівень
![]() – загальна назва елементів VIII гр. ПСХЕ
– загальна назва елементів VIII гр. ПСХЕ
![]() – причина загальної назви елементів VIII гр. ПСХЕ
– причина загальної назви елементів VIII гр. ПСХЕ
Відповіді на запитання гри:
- Правило октету (Атом на зовнішньому енергетичному рівні прагне містити 8 елект-ронів, щоб набути завершеності).
- Завершений енергетичний рівень (Енергетичний рівень, заповнений максимально можливою для нього кількістю електронів.)
- Причина потреби атома в завершеності зовнішнього рівня (У такому стані атоми не вступають в хімічні реакції, мають найнижчий, найстійкіший і енергетично вигідніший енергетичний стан.)
- Елементи, які мають повністю завершений зовнішній рівень (Елементи VIII гр. ПСХЕ).
- Загальна назва елементів VIII гр. ПСХЕ (Інертні або благородні гази).
- Причина загальної назви елементів VIII гр. ПСХЕ(Вони не вступають в хімічні реакції.)
V. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Утворення ковалентного зв’язку. Ковалентний неполярний зв’язок.
Робота біля дошки
Викладач. Давайте пригадаємо електронну форму і графічну схему будови атома Гідрогену (учень на дошці записує електронну та графічну будови атома Гідрогену і робить висновок про його здатність утворювати хімічні зв’язки).
![]()
![]()
1Н +1 ) ls22s1
1e
Пояснення викладача
Під час утворення хімічного зв’язку атоми намагаються, щоб на їх зовнішньому енергетичному рівні було два або вісім електронів. Цього можна досягти декількома способами. Найпоширеніший з них полягає в об’єднанні неспарених електронів у спільні електронні пари, які будуть належати обом атомам
При зображенні утворення хімічного зв’язку електрони зовнішнього енергетичного рівня позначають крапкою або хрестиком.
Розглянемо, як же утворюється хімічний зв’язок в молекулі водню (Слайд 4)
В утворенні молекули водню беруть участь два атоми Гідрогену, які намагаються добудувати свій зовнішній енергетичний рівень за рахунок іншого атома. Кожен атом намагатиметься притягнути на свою електронну оболонку додатковий електрон і таким чином отримати електронну конфігурацію найближчого інертного газу – Неону. Під час взаємного притягання ядер атомів та електронних оболонок дві s-орбіталі перекриваються і в місцях перекривання утворюється підвищена електронна густина.
Утворення молекули водню можна записати у вигляді схеми:
(слайд 6)
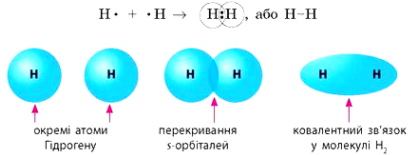
Мал. 1. Електронні орбіталі (1s) окремих атомів Гідрогену і їх перекривання.
Н• + •Н → Н : Н такі формули називають формулами Льюїса, або електронно-
крапковими формулами
Отже, кожний атом Гідрогену віддає свій електрон у спільне користування. При цьому утворюється спільна пара, що одночасно рівномірно належить обом атомам Гідрогену.
Хімічний зв’язок, що виникає в результаті утворення спільних електронних пар, називають ковалентним (слайд 7).
Спільну електронну пару, що обумовлює хімічний зв’язок, можна позначити рискою. Таким чином виходить структурна формула .
У молекулі водню електронна густина хімічного зв’язку, як вже вище згадувалось, знаходиться на однаковій відстані від обох ядер і в однаковій мірі належить обом атома.
Хімічний зв’язок, в якому відсутнє зміщення спільних електронних пар в бік одного з атомів, називається ковалентним неполярним. Характерний для атомів з однаковою електронегативністю.
Завдання: скласти схему утворення зв’язку молекули хлору.
Фізхвилинка (вправа для очей)
2. Утворення зв’язку між різними атомами неметалів. Ковалентний полярний зв’язок.
Ковалентний зв’язок також може утворюватися між атомами різних хімічних елементів. Розглянемо його на прикладі молекули гідроген хлориду.
У цій молекулі атом Гідрогену за рахунок неспареного електрона атома Хлору завершує перший енергетичний рівень, а атом Хлору за рахунок атома Гідрогену завершує другий енергетичний рівень. Таким чином, утворюється спільна електронна пара.
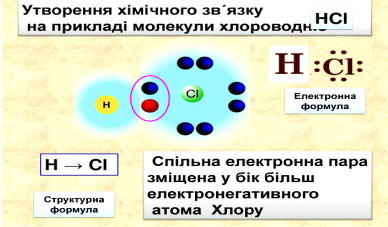 (слайд 8)
(слайд 8)
Оскільки атоми Гідрогену та Хлору володіють різною електронегативність, то їхня спільна електронна густина хімічного зв’язку буде зміщена в сторону більш електронегативного атома, тобто атома Хлору. Таким чином на атомі Хлору виникатиме частковий негативний заряд («δ–»), а на атомі Гідрогену частковий позитивний заряд («δ+»).
(Слайд 12 )
Хімічний зв’язок, в якому одна чи кілька спільних пар зміщені в бік одного з атомів, називається ковалентним полярним зв’язком.
V. Узагальнення й систематизація знань
Складання схеми
Завдання: скласти опорну схему «Ковалентний зв'язок». (слайди 9-10)
Очікувана відповідь учнів.

Відгадування загадок (слайди 11-15)
Завдання: відгадати загадки про хімічний зв'язок.
Атомів взаємодія –
Це і сила, і надія,
Бо це явище фізичне,
А зв’язок назвіть логічно. (хімічний)
У зв’язку, що є надійним
Пари електронів спільні
Як конкретно він зоветься?
Назва нескладна, здається (ковалентний)
Цей зв’язок, що ви не знали
Любить дуже все до пари
Навіть має власні види,
В нього два їх різновиди.
Відгадай слова новенькі,
Адже відповідь простенька. (полярний і неполярний)
Є молекула хлор-два
І нічого більш нема.
Як у ній зв’язок назвати?
Вам всім треба написати. (ковалентний неполярний)
Ось аш-хлор-сполука чемна,
Формула – проста, приємна
Та який у ній зв’язок?
Думай, вчися весь урок. (ковалентний полярний)
Вправа «Відповідність» (слайд 16)
Завдання: заповнити «мішки», розподіливши формули сполук за типом хімічного зв’язку.
S8, SiO2, CCl4, O2, N2, CO, SO2, H2O, P, NH3, CH4
|
|
|
|
|
|
VI. ПІДСУМОК УРОКУ
Прийом «Лайк» (слайд 17)
- За допомогою значків «Лайк» чи «Антилайк» учні оцінюють свою роботу на уроці.
 Мені сподобалося ...
Мені сподобалося ...
Для мене стало новим ...
Мене здивувало ...
У мене вийшло ...
 Мені не сподобалось …
Мені не сподобалось …
У мене не вийшло …
Я не зрозумів …
VІI. ВИСТАВЛЕННЯ ОЦІНОК ТА ЇХ Обґрунтування
- За кількістю отриманих «зірочок» визначається «Зірка хімії» та оцінюються активні учні класу на уроці. (слайд 18)
VIІІ. ІНСТРУКТАЖ З ДОМАШНЬОГО ЗАВДАННЯ
Початковий рівень: опрацювати конспект та підручник Хімія (Попель П.П., Крикля Л.С.): §15-16, с. 78-86.
Середній рівень: дати відповідь на запитання
§15, №№ 98-100 (с. 82-83).
Достатній рівень: виконати завдання §16, №107 (с.86).
Високий рівень: використовуючи газети, журнали, інтернет-ресурси чи інші медіа джерела, підготувати повідомлення (презентацію) на теми «Речовини з ковалентним хімічним зв'язком» та/або скласти кросворд з теми «Ковалентний хімічний зв'язок».
1


про публікацію авторської розробки
Додати розробку


