Конспект уроку з фізики для 7 класу на тему "Етапи становлення та основні положення атомно-молекулярного вчення про будову атома.
Урок засвоєння нових знань з використанням технології особистісно орієнтованого навчання, інтерактивних технологій та ІКТ з використанням методів та прийомів: дослідницький, пояснювально-ілюстративний, евристичний (частково-пошуковий), вправа «Настрій», робота в групах, ігри «Хто швидше?», «Зобрази мене», прийоми «Навчаючи - учуся», «Знайди помилку», повідомлення учня, розповідь вчителя, вправа «Склади розповідь», бесіда, самооцінювання.
Автор уроку: Павлова Оксана Іванівна, учитель фізики Лукашівського НВК, спеціаліст вищої категорії.
Предмет: фізика.
Клас: 7.
Тема уроку: Етапи становлення та основні положення атомно-молекулярного вчення про будову атома.
Мета уроку:
- Освітня: Ознайомитися з основними етапами розвитку вчення про будову атома, її творцями; пояснити основні положення атомно-молекулярного вчення про будову речовини.
- Розвивальна: розвивати увагу, пам'ять, вміння працювати в групі, аналізувати та робити висновки, прищеплювати навички інтелектуальної праці. Сприяти формуванню в учнів діяльнісної, предметної, комунікативної, саморозвитку та самоосвіти компетентностей.
- Виховна: показати історичну обумовленість фізичного пізнання, внесок зарубіжних і вітчизняних науковців у становлення та розвиток вчення про будову атома, сприяти формуванню фізичної картини світу, інформаційної культури.
Очікувані результати: учень (учениця):
знає й розуміє: основні положення атомно-молекулярного вчення про будову речовини; етапи розвитку вчення про будову атома;
уміє: пояснити атомно-молекулярну будову речовини;
виявляє ставлення й оцінює: історичну обумовленість фізичного пізнання, внесок зарубіжних і вітчизняних науковців у становлення та розвиток вчення про будову атома.
Тип уроку: урок засвоєння нових знань з використанням технології особистісно орієнтованого навчання, інтерактивних технологій та ІКТ.
Методи та прийоми: дослідницький, пояснювально-ілюстративний, евристичний (частково-пошуковий), вправа «Настрій», робота в групах, ігри «Хто швидше?», «Зобрази мене», прийоми «Навчаючи - учуся», «Знайди помилку», повідомлення учня, розповідь вчителя, вправа «Склади розповідь», бесіда, самооцінювання.
Випереджувальні завдання: підготувати повідомлення «Цікаві фрази Резерфорда»
Обладнання: Комп’ютер, підручник, таблиця Менделєєва, світлини вчених і філософів: Демокріта, Арістотеля, Дальтона, Ломоносова, Менделєєва, Томсона, Резерфорда, Чедвіка.
Місце проведення: кабінет фізики (наявність комп’ютера)
Оформлення дошки:
По центру: запис теми уроку.
Зліва: епіграф «Відшукай всьому початок, і ти багато зрозумієш». (Козьма Прутков)
Справа: правила роботи в групах
План уроку
І. Мотиваційний етап
1. З’ясування емоційного настрою. Вправа «Настрій»
2. Актуалізація опорних знань.
ІІ. Етап цілевизначення і планування діяльності.
- Ознайомлення з темою, метою, епіграфом уроку
2.Узгодження цілей і плану уроку.
ІІІ. Опрацювання навчального матеріалу.
1. Фронтальне опитування — ланцюгова реакція.
2. Гра «Хто швидше?».
3. Повторення правил роботи учнів групах.
4. Ознайомлення з прийомом інтерактивного навчання «Навчаючи – учуся».
5. Робота в групах. Прийом інтерактивного навчання «Навчаючись – учусь».
6. Фізкультхвилинка «Руханка».
7. Розповідь вчителя «Це цікаво!».
8. Повідомлення учня «Цікаві фрази Резерфорда».
9. Гра «Зобрази мене».
10. Робота в парах. Прийом «Знайди помилку».
ІV. Рефлексивно-оцінювальний етап.
1. Вправа «Склади розповідь».
2. Бесіда.
3. Самооцінювання. Прийом «Драбинка успіху»
Хід уроку
І. Мотиваційний етап
1. З’ясування емоційного настрою. Вправа «Настрій».
- На берегах зошита позначте впевненість чи невпевненість у самостійному опрацюванні матеріалу ,виконанні завдань, готовність до співпраці, роботі в групах, розуміння навчального матеріалу(слайд 1):
|
|
|
настрій прекрасний |
|
|
|
настрій хороший |
|
|
|
не дуже готовий до уроку |
|
|
|
не дуже добре почуваюся, хворий |
|
|
|
готовий до уроку |
|
|
|
хочеться творити |
2. Актуалізація опорних знань.
Я знаю, що деякі знання про атом у вас вже є. Протягом однієї - двох хвилин напишіть на аркушах оповідання «Все про нього…» (про атом).
ІІ. Етап цілевизначення і планування діяльності.
1. Ознайомлення з темою, метою, епіграфом уроку (Слайди 2-3)
Наше століття не випадково називається атомним. Всім нам добре знайомі такі поняття, як атомна електростанція, атомні кораблі, атомна бомба, атомна енергія і т.д. Вчення про атоми стало важливою областю фізики. І хоча світ атома ніхто не бачив, але тим не менш, він реальний. Життя ставить перед нами багато питань. Деякі розв’язуються дуже просто, проте над іншими людство б’ється тисячі років. Наприклад, над таким «Як побудований світ. Із чого все складається?». Зараз нас це вже не дивує. Нас не дивує те, що всі тіла складаються з дрібних частинок. Але так було не завжди. І от сьогодні протягом уроку ми познайомимося з відповідями на ці питання. Як сказав колись Козьма Прутков «Відшукай всьому початок, і ти багато зрозумієш»
2.Узгодження цілей і плану уроку.
ІІІ. Опрацювання навчального матеріалу.
1. Фронтальне опитування — ланцюгова реакція.
Атом — головний об'єкт нашого уроку. Але, перш ніж перейти безпосередньо до вивчення теми, пригадаємо, що ж ми про знаємо про це поняття.
- Що означає слово «атом»?
- Хто ввів це поняття у фізику?
- З чого складається атом?
- Що відомо про розміри атома?
- Як описати рух атомів в різних агрегатних станах речовини?
- Які явища є доказом того, що всі тіла складаються з атомів та молекул?
2. Гра «Хто швидше?»
Вставити пропущені слова
- Об’єднання атомів утворюють молекули - найменші частинки речовини, що мають всі його хімічні властивості.
- Атом – найменша частка речовини мікроскопічних розмірів і маси, яка є носієм його властивостей.
- Атоми знаходяться в безперервному русі.
- Притягуються на відстанях більших за розмір атома, але відштовхуються, коли наближати їх одне до одного.
- Всі види атомів відображені в таблиці Менделєєва. Кожний має своє «місце», свій порядковий номер, свою атомну масу.
- В центрі атома знаходиться позитивно заряджене ядро (складається з протонів (+ заряджені) і нейтронів (не мають заряду)). Навколо ядра по орбітах рухаються електрони (негативно заряджені).
- Кількість протонів і електронів в атомі, що знаходиться в звичайному стані, є однаковою. Тому атом є нейтрально зарядженим.
- Йони – атоми, з надлишковою або недостатньою кількістю електронів.
- Броунівський рух – рух зважених в рідині або газі частинок (пилок квітів) або хаотичний рух атомів, молекул.
(взаємомоперевірка)
3. Повторення правил роботи учнів групах. (правила на дошці)
Атомарне вчення пройшло довгий і складний шлях. І сьогодні ми з вами ознайомимось з деякими основними етапи розвитку цього вчення. Яскравий слід у вивченні будови атома залишили такі вчені, Джозеф Джон Томсон, Ернест Резерфорд та Джеймс Чедвік (їхні світлини на дошці). І , як ви вже бачите, працювати ми будемо в групах. У вас на партах правила роботи в групах. Уважно прочитайте і намагайтесь дотримуватись їх.
4. Ознайомлення з прийомом інтерактивного навчання «Навчаючи – учуся»
Один мудрець сказав: «Якщо двоє людей обмінялись двома золотими монетами, вони не стали багатшими, а якщо обмінялись знаннями – стали розумнішими і знання їхні глибшими!» (Слайд 4)
А чи хотілося вам колись виступати в ролі учителя, розповідати самому щось неймовірно цікаве, корисну інформацію товаришу? На сьогоднішньому уроці ви будете мати змогу передати свої знання іншим, а значить зробити так, щоб і ваші знання стали глибшими. На партах кожної групи розробка «Основні етапи розвитку уявлень про будову атома» (кожен етап відповідає номеру групи). Ви повинні ознайомитися з інформацією для вашої групи, обговорити її, вибрати одного представника, який повідомить цю інформацію іншій групі. Друга і третя група – теж саме. (Слайд 5)
5. Робота в групах «Навчаючись – учусь»
ГРУПА 1. етап І  Гіпотеза про існування атома як неподільної частинки.
Гіпотеза про існування атома як неподільної частинки.
Поняття атом, як і саме слово, має давньогрецьке походження, хоча істинність гіпотези про існування атомів знайшла своє підтвердження лише в 20 столітті. Основною ідеєю, яка стояла за даним поняттям протягом всіх сторіч, було уявлення про світ як про набір величезної кількості неподільних елементів, які є дуже простими за своєю структурою і існують від початку часів.
Історія зберегла ім`я стародавнього атоміста Сидонського, який жив у ХІІст. до н.е. На ті ж часи припадає поява «Книги змін» китайського вченого Вен Ванга, в якій поряд із вченням про протилежні начала (інь, янь) міститься також вчення про первісну матерію та її найдрібніші частинки «ці».
Першим почав проповідувати атомістичне вчення в 5 столітті до нашої ери філософ Левкіпп. Потім естафету підхопив його учень Демокріт. Збереглися лише окремі фрагменти їх робіт, з яких стає зрозумілим, що вони виходили з невеликої кількості досить абстрактних фізичних гіпотез: «Солодкість і гіркота, спека і холод смисл визначення, насправді ж [тільки] атоми і пустота». За Демокрітом, вся природа складається з атомів, найдрібніших часток речовини, які спочивають чи рухаються в абсолютно пустому просторі. Всі атоми мають просту форму, а атоми одного сорту є тотожними; різноманіття природи відображає різноманіття форм атомів і різноманіття способів, в які атоми можуть зчіплюватись між собою. І Демокріт, і Левкіп вважали, що атоми, почавши рухатись, продовжують рухатись по законам природи. Через покоління після Демокріта, Платон запропонував своє рішення цієї проблеми: «найдрібніші частки належать не царству матерії, а царству геометрії; вони являють собою різні тілесні геометричні фігури, обмежені плоскими трикутниками». А його учень Арістотель вважав, що процес поділу речовини може бути нескінченним.Такий підхід на багато століть став домінуючим, а вчення Демокріта забули майже на 2000 років, його праці збереглися лише у фрагментах, а людство знає про них із поем давньогрецького поета Лукреція «Про природу речей». Але не всі філософи, вчені підтримували ідею існування атома.
Наприклад, Арістотель вважав, що світом керують чотири «начала»: вода, земля, повітря і вогонь. А «началом» всіх «начал» є Бог. Він визнавав об'єктивне існування матеріального світу і його пізнаваність, але протиставляв земний і небесний світи, вірив і вчив вірити в існування божественних сил.
Історичний факт: під тиском церкви у 1626 р. Паризький парламент під загрозою страти заборонив атомістичну теорію (теорію про існування атома).
Протягом багатьох століть після цього не було висловлено ніяких нових ідей про структуру матерії. Наукова думка у цьому напрямі почала відроджуватися тільки у 17 ст.
ГРУПА 2 етап ІІ Експериментальне підтвердження існування атома.
 До середини ХІХ ст.. вже не існувало сумнівів, що атом існує, хоча і вважався неподільним.
До середини ХІХ ст.. вже не існувало сумнівів, що атом існує, хоча і вважався неподільним.
В 1808 році Джон Дальтон (англійський шкільний вчитель математики) відродив атомізм. Припустив, що всі атоми певного хімічного елемента в точності однакові, а атоми різних елементів можна відрізняти один від одного за їх масою. Було встановлено, що 1 атом кисню в 16 разів більший по масі атому водню (вуглецю – в 12; заліза – в 56 разів)
1869 р. - Дмитрій Іванович Менделєєв систематизував знання про атоми в таблиці періодичних елементів хімічних елементів. Існування атома підтверджувалось експериментально багатьма вченими.
1. Михайло Васильович Ломоносов (заклав основи молекулярно-кінетичної теорії (МКТ) газів, які пізніше були підтверджені експериментально).
2. Бенджамін Франклін – один із засновників США, політичний діяч, дипломат, вчений. Досліджував торію електричного струму, довів електричну будову блискавки. В його роботах вперше з’являються терміни: заряд, позитивний і негативний заряд та інші.
3. Амедео Авогадро отримав уявлення про розміри і масу атомів.
4. Роберт Браун спостерігав у мікроскоп хаотичний рух зважених частинок (пилок квитів) в рідині. Побудував теорію Броунівського руху в 1905 р.
Етап «Експериментального підтвердження існування атома» тривав до
1897 р. В цьому році Джон Томсон відкрив нову частинку, що входила до ядра кожного атома – електрон.
ГРУПА 3. етап ІІІ Дослідження будови атома (з 1897 р.)
Перші моделі атомів мали одну схожість: всі вони були нейтральні за зарядом (позитивний і негативний заряди містилися в однаковій кількості). Кожна з моделей могла пояснити ряд фізичних явищ, але виникали проблеми при поясненні інших.
1897 - Експерименти Томсона показали:
- електрон входить до складу всіх атомів. Таким чином, атоми є складними частками, вони складаються з інших, простіших часток.
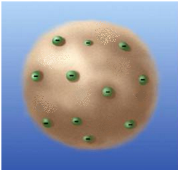
1903 – Модель атома Томсона (модель пудингу).
1. Атом – куля, по всьому об’єму якої рівномірно розміщений позитивний заряд – «пудинг».
2. Всередині кулі і на її поверхні знаходяться електрони, що можуть здійснювати коливальні рухи біля свого положення рівноваги – «родзинки».
3. Позитивний заряд кулі по модулю дорівнює заряду електронів, тому заряд атома в цілому дорівнює 0.
Висновок. Модель пояснювала деякі фізичні властивості речовини. Модель потребувала експериментальної перевірки.
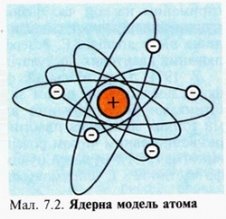
Модель атома Резерфорда.
Учень Томсона Ернест Резерфорд проводив експерименти по розсіюванню а-частинок. В результаті була «створена» нова модель атома (Планетарна модель атомна, ядерна модель атома, модель атома Резерфорда). Згідно Резерфорду, атом за своєю будовою нагадує Сонячну систему. Подібно до того як планети, притягаючись до Сонця, рухаються навколо нього, так і електрони в атомі рухаються навколо ядра, утримувані силами тяжіння до нього. Через ці подібності модель будови атома, запропоновану Резерфордом, назвали планетарною моделлю.
- Атом не є суцільним як в моделі Томсона.
- Існує атомне ядро, тобто тіло малих розмірів, в якому сконцентрована майже вся маса атома і весь позитивний заряд.
- Навколо ядра на «великій» відстані в порівнянні з розміром ядра, обертаються негативно заряджені електрони, що втримуються біля нього силами (притягуються) і утворюють електрону оболонку.
- Негативний заряд всіх електронів розподілений по всьому об’єму атома.
Резерфордовськая, або ядерна, модель атома, витіснивши томсоновську модель, з'явилася важливим етапом на дорозі створення нових розділів фізики. Деякі деталі, перенесені з томсоновськой моделі, такі, як існування в ядрі електронів, пізніше також були відкинуті.
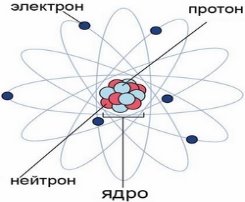 У 1920 році Джеймс Чедвік (20.10.1891-24.07.1974) , англійський фізик-експериментатор, член Лондонського королівського товариства, підтвердив теорію атома Резерфорда і зробив висновок про те, що заряд ядра атома дорівнює порядковому номеру елемента в таблиці Менделєєва. У 1932 році виявив частинки, які відрізняються від протонів електричними властивостями, але дуже близькі до них за масою та розмірами. Він назвав ці частинки нейтронами. А також довів, що ядра атомів теж подільні! Вони складаються із протонів і нейтронів, які зв’язані між собою потужною ядерною взаємодією, а їхня кількість у різних елементів – різна.
У 1920 році Джеймс Чедвік (20.10.1891-24.07.1974) , англійський фізик-експериментатор, член Лондонського королівського товариства, підтвердив теорію атома Резерфорда і зробив висновок про те, що заряд ядра атома дорівнює порядковому номеру елемента в таблиці Менделєєва. У 1932 році виявив частинки, які відрізняються від протонів електричними властивостями, але дуже близькі до них за масою та розмірами. Він назвав ці частинки нейтронами. А також довів, що ядра атомів теж подільні! Вони складаються із протонів і нейтронів, які зв’язані між собою потужною ядерною взаємодією, а їхня кількість у різних елементів – різна.
- Обговорення матеріалу в групах;
- Визначення учня, який повідомить інформацію іншій групі;
- Робота в групах по опрацюванні нової інформації;
- Повернення учнів у свою групу;
- Повідомлення класу того, про що дізнались при спілкуванні.
6. Фізкультхвилинка «Руханка»
7. Розповідь вчителя «Це цікаво!»
Модель атома, якою ми будемо користуватись на уроках фізики, була створена на початку ХХ ст. Ернестом Резерфордом. В чому проблема? (розміри атома)
Маємо три об’єкти: атом, яблуко, Земна куля.
Уявіть собі!!!
- Якщо ядро атома збільшити до розмірів яблука, то саме яблуко, збільшене в стільки ж разів, збільшиться до розмірів Земної кулі.
- Якщо ядро атома збільшити до розмірів яблука, то відстань від ядра до електронів буде порядку 1 км.
- Підраховано, що якби всі електрони примкнули впритул до атомних ядер, то об'єм тіла дорослої людини став би рівним однієї мільйонної частці кубічного міліметра! Це означає, що більше 99% усередині тіла людини (як і будь-якого іншого тіла) займає порожнеча!
В 2009 р. група дослідників Харківського Фізико-Технічного Інституту за допомогою наднового електронного мікроскопа, отримала зображення електронних хмар атома вуглецю. Як можна бачити, навіть із сучасною технікою «заглянути» в середину атома не має можливості.
- Який висновок можна зробити? (Атоми не можна побачити «прямим» шляхом. Наші знання про будову атома засновані на величезній кількості експериментальних даних. Фізика – експериментальна наука. Важко переоцінити внесок вчених у становлення та розвиток атомно – молекулярного знання)
8. Повідомлення учня «Цікаві фрази Резерфорда»
…За сімейною легендою, одержавши довгоочікувану телеграму з Англії, яка сповіщала юного вченого про те, що йому присуджено стипендію для навчання в Кембриджі, у себе вдома, в Новій Зеландії, на городі, відкинув лопату й викликнув: «Це остання в житті картопля, яку я викопав!»
… Резерфорд так описував свої результати: «Я повинен зізнатися по секрету, що не вірив, що таке можливо. Це було майже настільки неправдоподібно, як те, наприклад, що ви зробили постріл по клаптику газети 15-тидюймовим снарядом, а він повернувся б назад і влучив у вас».
…Одного разу під час лекції, заплутавшись у математичних викладках, поклав крейду й спокійно вимовив: «Якщо зробити все правильно, то вийде так, як я сказав».
…На черговий комплімент на свою адресу: «Ви завжди на гребені хвилі!» - відгукнувся: «А хіба не я піднімаю цю хвилю?»
9. Гра «Зобрази мене»
Будь-яка ідея має свого автора. Частіше за все це надзвичайно допитливі та безмежно знаттєлюбні люди, які настирливо шукають собі проблеми. Зараз і ви пройдете такий етап – етап автора ідеї. Перед вами текст з описом моделі будови атома за Томсоном, Резерфордом та Чедвіком. Спочатку уважно читаєте, а потім робите зображення моделі на аркушах паперу .
|
Джозеф Джон Томсон (18.12.1856-30.08.1940) – англійський фізик, член Лондонського королівського товариства. У 1897 році експериментально довів існування електрона, дрібну частинку, яка у 2000 разів менша за атом. Визначив її масу і заряд. У 1903-1904 роках висунув гіпотезу про те, що атом являє собою позитивно («+») заряджену сферу, всередині якої знаходяться електрони («–»). Вчені назвали цю модель «пудинг з родзинками» («пирог с изюмом») |
|
Ернест Резерфорд (30.08.1871-18.11.1937) – англійський фізик, основоположник ядерної фізики, член Лондонського королівського товариства. У 1911 році експериментально обґрунтував ядерну модель атома: в центрі знаходиться позитивне ядро, а навколо обертаються негативні електрони. Ця модель носить назву «планетарна модель атома». |
|
Джеймс Чедвік (20.10.1891-24.07.1974) – англійський фізик-експериментатор, член Лондонського королівського товариства. У 1920 році підтвердив теорію атома Резерфорда і зробив висновок про те, що заряд ядра атома дорівнює порядковому номеру елемента в таблиці Менделєєва. У 1932 році виявив частинки, які відрізняються від протонів електричними властивостями, але дуже близькі до них за масою та розмірами. Він назвав ці частинки нейтронами. А також довів, що ядра атомів теж подільні! Вони складаються із протонів і нейтронів, які зв’язані між собою потужною ядерною взаємодією, а їхня кількість у різних елементів – різна. |
Самоперевірка (Слайди6-8 )
10. Робота в парах.
Знайди помилку в тексті «Основні положення атомно-молекулярного вчення»
На уроках природознавства та на минулому уроці фізики ми вже говорили про основні положення атомно-молекулярного вчення. А тепер розуміємо, що ще на початок 1860-х рр. атомно-молекулярне вчення сформувалось у вигляді таких тез:
- Речовини складаються з молекул. Молекулою називається якась (найменша) частинка речовини, яка має її хімічні властивості. Молекули складаються з тіл(атомів), які сполучаються між собою в певних співвідношеннях.
- Атоми та молекули перебувають у напрямленому (невпинному самовільному) русі.
- Молекули простих речовин містять різні (однакові) атоми (O2, O3, P4, N2 тощо); молекули складних речовин — однакові (різні) атоми (H2O, HCl, тощо).
- Між тілами (атомами) існують сили притягання та відштовхування.
Отже, і після всіх експериментальних дослідів сучасна наука зберегла раціональне зерно класичного атомно-молекулярного вчення: ідеї про дискретність будови речовини, про здатність атомів давати, сполучаючись одне з одним у певному порядку, якісно нові та складніші утворення та про безперервний рух частинок, з яких складається речовина. (Слайди 9-10)
ІV. Рефлексивно-оцінювальний етап.
1. Вправа «Склади розповідь»
Підведемо підсумок уроку, склавши розповідь за допомогою слів, які ви бачите на дошці:
Хто? Коли? Як? Яка? З чого?
2. Бесіда.
– А тепер подивіться у свої листи-оповідання. Скажіть, чи є у вас приріст знань?
- Гордість за яких філософів, вчених переповнює вас після сьогоднішнього уроку? (Слайди 11-14 )
3. Самооцінювання
- Оцініть власну діяльність на уроці. Для цього намалюйте в зошиті драбинку, де є 12 щаблів. І зазначте, на якому щаблі драбинки ваш смайлик, що відповідає вашій оцінці:
Домашнє завдання:
Обов’язкове:
1. Опрацювати матеріал § ___ ; відповідати на запитання (усно).
За бажанням:
1. Створити презентацію «Фізичні явища навколо нас»

про публікацію авторської розробки
Додати розробку