Конспект уроку з хімії для 8 класу на тему: "Електронна природа хімічного зв’язку. Поняття про електронегативність"
Електронна природа хімічного зв’язку. Поняття про електронегативність
Мета уроку: ознайомити учнів з поняттям «хімічний зв’язок», розглянути його природу та причини виникнення; дати поняття про електронегативність хімічних елементів та з’ясувати її зміни у періодах і групах; закріпити знання про електронну будову атомів; розвивати хімічну мову, логічне мислення, вміння працювати з навчальним матеріалом; формувати науковий світогляд
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, таблиці «Будова електронних оболонок атомів І –ІІІ періодів», «Електронегативність атомів хімічних елементів».
Тип уроку. Вивчення нового матеріалу
Форми роботи. Розповідь, бесіда, робота учнів з таблицями, з підручником.
ХІД УРОКУ
- Організація класу
- Оголошення теми і мети уроку
- Актуалізація опорних знань
«Мозковий штурм»
- Яким елементом закінчується кожний період?
- Назвіть інертні елементи.
- Які властивості проявляють інертні елементи?
- Чому інертні елементи не можна віднести до типових неметалів?
- Яка будова зовнішнього енергетичного рівня в інертних елементів?
- Яка зміна властивостей спостерігається у періодах?
- Які властивості проявляють елементи ,що мають однакове число електронів на зовнішньому енергетичному рівні?
- Які електрони називаються спареними, а які неспареними?
- Що таке радіус атома? (відстань від центра ядра до сферичної поверхні, якої торкаються орбіталі з електронами останнього енергетичного рівня)
- Як змінюється радіус атома у періодах і групах? ( радіус атомів елементів у періоді зменшується зліва направо, а у групі (підгрупі) зростають зверху донизу)
![]()
![]() Радіус атома ЗМЕНШУЄТЬСЯ (у періоді)
Радіус атома ЗМЕНШУЄТЬСЯ (у періоді)
Радіус атома ЗБІЛЬШУЄТЬСЯ (у групі (підгрупі))
- Мотивація навчальної діяльності
У ході бесіди ми з’ясували, що всі хімічні елементи, крім інертних газів, мають незавершені електронні орбіталі. У процесі утворення хімічних зв’язків атоми хімічних елементів намагаються завершити їх і утворити стійку восьми електронну будову зовнішнього енергетичного рівня. Отже, сьогодні на уроці ми повинні з’ясувати принципи завершення зовнішнього енергетичного рівня.
Також ви вивчите таке поняття, як «електронегативність» , та її зміну у періодах і групах.
- Вивчення нового матеріалу
- Хімічний зв'язок і будова речовини
Атоми майже всіх хімічних елементів не можуть довго існувати поодинці. Вони сполучаються з такими самими або іншими атомами. Багато атомів металічного елемента, сполучаючись разом, утворюють метал. Алмаз, графіт, червоний фосфор містять з’єднані між собою атоми неметалічних елементів. Два атоми Оксигену сполучаються в молекулу кисню; із таких молекул складається газ кисень. Вода містить молекули води, утворені двома атомами Гідрогену й одним атомом Оксигену. Натрій хлорид складається не з молекул, а з великої кількості йонів Na+ i Cl-.
Сполучення будь – яких частинок відбувається з виділенням енергії.
Взаємодію між атомами, молекулами, йонами, завдяки якій частинки утримуються разом, називають хімічним зв’язком.
- Електронна природа хімічного зв’язку
На основі таблиць пояснюємо, як атоми хімічних елементів завершують свої зовнішні електронні оболонки. Звертаємо увагу на те, що у неметалічних елементів на зовнішньому енергетичному рівні є чотири і більше електрони. Неметалічним елементам енергетично невигідно віддавати свої зовнішні електрони, а тому вони приєднують до восьми електронів і утворюють стійкий октет. У металічних елементів на зовнішньому електронному рівні , навпаки, невелика кількість електронів – від одного до трьох, і тому металічні елементи віддають свої зовнішні електрони. На передостанньому електронному шарі у них також є стійкий октет електронів. Тобто робимо висновок, що в утворенні хімічних зв’язків безпосередньо беруть участь електрони зовнішньої електронної оболонки.
- Поняття про електронегативність.
Властивість атома елемента притягувати до себе спільні електронні пари порівняно з іншими елементами сполуки називається електронегативність.
Електронегативність тісно пов’язана з поняттям «радіус атома»: електронегативність буде тим більшою, чим менший радіус атома.
На початку уроку ми повторили поняття про радіус атома і з’ясували, як він змінюється в періодах і групах. Тепер з’ясовуємо, як буде змінюватися електронегативність у періодах і групах.
Завдання. Розглянути таблицю «Ряд електронегативності» і зробити висновок про зміну електронегативності у періоді та групі.
Висновок . Якщо радіус атома у періодах зменшується, то електронегативність збільшується. У групах, навпаки, зверху вниз радіус атома збільшується, отже, електронегативність зменшується.
Робота з таблицею. Ряд електронегативності.
F>O>Cl>Br>S>P>C>H>Si>Ag>Mg>Ca>Na>K>Cs>Fr
У періодичній системі електронегативність елементів зростає в періодах зліва на право, а в головних підгрупах – знизу вверх.
![]()
![]() Електронегативність ЗБІЛЬШУЄТЬСЯ (період)
Електронегативність ЗБІЛЬШУЄТЬСЯ (період)
Електронегативність ЗМЕНШУЄТЬСЯ (група)
- Поняття про валентні електрони.
Зовнішні електрони (більш віддалені) мають здатність спарюватися і їх називають ВАЛЕНТНИМИ.
Завдання. Записати електронну формулу Алюмінію і визначити валентні електрони.
Правило. При записі формули складної речовини, хімічні елементи записуються в порядку зростання електронегативності зліва на право. Наприклад: H2SO4, HCl, K3PO4, Al2O3, NaCl.
- Закріплення вивченого матеріалу
«Чомучка»
- Чому виникає хімічний зв'язок?
- Чому неметалічні елементи переважно приєднують електрони?
- Чому металічні елементи завжди віддають електрони?
- Чому електронегативність у періодах завжди збільшується?
- Чому електронегативність у групах зменшується?
- Чому Флуор найбільш, а Францій найменш електронегативний?
- Підбиття підсумків уроку
- Домашнє завдання
Вивчити §
Завдання.
- Із запропонованих хімічних елементів вибрати елементи – метали.
Zn, C, K, Na, Fe, O, He, Ba, Pb, Si, Sn, S, W, Hg.
- Записати будову атома Магнію. Записати електронну формулу, вказати валентні електрони.
3)Розмістити метали у порядку зменшення їх активності: Fe, Zn, Na, Al, Ag, Cu, Pb, Mg, K, Ca, Sn.
4) Підготувати повідомлення про Нобелівського лауреата Лайнуса Полінга
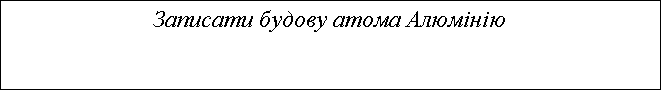
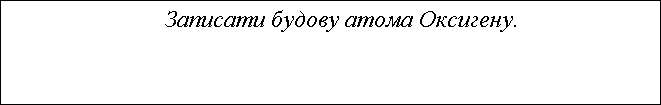
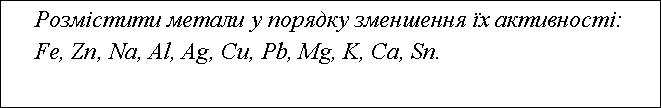



-
Вдячна за конспект уроку


про публікацію авторської розробки
Додати розробку
