конспект "Взаємодія води з оксидами."
забезпечити засвоєння учнями знань про хімічні властивості води, взаємодії з металами, оксидами активних металів і неметалів, реакцій розкладу та сполучення; удосконалення експериментальних умінь учнів, володіння хімічною мовою, повторення знань учнів про класифікацію простих речовин, типи хімічних реакцій, умови їх протікання; удоско¬налення знань учнів про індикатори та класи неорганічних сполук;
Урок на тему: «Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи. Поняття про індикатори.»
Цілі уроку:
дидактична: : забезпечити засвоєння учнями знань про хімічні властивості води, взаємодії з металами, оксидами активних металів і неметалів, реакцій розкладу та сполучення; удосконалення експериментальних умінь учнів, володіння хімічною мовою, повторення знань учнів про класифікацію простих речовин, типи хімічних реакцій, умови їх протікання; удосконалення знань учнів про індикатори та класи неорганічних сполук;
розвивальна: формувати вміння класифікувати речовини; розвивати вміння складати формули оксидів; розглянути класифікацію оксидів за хімічними властивостями; формувати навички написання та урівнювання рівнянь хімічних реакцій;
виховна:. впливати на формування екологічного виховання, розвиток пізнавальної діяльності учнів, логічного та образного мислення, різних видів пам’яті, розширення кругозору, культури усної та письмової мови;
Тип уроку: комбінований, урок перевірки раніше засвоєного матеріалу та засвоєння нових знань.
Форми й методи роботи: робота в групах, парах, індивідуальна робота, самоаналіз, самоперевірка, проблемне питання, «Хрестики-нулики», «Знайди помилку», «Х та Y», «Хто швидше», «Визначіть валентність», «Знайди елемент», «Банк цікавих даних», «Есе», «Знаю. Хочу знати. Вивчив».
Засоби навчання: періодична система хімічних елементів Д.І. Менделєєва, роздатковий матеріал.
Хід уроку.
І. Організаційна частина.
Епіграф до уроку:
Немає нічого, що не долалось би працею.
Українське прислів’я
ІІ. Мотивація навчальної діяльності.
Учитель. Сьогодні на уроці ми продовжимо вивчати воду. Хімічні властивості води характеризуються здатністю взаємодіяти з основними та кислотними оксидами. Тому в нас сьогодні на уроці буде дві команди. Перша команда буде мати назву «Основні оксиди», а друга команда – «Кислотні оксиди». Ви знаєте, що молекула води також є оксидом, а всі оксиди містять Оксиген, який має форму геометричної фігури кола, тому ваше завдання впродовж уроку отримати за правильні відповіді якнайбільшу кількість цих геометричних фігур (оксигенчиків). Спочатку я прошу вас проаналізувати свої знання і вміння, заповнюючи колонки таблиці «Знаю» або «Хочу знати» (ставити «+» у відповідні комірки). Ваші відповіді не вплинуть на оцінку, відповідайте чесно – це дасть вам можливість визначити питання, над якими вам треба ще попрацювати. На які питання ще треба звернути увагу? Яких результатів ви плануєте досягнути сьогодні на уроці? (Очікувані результати). Хто вважає, що знає та вміє все?
«Хто знає все, тому ще багато треба вчити» (І. Кант).
Яку оцінку, на вашу думку, ви одержите сьогодні під час перевірки знань теми? (Записати в зошиті «Очікувана оцінка - …»). Співпадуть очікувані результати з реальними чи ні, залежить від того, наскільки реально ви оцінили свої знання.
Робота в групах.
«Хрестики й нулики». Шлях до успіху складають назви металів або неметалів.
Оцінювання: кожна правильна відповідь оцінюється в 1 бал.
І група
|
Барій |
Силіцій |
Кальцій |
|
Калій |
Магній |
Карбон |
|
Фосфор |
Хлор |
Алюміній |
|
Хлор |
Меркурій |
Аурум |
|
Силіцій |
Нітроген |
Оксиген |
|
Купрум |
Гідроген |
Ферум |
ІІ група
|
Бром |
Магній |
Алюміній |
|
Силіцій |
Барій |
Бор |
|
Хлор |
Сульфур |
Фосфор |
|
Кальцій |
Купрум |
Ферум |
|
Сульфур |
Карбон |
Хром |
|
Магній |
Силіцій |
Хлор |
Індивідуальна робота.
«Знайди помилку».
Оцінювання: кожна правильна відповідь оцінюється в 1 бал.
1.Питна вода має колір, запах і смак... (Не має)
2.Питна сода, цукор і сіль добре розчиняються у воді... (Питна сода — не
розчиняється)
3.Щоби швидше розчинився цукор, воду треба охолодити... (Нагріти)
4.Добре розчиняються у воді такі речовини, як сіль, пісок, цукор, крейда...
(Пісок і крейда не розчиняються)
5.Щоби швидше розчинити пісок, суміш піску з водою треба добре
перемішати... (Пісок не розчиняється у воді)
6.Речовина буде довше розчинятися у воді, якщо її подрібнити... (Швидше)
7.Розчин може бути прозорим і мутним... (Тільки прозорим)
8.Розчин можна назвати неоднорідною сумішшю... (Однорідною)
9.Повітря, розчин цукру, газована вода — однорідні суміші... (Газована вода — неоднорідна суміш)
10.Молоко, пісок із водою, оцет — неоднорідні суміші... (Оцет — однорідна
суміш)
ІІІ. Актуалізація опорних знань
Робота в групах.
«X та Y».
Заповніть рядок «X» формулами основних оксидів – І група.
Заповніть рядок «Y» формулами кислотних оксидів – ІІ група.
Завдання.
Na2O, NO2, CuO, ZnO, Cr2O3, MgO, Cu2O, PbO2, V2O5, B2O3, Li2O, SO3, MnO2, Al2O3, CO2, N2O5, CrO3, P2O5
Оцінювання: кожна правильна відповідь оцінюється в 1 бал.
Робота в групах.
«Хто швидше».
Оцінювання: кожна правильна відповідь оцінюється в 1 бал.
Заповніть таблицю, склавши формули сполук поданих елементів з Оксисеном. (Завдання потрібно виконати швидко, і кожен член групи повинен записати одну формулу).
Учитель: Діти, скажіть, будь ласка, у чому особливість усіх формул? Так, усі вони містять Оксисен, назва яких – «оксиди».
Оксиди – це такі чарівні речовини,
Потрібні і в хімії і для людини,
Вони з Оксисеном дружать завжди,
Без нього вони нікуди.
Завдання.
Група І
|
№ п/п |
Валентність |
Хімічний символ елемента |
Формула сполуки з Оксигеном |
|
1 |
ІІ |
Ca |
CaO |
|
2 |
І |
H |
H2O |
|
3 |
ІV |
S |
SO2 |
|
4 |
ІІ |
Cu |
CuO |
|
5 |
V |
P |
P2O5 |
|
6 |
ІІІ |
Cr |
Cr2O3 |
|
7 |
І |
Na |
Na2O |
|
8 |
ІІ |
Fe |
FeO |
Група ІI
|
№ п/п |
Валентність |
Хімічний символ елемента |
Формула сполуки з Оксигеном |
|
1 |
ІІ |
Mg |
MgO |
|
2 |
І |
Li |
Li2O |
|
3 |
ІII |
Al |
Al2O3 |
|
4 |
ІV |
C |
CO2 |
|
5 |
V |
N |
N2O5 |
|
6 |
ІІІ |
Fe |
Fe2O3 |
|
7 |
І |
K |
K2O |
|
8 |
ІІ |
Cr |
CrO |
ІV. Вивчення нового матеріалу.
Випереджувальне завдання. «Банк цікавих даних» (повідомлення учня).
Небайдужим до хімічних знань був знаменитий письменник-фантаст Ж. Верн, який у своєму романі «Таємничий острів» розглядав воду як ефективне паливо майбутнього:
Яке паливо замінить вугілля?
- Вода,— відповів інженер.
- Вода? — перепитав Пенкроф...
Так, але вода, розкладена на складові частини,— пояснив Сайєрс Сміт,— без сумніву, це буде виконуватися за допомогою електричного струму, який в руках людства стане могутньою силою. Так, я впевнений, що прийде день і вода замінить паливо, водень і кисень, з яких нона складається, будуть застосовуватися й окремо: вони виявляться невичерпним і таким потужним джерелом тепла і світла, що вугіллю до них далеко. Прийде день, друзі мої, і в трюми пароплавів будуть вантажити не вугілля, а балони з двома цими стиснутими газами, й вони будуть згоряти з величезною тепловою віддачею... Вода — це вугілля майбутніх віків.
Проблемні питання.
- Які хімічні властивості має вода?
- В результаті взаємодії води з іншими речовинами, які сполуки можуть
утворюватися?
- Яку властивість води описав Ж.Верн у своєму романі «Таємничий острів»?
Учитель. Вода дуже стійка проти нагрівання, але при високій температурі (200°С) або під дією постійного електричного струму вона розкладається (реакція розкладу):
2Н2O= 2Н2 + O2
Вода вступає в реакції сполучення з багатьма складними речовинами, наприклад з оксидами. У цьому можна переконатися, провівши такі досліди.
Дослід 1. У фарфорову чашку вміщують трохи свіжопрожареного оксиду кальцію СаО (палене вапно) і поливають його водою. При цьому виділяється багато теплоти, оскільки відбувається хімічна реакція. В результаті утворюється пухкий порошок, при розчиненні якого у воді утворюється мильний на дотик розчин.
Рівняння реакції оксиду кальцію з водою (реакція сполучення) таке:
СаО + Н2O = Са(ОН)2
кальцій оксид кальцій гідроксид
(основа)
Технічний кальцій оксид називають негашеним (паленим) вапном.
Кальцій оксид виявляє усі хімічні властивості, характерні для основних оксидів активних металів.
Кальцій гідроксид Са(ОН)2 — безбарвні кристали, зазвичай порошок сірого кольору, мало розчиняється у воді. Са(ОН)2 — сильна основа.
Гашене вапно Са(ОН)2, змулене у воді, утворює завись (суспензію), яку називають вапняним молоком. Воно застосовується у виробництві цукру для його очищення і для вапнування стовбурів дерев.
Безбарвний прозорий розчин гашеного вапна називають вапняною водою. Її використовують як реактив на карбон(IV) оксид С02(реакція обміну):
Са(ОН)2 + С02 = СаС03 + Н20
Гашене вапно Са(ОН)2 широко використовується у будівництві як в’яжучий матеріал, у сільському господарстві — для вапнування ґрунтів, як компонент шихти у виробництві скла і для зм’якшення води.
Індикатори – речовини, що змінюють своє забарвлення під дією кислот чи лугів. Луги – це розчинні у воді основи (гідроксиди).
Дія кислот і лугів на індикатори
|
Середовище |
Індикатори |
||
|
Метиловий оранжевий |
Лакмус |
Фенол- фталеїн |
|
|
Нейтральне |
Оранжевий |
Фіолетовий |
Безбарвний |
|
Кисле |
Червоний |
Рожевий |
Безбарвний |
|
Лужне |
Жовтий |
Синій |
Малиновий |
Дослід 2. Наливають у хімічний стакан трохи води, добавляють кілька крапель розчину фіолетового лакмусу і спалюють над водою в металевій ложечці червоний фосфор. Фосфор (V) оксид Р2O5, який утворюється у вигляді білого диму, поступово розчиняється у воді і реагує з нею. Це підтверджує зміна фіолетового забарвлення лакмусу на рожеве. У цьому випадку утворюється метафосфорна кислота (реакція сполучення):
Р2O5 +Н20 = 2НР03
метафосфорна кислота
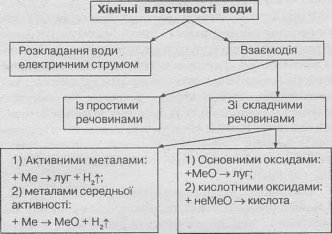
Як видно, вода реагує з дуже багатьма речовинами. В узагальненому вигляді наведемо приклади найважливіших хімічних реакцій, в яких бере участь вода.
1.Вода реагує з активними металами. Утворюються розчинні у воді гідроксиди (луги) і водень (реакція заміщення):
2Lі + 2 НОН — 2 LiOН + Н2
літій
гідроксид
2.Вода реагує з менш активними металами при нагріванні. Продукти реакції — оксиди металів і водень (реакція заміщення):
Zn + Н20 = ZnO + Н2
цинк
оксид
II III
ЗFе + 4Н20 = Fе0*Fе20з (або Fе304)+4Н2
3.Вода реагує з деякими неметалами (продукти реакції різні) (реакція заміщення):
карбон (ІІ)
оксид
4.Вода реагує з оксидами активних металів. Утворюються розчинні у воді гідроксиди
(луги) (реакція сполучення):
Lі20 + Н20 = 2LіОН
літій гідроксид
5.Вода реагує майже з усіма оксидами неметалів. Утворюються кислоти
(реакція сполучення):
S03 + Н20 = Н2S04
сульфур (VІ) сульфатна
оксид кислота
Оксиди широко використовують у промисловості. Оксиди Феруму, Алюмінію, Урану тощо — джерела добування металів. Прозорі кристали корунду А1203 використовують в ювелірній промисловості як дорогоцінні камені: рубін — червоного, сапфір — синього кольору. Непрозорі кристали корунду застосовують для виготовлення шліфувальних брусків та інших абразивних матеріалів. SiO2 — річковий пісок використовують у будівництві та для виготовлення скла. СО — як паливо, а також відновник під час виплавляння сталі. ZnO — для виготовлення білої фарби, Fе203 — коричневої, Сг203 — зеленої, С02 — для газування фруктової води.
Структурологічна схема хімічних властивостей води.
Фізкультхвилинка.
Одна ворона,
Поважна персона,
Пішла в перукарню,
І пофарбувалася гарно.
Біла стала справа й зліва,
Й зверху, й знизу побіліла.
Як на неї не дивись,
Всюди біла, де не візьмись.
Всі казкові зміни з нею
Сталися тому, напевно,
Що знання хімічні враз,
Застосовують повсякчас.
(Руки на пояс, повороти тулуба вправо-вліво. Зімкнені ззаду руки випрямити і повільно
піднімати, голову поступово нахиляти назад, підборіддя піднімати вверх. Руки на пояс, повороти голови праворуч-ліворуч-вверх-вниз. Руки на поясі, нахил тулуба ліворуч-праворун-прямо-назад. Кисті рук на плечі, колові рухи плечима вперед. Колові рухи плечима назад. Руки вгору (вдих), опускати через різні боки вниз (видих).)
V. Закріплення та поглиблення знань.
Робота в парах.
«Визначіть валентність» відгадавши загадку, за поданою формулою сполуки, необхідно визначити валентність хімічних елементів.
Оцінювання: кожна правильна відповідь оцінюється в 1 бал.
1. Як називається газ, який бере участь у процесі фотосинтезу?
(Вуглекислий газ), (СО2).
2. Мене не їдять, і без мене не їдять. (Сіль), (NaCl).
3. Що за чиж на чорнім полі креслить носом білий слід? (Крейда), (CaCO3).
4. Не горить, а гасити доводиться. (Вапно), (CaO).
5. Що таке: пливе і ллється
Часом на камінь дереться
Як немає – все всихає
Звір і птаха помирає. (Вода), (Н2O).
6. Не тільки в хімії я є основа,
Якщо звернути увагу,
У вапнуванні грунту, на будівництві,
У садівництві в мене є патент
Скрізь я – головний компонент. (Гашене вапно), (Ca(OН)2).
Робота в парах.
«Знайди елемент»
1.Скласти хімічні реакції за поданими схемами.
2.Підрахувати суму коефіцієнтів (враховуючи, що якщо коефіцієнт не стоїть, то він дорівнює одиниці).
3.У таблиці Д.І. Менделєєва знайти елемент з таким значенням відносної атомної маси. Цей елемент є обов’язковим компонентом усіх живих організмів, підвищує стійкість рослин до холоду, засухи і хворіб. Рослини, яким його не вистачає, легко уражуються грибковими і бактеріальними хворобами.
Елемент: Калій.
Оцінювання: одне рівняння – 2 бали. Максимальна кількість балів - 10
|
Схеми реакцій |
Відповідні рівняння реакцій |
Сума коефіцієнтів |
|
Na + O2 = Na2O |
4Na + O2 = 2Na2O |
7 |
|
Zn + O2 = ZnO |
2Zn + O2 = 2ZnO |
5 |
|
Cr + O2 = Cr2O3 |
4Cr + 3O2 = 2Cr2O3 |
9 |
|
Fe + O2 = Fe2O3 |
4Fe + 3O2 = 2Fe2O3 |
9 |
|
Cl2 + O2 = Cl2O5 |
2Cl2 + 5O2 = 2Cl2O5 |
9 |
|
Разом: 39 |
||
VІ. Підбиття підсумків уроку. Оцінювання відповідей учнів.
Учитель. Підрахуйте кількість набраних балів «оксигенчиків». Виставте оцінку за урок. Чи співпала оцінка з очікуваною? Чому саме так вийшло? Відкоригуйте свою таблицю «Знаю. Хочу знати. Вивчив». Зазначте, чи правильно ви оцінили свої знання на початку уроку, на що треба ще звернути увагу, чого ви навчились під час уроку. Чи досягли ви тих результатів, що планували?
VІІ. Домашнє завдання
І рівень.
Тестові завдання
1.Фенолфталеїн у розчині лугу набуває забарвлення: а) жовтого; б) синього; в) малинового.
2.Забарвлення лакмусу у нерозчинних основах: а) синіє; б) не змінюється; в)червоніє.
3.Реакція нейтралізації відбувається між кислотою та: а) водою; б) оксидами; в) основами.
4.Яка з основ буде реагувати з кислотним оксидом SO3: а) KOH; б) Zn(OH)2; в) Al(OH)3
5.Яка основа не розкладається при нагріванні: а) Fe(OH)3; б) NaOH; в) Ca(OH)2
6.Метиловий оранжевий у розчині лугу набуває забарвлення:
а)жовтого; б)синього; в)малинового.
ІІ рівень
Напишіть рівняння реакцій, щоб здійснити перетворення:
а) Ca – CaO – Ca (OH)2 – CaCO3;
б) P – P2O5 – H3PO4 – Na3PO4 .
ІІІ рівень
Визначте речовину, що утворюється в результаті перетворень:
а) S – SO2 + H2O = A ; Ba – BaO + H2O = B ; A + B = C
б) S – SO2 - SO3 + H2O = A ; Ca – CaO + H2O = B ; A + B = C
ІV рівень
Виберіть зі списку формули кислот. Напишіть рівняння одержання цих кислот.
|
№ |
Речовини |
|
1 |
Cu(OH)2 , Na2O , P2O5 , HNO3 , Al2(SO4)3 , HCl , KOH |
|
2 |
Fe(OH)2 , CaO , SO3 , H3PO4 , MgCl2 , NaOH , H2S |
|
3 |
Fe(OH)3 , K2O , CO2 , HCl , Zn3(PO4)2 , Ba(OH)2 , HNO3 |
|
4 |
Al(OH)3 , MgO , Cl2O7 , H2SO4 , Ba(NO3)2 , KOH , H2S |
|
5 |
ZnO , H2SiO3 , CO2 ,, Al(OH)3 , AgNO3 , KOH , HBr |
|
6 |
K2O , HCl , P2O5 , Cu(OH)2 , Ca3(PO4)2 , Ba(OH)2 , H2SO4 |


про публікацію авторської розробки
Додати розробку
