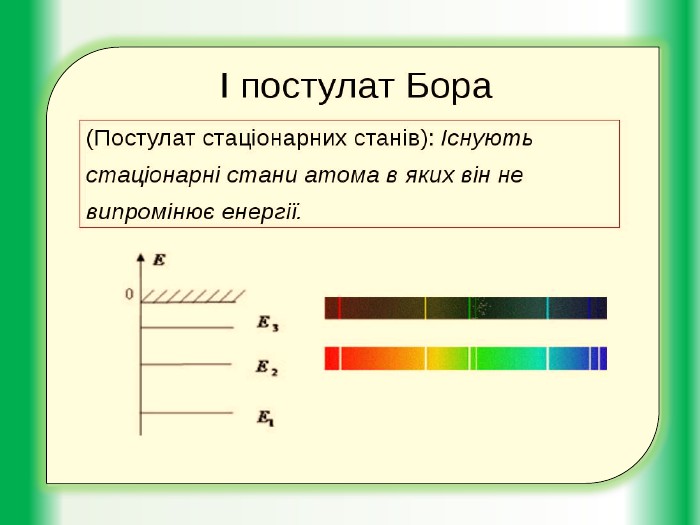
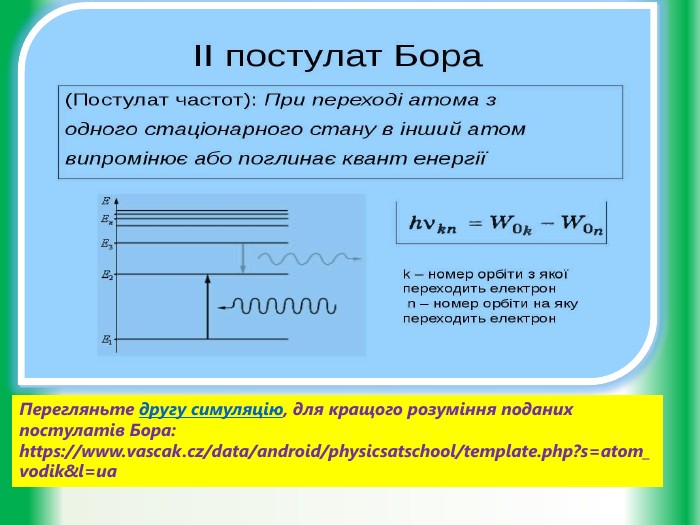
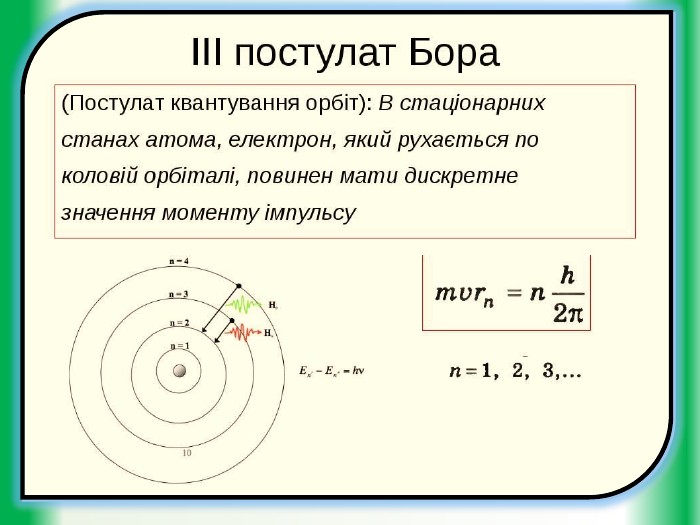
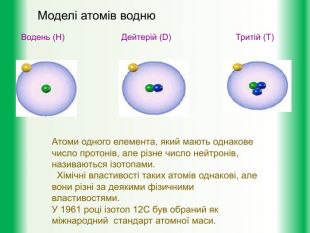
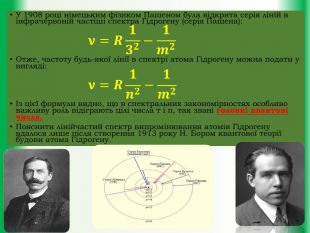
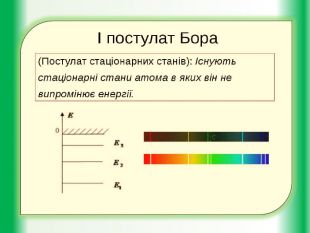
Квантові властивості атома. Квантові постулати М.Бора.
Про матеріал
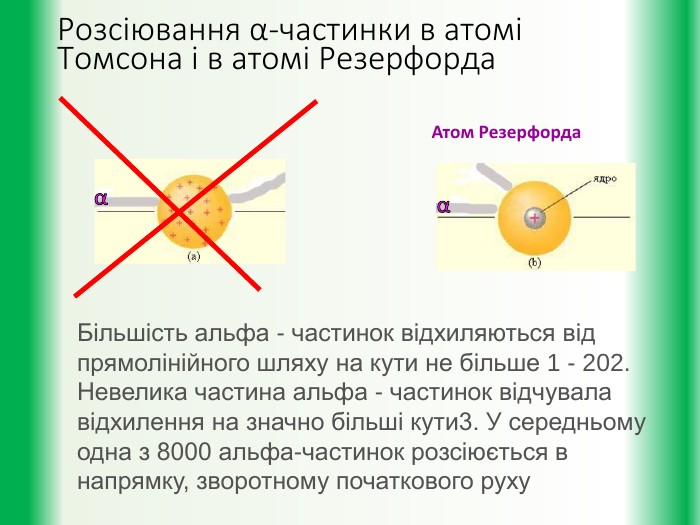
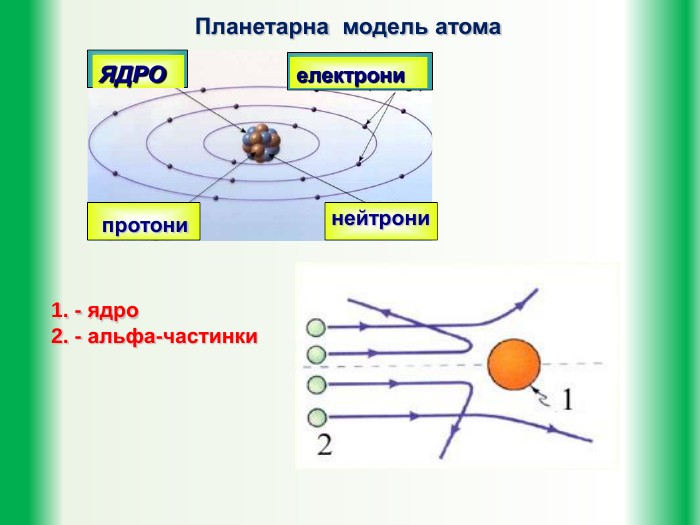
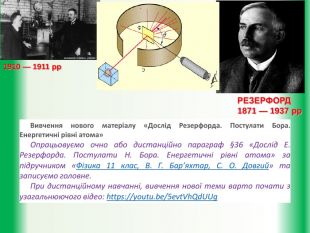
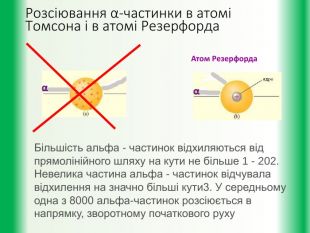
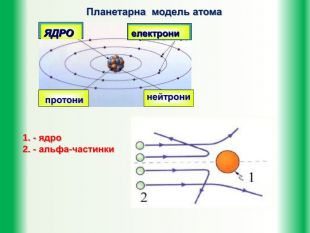
Мета уроку: дати учням уявлення про будову атома. Познайомити їх із планетарною моделлю атома за Резерфордом та пояснення квантовими постулатами Н. Бора труднощів планетарної моделі Резерфорда.
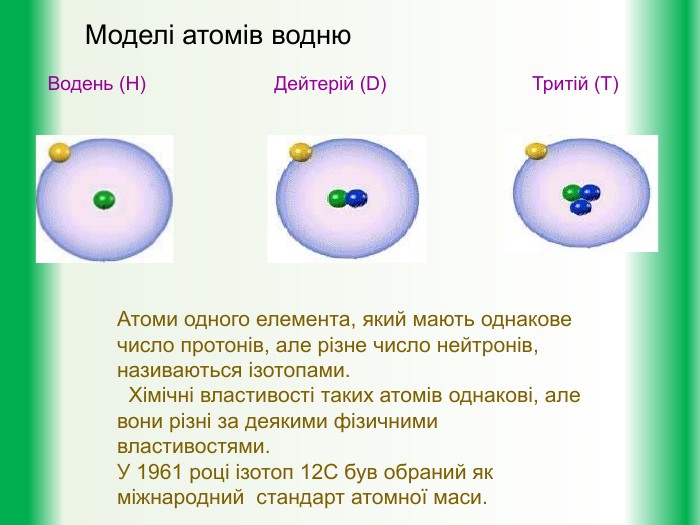
сформувати уявлення про будову атома, навчитись розглядати будову атомів у таблиці «Періодична система хімічних елементів Менделєєва», навчитись відрізняти один від одного атоми різних хімічних елементів.
виховувати вміння аналізувати, узагальнювати одержані знання, сприяти становленню особистості учня, його інтелектуальному і духовному розвитку, розвивати уяву, творче мислення; виховувати працелюбність та наполегливість.
Обладнання: презентація, підручники, таблиця «Періодична система хімічних елементів Менделєєва», картки –завдання.
Тип уроку: Урок вивчення нового матеріалу.
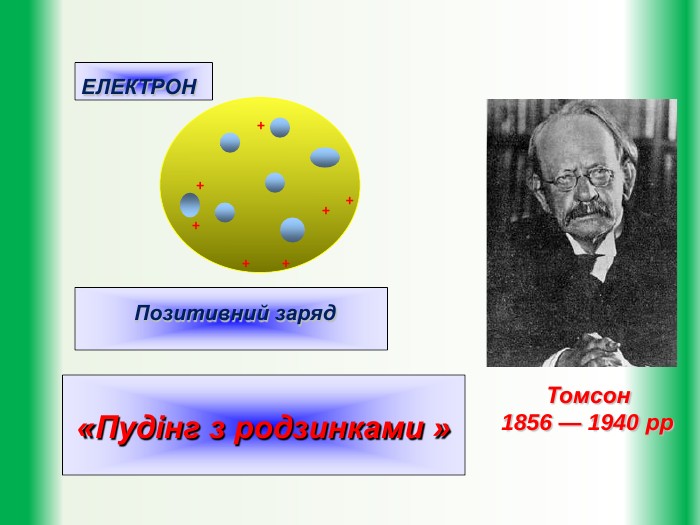
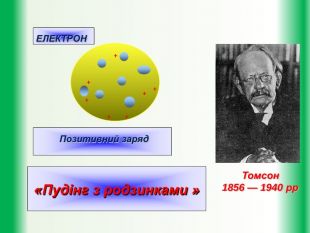
Базові поняття: атом, модель Томсона, планетарна модель атома модель, іон, постулати.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку