Лабораторні роботи з хімії
Файл містить 5 методичних вказівок до лабораторних робіт. Має бланки для оформлення звіту. Підходить для судентів коледжів, же хімія вивчається в рамках загальноосвітнього циклу. Може бути корисною для10-11 класів
Лабораторно-практичне заняття №1
Тема: Вивчення властивостей оцтової кислоти.
Мета:
- узагальнити про органічні кислоти як клас речовин,
- дізнатись про основні хімічні властивості карбонових кислот на прикладі оцтової кислоти,
Матеріальне забезпечення:
- хімічний посуд,
- розчин оцтової кислоти,
- Універсальний індикатор
- Mg
- NaOH.
- CaCO3 чи Na2CO3
Техніка безпеки:
- Звільніть робоче місце від усіх непотрібних для роботи предметів і матеріалів.
- Перевірте наявність і надійність посуду, приладів та інших предметів, необхідних для виконання завдання.
- Починайте виконувати завдання тільки з дозволу викладача.
- Хімічні речовини для досліду слід брати тільки в кількостях, передбачених інструкцією проведення досліду, або за вказівкою викладача.
- Перед тим, як взяти реактив, необхідний для досліду, прочитайте етикетку на тарі (банці або склянці), щоб попередити помилку.
- Не беріть реактиви незахищеними руками. Використовуйте для цього фарфорові ложечки, совочки та шпателі.
- Користуйтеся піпетками та пастками, гумовими грушами для набирання рідких хімічних реактивів.
- Уразі потрапляння на шкіру кислоти слід негайно змити її залишки зі шкіри водою, а потім слабким розчином питної соди.
- Не пробуйте хімічні речовини на смак, адже будь – яка з них тією чи іншою мірою отруйна.
- Визначаючи речовини за запахом, не нахиляйтеся над шийкою посудини і не вдихайте пару або газ, що виділяється. Для цього треба легким рухом долоні над шийкою посудини спрямувати пару або газ до носа і вдихати їх обережно в невеликих кількостях.
- Прибирання робочих місць після закінчення практичних занять виконуйте за вказівкою викладача.
- Після закінчення роботи помийте руки з милом, зніміть халат і повісте його в шафу, призначену для зберігання спецодягу.
Теоретичні відомості:
Оцтова кислота, як представник карбонових кислот має кислотні властивості: у воді має кислий смак, забарвлює лакмус і метиловий оранжевий у червоний колір, є взаємодієз металами з виділенням водню. Це свідчить, що органічні кислоти вступають у реакції, характерні для кислот .
Дисоціацію карбонових кислот у загальному вигляді можна записати рівнянням на прикладі оцтової):
CH3COOH = CH3COO- + H+
За ступенем дисоціації мурашина кислота є електролітом середньої сили, інші карбонові кислоти належать до слабких електролітів внаслідок впливу вуглеводневого радикалу.
Метали, розташовані в ряду стандартних електродних потенціалів ліворуч від водню, витісняють його з карбонових кислот.
Звичайно, реакція відбувається повільніше, ніж із сильними кислотами, з утворенням солей — іонних сполук:
2СН3СООН + Mg = (CH3COOH)2Mg + Н2.
Етанова (оцтова) кислота Етанат (ацетат) магнію
Внаслідок взаємодії кислот з основними оксидами та основами утворюються солі:
2СН3СООН + СаО = (СН3СОО)2Са + Н20,
Етанат (ацетат) кальцію
Контрольні запитання:
![]()
![]()
![]()
![]()
![]()
![]() Зробіть перетворення: етан етен етанол етаналь етанова кислота натрій ацетат кальцій ацетат
Зробіть перетворення: етан етен етанол етаналь етанова кислота натрій ацетат кальцій ацетат
Завдання та порядок їх виконання.
1. Дія на індикатори.
У три пробірки налийте по 1-2 мл розчину оцтової кислоти. До вмісту пробірки №1 додайте папірець універсального індикатора, до пробірки №2 розчин метил оранжу. До пробірки №3 – розчин лакмусу. Спостерігай те зміну індикаторів, дані занесіть в таблицю
2. Взаємодія з металами.
До розчину оцтової кислоти в пробірці додайте порошок магнію. Спостерігайте виділення газу. Складіть рівняння реакції.
3. Взаємодія з лугами.
До 1-2 мл розчину гідроксиду натрію в пробірці добавте кілька крапель фенолфталеїну. до забарвленого розчину краплями додайте розчин оцтової к-ти до знебарвлення розчину. Про що це свідчить?
Складіть рівняння реакції.
- Взаємодія з солями.
До розчину оцтової кислоти в пробірці додайте карбонат кальцію чи натрію. Спостерігайте реакцію за її ознаками. Зробіть висновки
Література.
1.П.П. Попель, Л.С. Крикля хімія 10- К.: Перун, 2018
2.П.П. Попель, Л.С. Крикля хімія 10- К.: Перун, 2010
Лабораторно-практичне заняття №2
Тема: Вивчення властивостей вуглеводів.
Мета:
- ознайомитись з хімічними властивостями глюкози
- дізнатись про якісні реакції вуглеводів
- Узагальнити знання про крохмаль як природній полімер.
Матеріальне забезпечення:
- хімічний посуд
- NaOH
- CuSO4
- розчин глюкози,
- Крохмаль
- розчин йоду спиртовий.
Техніка безпеки:
- Звільніть робоче місце від усіх непотрібних для роботи предметів і матеріалів.
- Перевірте наявність і надійність посуду, приладів та інших предметів, необхідних для виконання завдання.
- Починайте виконувати завдання тільки з дозволу викладача.
- Хімічні речовини для досліду слід брати тільки в кількостях, передбачених інструкцією проведення досліду, або за вказівкою викладача.
- Перед тим, як взяти реактив, необхідний для досліду, прочитайте етикетку на тарі (банці або склянці), щоб попередити помилку.
- Не беріть реактиви незахищеними руками. Використовуйте для цього фарфорові ложечки, совочки та шпателі.
- Насипайте або наливайте реактиви на столі (сухі – над аркушем паперу, рідкі – над лотком).
- Не зсипайте розсипаний і не зливайте розлитий реактив назад у тару до основної кількості реактиву.
- Не пробуйте хімічні речовини на смак, адже будь – яка з них тією чи іншою мірою отруйна.
- Визначаючи речовини за запахом, не нахиляйтеся над шийкою посудини і не вдихайте пару або газ, що виділяється. Для цього треба легким рухом долоні над шийкою посудини спрямувати пару або газ до носа і вдихати їх обережно в невеликих кількостях.
- Прибирання робочих місць після закінчення практичних занять виконуйте за вказівкою викладача.
- Після закінчення роботи помийте руки з милом, зніміть халат і повісте його в шафу, призначену для зберігання спецодягу.
Теоретичні відомості:
Вуглеводи — складова частина клітин усіх живих організмів.
Вуглеводи є найпоширенішими органічними сполуками, що підтверджується тим фактом, що більше половини органічного вуглецю на Землі існує у формі вуглеводів.
Здебільшого вуглеводи є сполуками рослинного походження — це продукти фотосинтезу і таким чином вони є базовою ланкою у трансформації сонячної енергії у хімічну для забезпечення життя на Землі.
З хімічної точки зору це є полігідроксикарбонільні сполуки та їхні похідні із загальною формулою СnH2nOn.
Низькомолекулярні вуглеводи відомі також як цукри. Найвідомішими представниками вуглеводів є целюлоза, крохмаль,глюкоза.
Глюкоза з точки зору хімії є альдегідоспиртом. Маючи альдегідну групу вона може поводити себе в реакціях як альдегід, тому для неї характерна реакція срібного дзеркала, як і для всіх альдегідів. Присутність 5 гідроксогруп робить її багатоатомним спиртом. Для неї, відповідно, характерна реакція з гідроксидом міді, до доводить властивості глюкози як гліколю.
Крохмаль (С6 Н10 О5) білий під мікроскопом зернистий порошок, нерозчинний в холодній воді, в гарячій воді набухає, утворює колоїдний розчин (крохмальний клейстер); з розчином йоду дає синє забарвлення. Молекула крохмалю неоднорідна за розмірами. Крохмаль утворюється в результаті фотосинтезу в листі рослин, відкладається «про запас» в бульбах , кореневищах, зернах. В шлунковому тракті людини і тварини крохмаль піддається гідролізу і перетворюється в глюкозу, яка засвоюється організмом.
Контрольні запитання:
Зробіть перетворення:
![]()
![]() Вуглекислий газ глюкоза глюконова кислота
Вуглекислий газ глюкоза глюконова кислота
![]()
![]()
![]()
![]() Вуглекислий газ глюкоза крохмаль глюкоза вуглекислий газ
Вуглекислий газ глюкоза крохмаль глюкоза вуглекислий газ
Завдання та порядок їх виконання.
1.Якісна реакція на глюкозу
У пробірку налийте 1мл розчину гідроксиду натрію і додайте кілька крапель розчину сульфату купруму. Спостерігайте утворення осаду гідроксиду купруму. До осаду додайте розчин глюкози і суміш збовтайте. Спостерігайте утворення прозорого розчину синього кольору. Поясніть побачене.
2.Утворення декстрину.
У пробірку насипте трохи крохмалю, добавте холодної води. Розмішайте суміш, дайте відстоятись. Що спостерігається? Чи розчинився крохмаль у холодній воді?
Налийте в склянку воду, що закипіла. Вилийте суміш із пробірки, перемішуючи у гарячу воду. Що спостерігається? Зробіть висновок. Збережіть клейстер для наступного досліду.
3.Якісна реакція на крохмаль
До приготовленого клейстеру додайте краплину йоду. Спостерігайте появу синього забарвлення. Ця реакція використовується для виявлення крохмалю або йоду.
Література.
1.П.П. Попель, Л.С. Крикля хімія 10- К.: Перун, 2018
2.П.П. Попель, Л.С. Крикля хімія 10- К.: Перун, 20
Лабораторно-практичне заняття №3
Тема: Якісні реакції на йони неметалів
Мета:
- навчитись на практиці застосовувати знання з хімії,
- розширювати кругозір шляхом пізнання додаткового навчального матеріалу на лабораторних заняттях,
- проводити трудове виховання, а саме : навчитись правильно користуватись хімічним посудом та ін. обладнанням.
Матеріальне забезпечення:
Хімічний посуд: пробірки з штативом, спиртівка, пробіркотримач.
Реактиви:
- сульфат амонію (розчин10%)
- натрій гідроксид (розчин),
- барій хлорид(розчин),
- фосфатна кислота (розб.),
- натрій хлорид (чи інша сіль), папірець універсального індикатора,
- аргентум нітрат (розчин).
Техніка безпеки:
- Звільніть робоче місце від усіх непотрібних для роботи предметів і матеріалів.
- Перевірте наявність і надійність посуду, приладів та інших предметів, необхідних для виконання завдання.
- Починайте виконувати завдання тільки з дозволу викладача.
- Хімічні речовини для досліду слід брати тільки в кількостях, передбачених інструкцією проведення досліду, або за вказівкою викладача.
- Перед тим, як взяти реактив, необхідний для досліду, прочитайте етикетку на тарі (банці або склянці), щоб попередити помилку.
- Не беріть реактиви незахищеними руками. Використовуйте для цього фарфорові ложечки, совочки та шпателі.
- Для змішування або розбавлення речовин, що супроводжуються виділенням тепла, а також для
нагрівання хімічних речовин слід використовувати фарфоровий або теплостійкий скляний посуд.
- Пробірки, кругло донні колби, фарфорові чашки можна нагрівати на відкритому
вогні, плоскодонні колби слід нагрівати лише на металевому розсіканні полум'я.
- Прибирання робочих місць після закінчення практичних занять виконуйте за вказівкою викладача.
- Після закінчення роботи помийте руки з милом, зніміть халат і повісте його в шафу, призначену для зберігання спецодягу.
Теоретичні відомості: Для виявлення йонів неогранічних речовин використовують якісні реакції. Це рекції які дають осад, газ, чи зміну кольору досліджуваної речовини, за якими можна судити про наявність того чи іншого йону.
Йони барію можна виявити додаванням сульфат – йону. При цьому утвориться білий осад барій сульфату.
Хлорид – йон виявляється за допомогою йону аргентуму. В результаті цієї реакції випадає білий сирнистий осад хлориду аргентуму.
Аміак(амоніак) безбарвний газ з різким запахом , добре розчинний у воді. У воді аміак утворює йон амонію.
Іон амонію NH4+ можна легко виявити в розчині, відновивши його до амоніаку NH3 . звичайно це роблять додаванням лугу та нагріванням. При цьому амоніак виділяється з розчину і його наявність можна виявить універсальним індикатором та за специфічним різким запахом.
Карбонат – йон виявляють переведенням його в осад, або у вуглекислий газ. Для цього додають відповідні речовини.
Контрольні запитання:
![]()
![]()
![]()
![]() Вуглекислий газ карбонатна кислота натрій карбонат кальцій карбонат кальцій оксид
Вуглекислий газ карбонатна кислота натрій карбонат кальцій карбонат кальцій оксид
![]()
![]()
![]()
![]()
![]() Сульфур(VI)оксид сульфатна кислота барій сульфат барій гідроксид барій нітрат барій нітрит
Сульфур(VI)оксид сульфатна кислота барій сульфат барій гідроксид барій нітрат барій нітрит
Завдання та порядок їх виконання.
- Виявлення хлорид – йону в розчині.
Візьміть 1мл розчину хлориду натрію, чи іншу запропоновану сіль хлоридної кислоти. Додайте 1 мл розчину нітрату срібла. Що спостерігаєте? Запишіть дані, отримані в результаті досліду в бланк відповідей.
- Виявлення сульфат – йону в розчині.
Візьміть 1мл розчину хлориду барію. Додайте 1 мл розчину будь-якої запропонованої солі сульфатної кислоти.. Що спостерігаєте? Запишіть дані, отримані в результаті досліду в бланк відповідей.
- Виявлення іонів амонію в розчині.
Налийте в пробірку 1мл розчину сульфату амонію і добавте до нього стільки ж розчину гідроксиду натрію. Закріпіть пробірку в пробіркотримачеві та нагрійте рідину в пробірці до кипіння. Обережно понюхайте газ, що виділяється. Піднесіть до отвору пробірки папірець універсального індикатора, змочений водою. Що спостерігається? Чому? Напишіть рівняння реакції
- Виявлення карбонат - йону в розчині.
У пробірку всипте невелику кількість карбонату кальцію і карбонату натрію. В пробірку додайте 1 мл розбавленої фосфатної кислоти й одразу закрийте її пробкою з газовідвідною трубкою, кінець якої опустіть в пробірку з вапняною водою(розчин Ca(OH)2 . Поясніть спостереження.
- Силікат- йон. Добування силікатної кислоти.
В хімічний стакан налийте 1 мл силікату калію і обережно додайте стільки ж розчину фосфатної кислоти, перемішуючи скляною паличкою. Що спостерігається? Опишіть дослід та зробіть висновки.
Література.
1.П.П. Попель, Л.С. Крикля хімія 10- К.: Перун, 2018
2.П.П. Попель, Л.С. Крикля хімія 10- К.: Перун, 2010
Лабораторно-практичне заняття №4
Тема: Якісні реакції на йони металів
Мета:
- навчитись на практиці застосовувати знання з хімії,
- розширювати кругозір шляхом пізнання додаткового навчального матеріалу на лабораторних заняттях,
- проводити трудове виховання, а саме : навчитись правильно користуватись хімічним посудом та ін. обладнанням.
Матеріальне забезпечення:
Хімічний посуд: пробірки з штативом
Реактиви:
- Плюмбум нітрат
- Калій йодид
- Алюміній хлорид
- Натрій гідроксид
- Жовта кровяна сіль K4[Fe(CN)6].
- Купрум сульфат
Техніка безпеки:
- Звільніть робоче місце від усіх непотрібних для роботи предметів і матеріалів.
- Перевірте наявність і надійність посуду, приладів та інших предметів, необхідних для виконання завдання.
- Починайте виконувати завдання тільки з дозволу викладача.
- Хімічні речовини для досліду слід брати тільки в кількостях, передбачених інструкцією проведення досліду, або за вказівкою викладача.
- Перед тим, як взяти реактив, необхідний для досліду, прочитайте етикетку на тарі (банці або склянці), щоб попередити помилку.
- Не беріть реактиви незахищеними руками. Використовуйте для цього фарфорові ложечки, совочки та шпателі.
- Насипайте або наливайте реактиви на столі (сухі – над аркушем паперу, рідкі – над лотком).
- Не зсипайте розсипаний і не зливайте розлитий реактив назад у тару до основної кількості реактиву.
- Не пробуйте хімічні речовини на смак, адже будь – яка з них тією чи іншою мірою отруйна.
- Визначаючи речовини за запахом, не нахиляйтеся над шийкою посудини і не вдихайте пару або газ, що виділяється. Для цього треба легким рухом долоні над шийкою посудини спрямувати пару або газ до носа і вдихати їх обережно в невеликих кількостях.
- Тонкостінний посуд слід закріплювати в затискачах штативів обережно, злегка повертаючи
навколо вертикальної вісі або переміщуючи вверх-вниз.
- Під час нагрівання скляних пластинок слід спочатку рівномірно прогріти весь
предмет, а потім вести місцеве нагрівання.
- Для змішування або розбавлення речовин, що супроводжуються виділенням тепла, а також для
нагрівання хімічних речовин слід використовувати фарфоровий або теплостійкий скляний посуд.
- Пробірки, кругло донні колби, фарфорові чашки можна нагрівати на відкритому
вогні, плоскодонні колби слід нагрівати лише на металевому розсіканні полум'я.
- Прибирання робочих місць після закінчення практичних занять виконуйте за вказівкою викладача.
- Після закінчення роботи помийте руки з милом, зніміть халат і повісте його в шафу, призначену для зберігання спецодягу.
Теоретичні відомості: Для виявлення йонів неогранічних речовин використовують якісні реакції. Це реакції які дають осад, газ, чи зміну кольору досліджуваної речовини, за якими можна судити про наявність того чи іншого йону. Див
Контрольні запитання:
![]()
![]()
![]() Алюміній алюміній хлорид алюміній гідроксид алюміній оксид
Алюміній алюміній хлорид алюміній гідроксид алюміній оксид
![]()
![]()
![]() Барій барій гідроксид купрум гідроксид купрум сульфат
Барій барій гідроксид купрум гідроксид купрум сульфат
Завдання та порядок їх виконання.
- Виявлення йону плюмбуму в розчині.
Візьміть 1мл розчину плюмбум нітрату, чи іншу запропоновану сіль додайте 1 мл розчину калій йодиду. Що спостерігаєте? Запишіть дані, отримані в результаті досліду в бланк відповідей.
- Виявлення йону заліза (ІІІ) в розчині.
Візьміть 1мл розчину хлориду заліза( ІІІ) додайте 1 мл розчину жовтої кров’яної солі. Що спостерігаєте? Яку назву має отримана речовина. Запишіть дані, отримані в результаті досліду в бланк відповідей.
- Виявлення йонів алюмінію в розчині.
Налийте в пробірку 1мл розчину хлориду алюмінію і добавте до нього стільки ж розчину гідроксиду натрію. Що спостерігається? Чому? Напишіть рівняння реакції
- Виявлення йону купруму в розчині.
Налийте в пробірку 1мл розчину сульфату міді (ІІ) і добавте до нього стільки ж розчину гідроксиду натрію. Що спостерігається? Чому? Напишіть рівняння реакці
Література.
- Н. М. Буринська, Л.П. Величко. Хімія 10 §§ 11-12
- Література. П.П.Попель, Л.С. Крикля. Хімія 10.
Рис 1
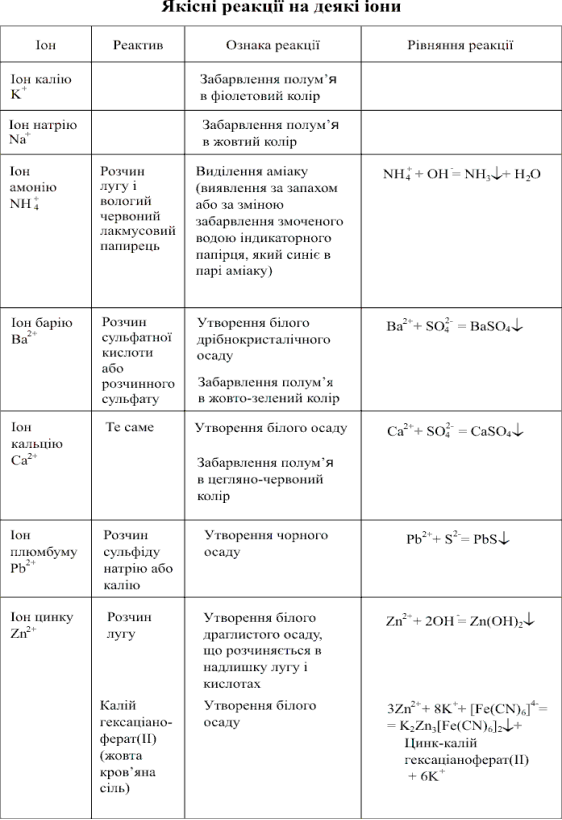
Лабораторно-практичне заняття №5
Тема: Розв’язування експерементальних задач
Мета:
перевірити й оцінити практичні вміння й навички учнів у розв'язанні експериментальних задач; скоригувати знання про властивості металів та їхніх сполук.
Тип заняття: практичного застосування знань, умінь і навичок.
Матеріальне забезпечення:
набір хімічних реактивів та посуду:
- Штатив з пробірками
- Fe, Mg
- H2SO4,
- NaOH,
- AlCl3,
- CuSO4
- CaCO3
Техніка безпеки:
- Звільніть робоче місце від усіх непотрібних для роботи предметів і матеріалів.
- Перевірте наявність і надійність посуду, приладів та інших предметів, необхідних для виконання завдання.
- Починайте виконувати завдання тільки з дозволу викладача.
- Хімічні речовини для досліду слід брати тільки в кількостях, передбачених інструкцією проведення досліду, або за вказівкою викладача.
- Перед тим, як взяти реактив, необхідний для досліду, прочитайте етикетку на тарі (банці або склянці), щоб попередити помилку.
- Не беріть реактиви незахищеними руками. Використовуйте для цього фарфорові ложечки, совочки та шпателі.
- Не зсипайте розсипаний і не зливайте розлитий реактив назад у тару до основної кількості реактиву.
- Тонкостінний посуд слід закріплювати в затискачах штативів обережно, злегка повертаючи навколо вертикальної вісі або переміщуючи вверх-вниз.
- Для змішування або розбавлення речовин, що супроводжуються виділенням тепла, а також для нагрівання хімічних речовин слід використовувати фарфоровий або теплостійкий скляний посуд.
- Розбавляючи концентровані кислоти, обережно доливайте кислоту у воду, а не навпаки.
- Користуйтеся піпетками та пастками, гумовими грушами для набирання рідких хімічних реактивів.
- Уразі потрапляння на шкіру кислоти слід негайно змити її залишки зі шкіри водою, а потім слабким розчином питної соди.
- Після закінчення роботи помийте руки з милом, зніміть халат і повісте його в шафу, призначену для зберігання спецодягу.
Теоретичні відомості:
Існують певні правила проведення хімічних реакцій практичних задач. По – перше напишіть рівняння реакції, яку ви збираєтесь проводити, а лише потім проводьте її з реактивами. Якщо у вас дана суха речовина (наприклад сіль), потрібно спершу зробити її розчин. Речовин для реакції брати в кількості 1-2 мл. Для відмірювання об’єму користуються мірними пробірками Дотримуйтесь техніки безпеки!
Контрольні запитання:
- Що таке якісна реакція?
- Що потрібно пам’ятати при роботі з кислотами?
Завдання та порядок їх виконання.
|
|
Варіант 1
|
Варіант 2
|
|
|
Використовуючи залізо, отримайте ферум(ІІ) сульфат |
Використовуючи магній, отримайте магній сульфат.
|
|
|
Використовуючи запропоновані реактиви, здійсніть реакції за схемою:
|
Використовуючи запропоновані реактиви, здійсніть реакції за схемою:
|
|
|
Здійсніть реакцію:
|
Здійсніть реакцію:
|
Занесіть результати роботи в бланк відповідей.
![]() Література.
Література.
1.П.П. Попель, Л.С. Крикля хімія 10- К.: Перун, 2018
2.П.П. Попель, Л.С. Крикля хімія 10- К.: Перун, 2010
Пояснювальна записка
Пропоновані методичні вказівки призначені для допомоги студентам при виконанні лабораторних робіт з хімії. Виконання лабораторних робіт є необхідним видом навчальної діяльності, який поглиблює знання з предмету, формує практичні навички роботи з лабораторним обладнанням та реактивами, сприяє перенесенню засвоєних знань вмінь та навичок на практику. Лабораторні роботи також мають і виховних аспект: сприяють розвитку самостійності, відповідальності, трудовому вихованню.
При виконанні робіт студенти діляться на підгрупи. В підгрупах студенти діляться по двоє, кожна пара має набір реактивів для виконання завдань. Виключенням є лабораторна робота № 3, де студенти діляться на 2 підгрупи по 6-8 чоловік, кожна з яких виконує один з варіантів лабораторної роботи.
Вказівка до кожної лабораторної роботи містить мету роботи, техніку безпеки при виконанні роботи з кислотами, лугами, нагрівальними приладами та загальні вимоги техніки безпеки при перебуванні в лабораторії; теоретичні основи для виконання тієї чи іншої роботи. Також наявні контрольні запитання по яким студент може зробити самоперевірку знань та готовність до виконання завдань лабораторної роботи. Кожне завдання роботи має інструкції, як правильно проводити дослід. Результати дослідів студенти заносять в спеціальні бланки (див. додаток), що значно полегшує процес оформлення звіту .
Лабораторно-практичне заняття №1
Студента ___________________________
Група____________________________
Тема: Вивчення властивостей оцтової кислоти.
Мета:
- навчитись на практиці застосовувати знання з хімії, розширювати кругозір шляхом пізнання додаткового навчального матеріалу на лабораторних заняттях,
- проводити трудове виховання, а саме : навчитись правильно користуватись хімічним посудом та ін. обладнанням.
Матеріальне забезпечення:
- хімічний посуд,
- розчин оцтової кислоти,
- Універсальний індикатор
- Mg
- NaOH.
- CaCO3 чи Na2CO3
Завдання та порядок їх виконання:
1.Дія на індикатори.
Виконайте дослід згідно інструкції. Запишіть результати:
- Кроки проведеннядосліду__________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________
- Ознаки реакції____________________________________________________________________
_______________________________________________________________________________________
- Рівняння реакції__________________________________________________________________
______________________________________________________________________________________
- Висновок ________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2.Взаємодія з металами.
Виконайте дослід згідно інструкції. Запишіть результати:
- Кроки проведеннядосліду__________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Ознаки реакції____________________________________________________________________
_______________________________________________________________________________________
- Рівняння реакції___________________________________________________________________
_______________________________________________________________________________________
- Висновок _________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________
3.Взаємодія з лугами.
Виконайте дослід згідно інструкції. Запишіть результати:
- Кроки проведеннядосліду__________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Ознаки реакції____________________________________________________________________
_______________________________________________________________________________________
- Рівняння реакції___________________________________________________________________
_______________________________________________________________________________________
- Висновок _________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________
4.Взаємодія з солями.
Виконайте дослід згідно інструкції. Запишіть результати:
- Кроки проведеннядосліду__________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Ознаки реакції____________________________________________________________________
_______________________________________________________________________________________
- Рівняння реакції___________________________________________________________________
_______________________________________________________________________________________
- Висновок _________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольні запитання
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторно-практичне заняття №2
Студента ___________________________
Група____________________________
Тема: Вивчення властивостей вуглеводів.
Мета:
ознайомитись з хімічними властивостями глюкози як альдегідоспирту спостерігати реакцію крохмалю з водою та дізнатись про якісну реакцію на крохмаль
Матеріальне забезпечення:
- хімічний посуд
- NaOH
- CuSO4
- розчин глюкози,
- Крохмаль
- розчин йоду спиртовий.
Завдання та порядок їх виконання:
Виконайте дослід згідно інструкції. Запишіть результати:
1.Якісна реакція на глюкозу
Кроки проведеннядосліду______________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції________________________________________________________________________________
_______________________________________________________________________________________
Рівняння реакції_________________________________________________________________________________
_______________________________________________________________________________________
Висновок ______________________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2.Утворення декстрину. Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду______________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________
Ознаки реакції_________________________________________________________________________________
_______________________________________________________________________________________
Рівняння реакції_________________________________________________________________________________
_______________________________________________________________________________________
Висновок ______________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3.Якісна реакція на крохмаль Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду______________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Висновок ______________________________________________________________________________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольні запитання
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторно-практичне заняття №3
Студента_____________________________
Група________________________
Тема: Якісні реакції на йони неметалів
Мета:
- навчитись на практиці застосовувати знання з хімії,
- розширювати кругозір шляхом пізнання додаткового навчального матеріалу на лабораторних заняттях,
- проводити трудове виховання, а саме : навчитись правильно користуватись хімічним посудом та ін. обладнанням.
Матеріальне забезпечення:
- сульфат амонію (розчин10%)
- натрій гідроксид (розчин),
- барій хлорид(розчин),
- фосфатна кислота (розб.),
- натрій хлорид (чи інша сіль), папірець універсального індикатора,
- аргентум нітрат (розчин).
Завдання та порядок їх виконання:
- Виявлення хлорид – йону в розчині.
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________
Висновок _____________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Виявлення сульфат – йону в розчині.
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________
_______________________________________________________________________________________
Висновок _______________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________ Виконайте дослід згідно інструкції. Запишіть результати:
3.Виявлення іонів амонію в розчині.
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________
_______________________________________________________________________________________
Висновок _______________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
4.Виявлення іонів амонію в розчині.
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________
_______________________________________________________________________________________
Висновок _______________________________________________________________________________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5.Силікат- йон. Добування силікатної кислоти.
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________
_______________________________________________________________________________________
Висновок
_____________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Контрольні запитання
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторно-практичне заняття №4
Студента_____________________________
Група________________________
Тема: Якісні реакції на йони металів
Мета:
- навчитись на практиці застосовувати знання з хімії,
- розширювати кругозір шляхом пізнання додаткового навчального матеріалу на лабораторних заняттях,
- проводити трудове виховання, а саме : навчитись правильно користуватись хімічним посудом та ін. обладнанням.
Матеріальне забезпечення:
Хімічний посуд: пробірки з штативом
Реактиви:
- Плюмбум нітрат
- Калій йодид
- Алюміній хлорид
- Натрій гідроксид
- Жовта кровяна сіль K4[Fe(CN)6].
- Купрум сульфат
Завдання та порядок їх виконання:
- Виявлення хлорид – йону в розчині.
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________
Висновок _____________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
- Виявлення сульфат – йону в розчині.
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________
_______________________________________________________________________________________
Висновок _______________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________ Виконайте дослід згідно інструкції. Запишіть результати:
3.Виявлення іонів амонію в розчині.
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________
_______________________________________________________________________________________
Висновок _______________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
4.Виявлення іонів амонію в розчині.
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________
_______________________________________________________________________________________
Висновок _______________________________________________________________________________________
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5.Силікат- йон. Добування силікатної кислоти.
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції_________________________________________________________________________
_______________________________________________________________________________________
Висновок
_____________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Контрольні запитання
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторно-практичне заняття №5
Студента_____________________________
Група________________________
Тема: Розв’язування експерементальних задач
Мета:
перевірити й оцінити практичні вміння й навички учнів у розв'язанні експериментальних задач; скоригувати знання про властивості металів та їхніх сполук.
Тип заняття: практичного застосування знань, умінь і навичок.
Матеріальне забезпечення:
набір хімічних реактивів та посуду:
- Штатив з пробірками
- Fe, Mg
- H2SO4,
- NaOH,
- AlCl3,
- CuSO4
- CaCO3
Дослід 1
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________
Висновок _____________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 2
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________
Висновок _____________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 3
Виконайте дослід згідно інструкції. Запишіть результати:
Кроки проведеннядосліду________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Ознаки реакції__________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________
Рівняння реакції________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________
Висновок _____________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольні запитання
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________


про публікацію авторської розробки
Додати розробку
