Лабораторний практикум. Робота №5 ТЕМА :Визначення електрохімічного еквівалента міді
11клЛабораторний практикум . Робота №5
ТЕМА :Визначення електрохімічного еквівалента міді
Мета роботи: визначити електрохімічний еквівалент міді застосовуючи закон Фарадея для електролізу для визначення елементарного електричного заряду.
Обладнання: склянка з водним розчином сульфату міді (CuSO4); електроди; джерело постійного струму; прилад для вимірювання часу; амперметр постійного струму на 1...2 А; терези з важками; реостат з ковзним контактом; вимикач; з'єднувальні провідники
Хід роботи:
1.Прослухав інструктаж з т.б. під час виконання роботи.
2.Ретельно очистити поверхню мідних пластин наждачним папером.
 3.Виміряти масу катода m1 до проведення досліду з точністю до 0,01г.
3.Виміряти масу катода m1 до проведення досліду з точністю до 0,01г.
4. Закріпити електроди у тримачі (зважену пластинку з’єднати з від’ємним полюсом джерела) і, не занурюючи їх у ванну з розчином,
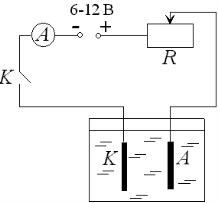
5. скласти електричне коло за схемою
6. Занурити електроди у ванну з розчином, замкнути коло, встановити за допомогою реостата силу струму в колі не більшу 1А і зафіксувати час.
7. Процес електролізу повинен тривати 15-20 хвилин, при цьому силу струму в колі підтримуйте незмінною (за допомогою реостата).
9.Визначити масу мідіm, що виділилась на катодіm=m2-m1.
10 Використовуючи переший закон Фарадея та отримані данні обчислити електрохімічний еквівалент міді
Закон Фарадея. Вчений встановив залежність маси речовини, виділеної на електроді, від заряду, який пройшов через електроліт.
m = kIt або m=kq
m- маса речовини, кг, г, мг
k-електрохімічний еквівалент речовини, див в таблиці
I- сила струму, А ![]() I= m/kt, I= q/t
I= m/kt, I= q/t
t- час електролізу, с t=m/Ik
q- заряд, Кл q=m/k, q= It
. Дивимось таблицю значень електрохімічних еквівалентів. Знайдіть значення k для міді. -0,33 мг/Кл
В ролі електроліта у нас розчин сульфату міді (мідний купорос).Тобто на катоді буде осідати…..(мідь)-. Будемо визначати масу електрода через 10 с, 20 с
11.. Результати вимірювань та обчислень занести до таблиці
|
№ |
Час, с |
Сила струму,І А |
Початкова маса катода, m0, г |
Маса катода після досліду, m1, г |
Маса виділеної речовини m=m1-m0, г |
к, табличне, г/Кл |
к |
|
1 |
10 |
2 |
28 |
29,43 |
1,43 |
33 |
|
|
2 |
15 |
3 |
28 |
29,97 |
1,97 |
33 |
|
|
3 |
20 |
4 |
28 |
32,12 |
4,12 |
33 |
|
Розрахунки :
Висновок

про публікацію авторської розробки
Додати розробку
