Металічні та водневі зв'язки. Презентація
Про матеріал
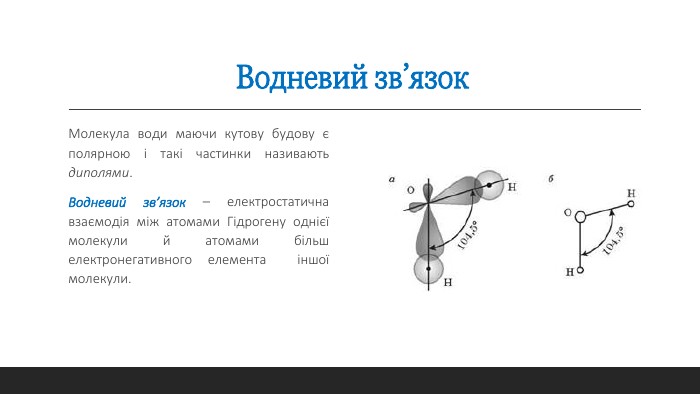
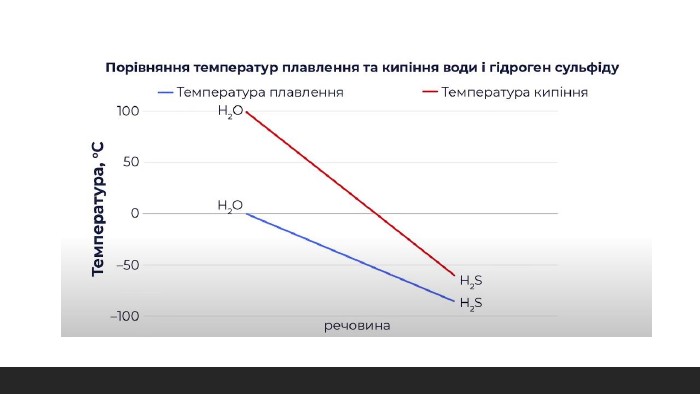
Металічний зв'язок. Водневий зв'язок. Властивості. Молекула води. Диполь. Метали та їх властивості. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку