МЕТОДИЧНА РОЗРОБКА ЛАБОРАТОРНОГО ЗАНЯТТЯ З ДИСЦИПЛІНИ "ВЛАСТИВОСТІ СПОЛУК ЕЛЕМЕНТІВ I B ГРУПИ"
КЗ ЛОР «САМБІРСЬКИЙ ФАХОВИЙ МЕДИЧНИЙ КОЛЕДЖ»
ЦИКЛОВА КОМІСІЯ ХІМІЧНИХ ДИСЦИПЛІН
Властивості сполук
елементів I B групИ
МЕТОДИЧНА РОЗРОБКА
ЛАБОРАТОРНОГО ЗАНЯТТЯ
З ДИСЦИПЛІНИ
«НЕОРГАНІЧНА ХІМІЯ»
для студентів ІІ курсу
спеціальності 226 Фармація, промислова фармація

Самбір
КЗ ЛОР «САМБІРСЬКИЙ ФАХОВИЙ МЕДИЧНИЙ КОЛЕДЖ»
ЦИКЛОВА КОМІСІЯ ХІМІЧНИХ ДИСЦИПЛІН
Властивості сполук
елементів I B групИ
МЕТОДИЧНА РОЗРОБКА
ЛАБОРАТОРНОГО ЗАНЯТТЯ
З ДИСЦИПЛІНИ
«НЕОРГАНІЧНА ХІМІЯ»
для студентів ІІ курсу
спеціальності 226 Фармація, промислова фармація
Підготувала:
викладач дисципліни «Неорганічна хімія»
КОВНАЦЬКА О.М.
Назва дисципліни: Неорганічна хімія
Спеціальність: 226 Фармація, промислова фармація
Курс ІІ група: 2Б фр
Тема: «Властивості сполук елементів I B групИ»
Тривалість: 80хв.
і. актуальність теми
З великої групи d – елементів до біогенних належать вісім найважливіших елементів: Fe, Cu, Zn, Mn, Co, Ni, Cr, Mo, концентрацію яких в організмі достовірно встановлено і їхню фізіологічну роль доведено.
Купрум Cu – незамінний компонент багатьох ферментів і білків, що відіграють важливу роль в ОВР; бере участь у процесах кровотворення, дихання тканин, сприяє синтезу гемоглобіну.
Іі. Навчальні цілі заняття
Знати:
- загальну характеристику елементів ІВ групи;
- фізичні та хімічні властивості міді;
- фізичні та хімічні властивості сполук Купруму;
- якісні реакції на катіон Cu2+;
- біологічну роль та медичне застосування сполук Купруму.
Вміти:
- добувати Купруму (ІІ) гідроксид та перевіряти його властивості;
- добувати комплексні сполуки Купруму (ІІ);
- проводити якісні реакції на катіон Сu2+;
- проводити гідроліз солей Купруму;
- розв‘язувати експериментальні задачі та записувати відповідні рівняння реакцій.
Практичні навички:
- виконання дослідів на якісне визначення йонів;
- відтворювання методики виконання дослідів та пояснення їх результатів;
- оформлення звіту та формулювання висновків лабораторної роботи.
ІІі. Цілі розвитку особистості (виховні цілі):
- сприяти формуванню критичного мислення;
- розвивати вміння співпрацювати, відчувати себе членом команди, брати відповідальність на себе, аналізувати результати діяльності;
- виховувати у студентів відповідальне ставлення до навчання;
- виховувати почуття відповідальності за свої дії та обов'язку;
- прищеплювати студентам любов до майбутньої професії фармацевта;
- залучення студентів до пошукової роботи, розвиваючи тим самим креативне мислення;
- прищеплювати студентам бажання до просвітницької роботи серед населення.
IV. Міждисциплінарна інтеграція
|
І. |
Попередні (забезпечуючі) дисципліни
|
|
|
|
1. Фізика |
1. Фізичні властивості металів. |
|
|
2.Хімія |
|
|
|
3. Техніка лабораторних робіт |
1. Правила виконання найбільш важливих лабораторних робіт. 2. Робота з лабораторним посудом, нагрівальними приладами, хімічними реактивами тощо. |
|
ІІ. |
Наступні дисципліни, ті що забезпечуються
|
|
|
|
|
|
|
|
2. Фармацевтична хімія |
1. Проведення фармакопейних та нефармакопейних реакцій для якісного виявлення йонів. |
|
|
|
|
|
|
|
|
|
ІІІ. |
Внутрішньодисциплінарна інтеграція |
|
|
|
Неорганічна хімія |
|
V. Матеріальне забезпечення: мультимедійний проектор, комп′ютер, мультимедійна презентація Power Point, дидактичні матеріали, періодична система Д.І.Менделєєва; таблиця розчинності кислот, основ, солей; електрохімічний ряд напруг.
Обдаднання:
- Штатив з пробірками, піпетки, сухе пальне, мікрошпатель, скляні палички.
Реактиви:
- Гідроксиди: Натрій гідроксид NaOH, амоній гідроксид NH4OH;
- Кислоти: сульфатна кислота H2SO4;
- Солі: Купрум (II) сульфат CuSO4, Натрій сульфід Na2S, Натрій карбонат Na2CO3, калій гексаціаноферат (ІІ) К4[Fe(CN)6 ], Натрій тіосульфат (кристалічний ) Na2S2O3;
- Метали: залізо, цинк;
- Індикатори:- синій і червоний лакмусові папірці, метилоранж.
VІ. ПЛАН ТА ОРГАНІЗАЦІЙНА СТРУКТУРА ЗАНЯТТЯ
|
N п/п |
Основні етапи і навчально-цільові питання |
Навчальні цілі в рівнях засвоєння |
Методи контролю і навчання |
Матеріали методичного забезпечення |
Розподіл часу у хв. |
|
ПІДГОТОВЧИЙ ЕТАП – 7-20 хв. |
|||||
|
1. 2.
3. |
Організація заняття |
|
|
Журнал |
1 хв. |
|
Постановка навчальних цілей та мотивація |
|
|
Слайд «Навчальні цілі» Слайд «Актуальність теми» |
2 хв. |
|
|
Контроль вихідного рівня знань, вмінь, навичок:
1. Контроль базових знань
|
І ІІІ
|
усно, фронтально ситуаційна задача
|
слайди тести на доповнення
|
10-25% |
|
|
ОСНОВНИЙ ЕТАП –– 48- 72 хв. |
|||||
|
4. |
Формування професійних вмінь та навичок: Робота №1. Вивчення властивостей сполук Купруму Дослід № 1. Одержання Купрум (ІІ) гідроксиду та Купрум (ІІ) оксиду. Дослід № 2. Відношення Купрум (ІІ) гідроксиду до кислот і лугів.
Дослід № 3. Одержання Купрум (ІІ) сульфіду. Дослід № 5. Гідроліз солей Купруму (II).
Робота №2. Одержання комплексних сполук Купруму Дослід № 6. Одержання амінокомплексу Купруму (II). Дослід № 7. Одержання малорозчинної сполуки Купруму (II) з комплексним аніоном.
Робота №3. Витіснення Купруму з солей активнішими металами Дослід № 8. Відновлення йонів Cu2+ до вільного металу.
Перевірка самостійної роботи (студентські проекти)
|
ІІІ
ІІІ
ІІІ
ІІІ
|
Лабораторна робота. Запис рівнянь хімічних реакцій та формулювання висновків експериментального дослідження
Лабораторна робота. Запис рівнянь хімічних реакцій та формулювання висновків експериментального дослідження
Лабораторна робота. Запис рівнянь хімічних реакцій та формулювання висновків експериментального дослідження
усно, фронтально презентація студентського проекту
|
Інструкції лабораторної роботи, лабораторне обладнання та реактиви
Інструкції лабораторної роботи, лабораторне обладнання та реактиви
Інструкції лабораторної роботи, лабораторне обладнання та реактиви
Слайди, реферати
|
60-90% |
|
ЗАКЛЮЧНИЙ ЕТАП 8-16 хв. |
|||||
|
5. |
Контроль та корекція рівня професійних вмінь і навичок |
III |
Індивідуальний контроль навичок |
Результати лабораторної роботи, задачі
|
10-20%
|
|
6. |
Підведення підсумків заняття |
|
Аналіз результатів лабораторної роботи, тестування |
Тести ІІІ р. Результати лабораторного дослідження |
|
|
7. |
ДОМАШНЄ ЗАВДАННЯ: - Підготуватись до модульного контролю №2 з розділу «Неорганічна хімія» РЕКОМЕНДОВАНА ЛІТЕРАТУРА: Основна: Левітін Є.Я. Загальна та неорганічна хімія В:Нова кн.,2003 р., ст. 272-459 Додаткова: Романова Н.В. Загальна та неорганічна хімія К.: Ірпінь : ВТФ “Перун”, 2002 р., ст. 209-457 - Опрацювати базу завдань модульного контролю №2. Вебсервіс Google Classroom.
|
|
|
МР №12 |
|
VІІ. МАТЕРІАЛИ МЕТОДИЧНОГО ЗАБЕЗПЕЧЕННЯ ПІДГОТОВЧОГО ЕТАПУ
VІІ. 2. МАТЕРІАЛИ КОНТРОЛЮ ДЛЯ ПІДГОТОВЧОГО ЕТАПУ ЗАНЯТТЯ
ПИТАННЯ ДЛЯ ФРОНТАЛЬНОГО ОПИТУВАННЯ:
- Дайте загальну характеристику елементів ІВ групи.
- Охарактеризуйте елемент Купрум за його положенням у періодичній системі.
- Напишіть електронну структуру атома Купруму.
- Опишіть поширення сполук Купруму у природі та основні сполуки цього елемента.
- Поясніть чому мідь у вологому повітрі поступово вкривається зеленою плівкою Купрум (ІІ) гідроксокарбонату Сu2(ОН)2СО3?
- Охарактеризуйте фізичні властивості міді.
- Перерахуйте хімічні властивості міді.
- Опишіть властивості Купрум (ІІ) гідроксиду.
- Опишіть властивості солей Купруму.
- Чому солі Купруму піддаються гідролізу?
- Яке середовище створюють солі Купруму внаслідок гідролізу?
- Які якісні реакції на катіони Сu2+ вам відомі?
ЗАВДАННЯ:
- Виберіть твердження, яке характеризує взаємодію перехідних металів з водою:
а) реагують активно з утворенням гідроксиду та водню;
б) не реагують;
в) реагують повільно з утворенням основних оксидів;
г) реагують лише при нагріванні.
- Заповніть пропуски
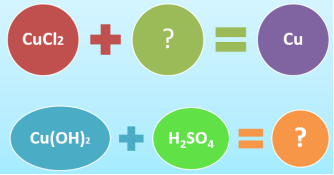
- ЕКСПЕРИМЕНТАЛЬНА ЗАДАЧА
Запропонуйте спосіб розпізнати кристалічні речовини:
Купрум (ІІ) сульфат та Магній (ІІ) сульфат
 VІІ. 2. МАТЕРІАЛИ МЕТОДИЧНОГО ЗАБЕЗПЕЧЕННЯ ОСНОВНОГО ЕТАПУ ЗАНЯТТЯ
VІІ. 2. МАТЕРІАЛИ МЕТОДИЧНОГО ЗАБЕЗПЕЧЕННЯ ОСНОВНОГО ЕТАПУ ЗАНЯТТЯ
ПРАВИЛА БЕЗПЕЧНОЇ РОБОТИ З ЇДКИМИ РЕЧОВИНАМИ
- Роботу з великою кількістю кислот і лугів проводьте у захисних окулярах.
- Розчини кислот і лугів готуйте у тонкостінному посуді; кислоту вливайте у воду малими порціями при перемішуванні.
- При розведенні кислот їх доливайте у воду, а не навпаки.
- Розлиту кислоту або луг засипте піском, а потім приберіть совком з щіткою. Забруднене місце нейтралізуйте содою, якщо розлита кислота; або слабким розчином оцтової кислоти, якщо розлитий луг.
- Користуючись кристалічними лугами, не стряхуйте їх, щоб пилоподібні часточки лугу не попадали на руки та одяг; беріть тільки шпателем або пинцетом. Розсипаний луг зразу приберіть, а стіл вимийте і витріть.
- Забороняється виливати в каналізацію розчини кислот і лугів без нейтралізації.
- Остерігайтеся потрапляння реактивів на одяг, шкіру, в очі; у разі потрапляння їдкої речовини її слід негайно змити великою кількістю води.
ПЕРША ДОПОМОГА ПРИ ОПІКАХ КОНЦЕНТРОВАНИМИ КИСЛОТАМИ ЧИ ЛУГАМИ
- При попаданні концентрованих кислот або лугів на руки чи обличчя, пошкоджену ділянку слід негайно промити протягом 10-15 хвилин проточною водою. Потім прикласти ватний тампон, змочений розчином: 2% Натрій гідрогенкарбонату (при опіках концентрованими кислотами), або 2% оцтової кислоти (при опіках концентрованими лугами), ополоснути водою і накласти марлеву пов’язку з риванолом чи фурациліном.
- При опіках порожнини рота після промивання проточною водою необхідно кілька разів прополоскати рот розчином Натрій гідрогенкарбонату (при опіках кислотами), або розчином оцтової кислоти (при опіках лугами). При попаданні крапель кислоти або лугу в очі промити їх проточною водою протягом 15 хвилин, а потім 2% р-ном Натрій гідрогенкарбонату (при опіках кислотами), або 2% розчином борної кислоти (при опіках лугами).
- Після надання допомоги потерпілого скерувати на консультацію у медичний заклад.
ХІД САМОСТІЙНОЇ РОБОТИ
Робота №1. Вивчення властивостей сполук Купруму
Дослід №1. Одержання Купрум (ІІ) гідроксиду та Купрум (ІІ) оксиду
Виконання досліду : До 5-7 крапель розчину Купрум (ІІ) сульфату додайте по краплях розчин Натрій гідроксиду до утворення осаду Купрум (ІІ) гідроксиду. Нагрійте пробірку з отриманим осадом. Відмітьте зміну забарвлення осаду внаслідок розкладу Купрум (II) гідроксиду.
РОБОТА З ЛУГАМИ ПОТРЕБУЄ ОБЕРЕЖНОСТІ (ТБ ! )
Завдання і запитання:
1. Напишіть рівняння реакцій утворення Купрум(ІІ) гідроксиду та Купрум(ІІ) оксиду.
2. Зробіть висновок про способи отримання гідроксиду та оксиду Купруму(ІІ).
|
Спостереження |
Рівняння реакції |
|
|
|
Дослід №2. Відношення Купрум (ІІ) гідроксиду до кислот і лугів
Виконання досліду: У двох пробірках отримати Купрум (ІІ) гідроксид і додати: в першу – надлишок концентрованого розчину гідроксиду Натрію (Калію), в другу - 2н розчину сульфатної кислоти.
Завдання і запитання:
1. Що відбувається в пробірках?
2. Напишіть відповідні рівняння реакцій.
3.Зробіть висновок про властивості гідроксиду та оксиду Купруму(ІІ).
|
Спостереження |
Рівняння реакції |
|
|
|
Дослід №3. Одержання Купрум (ІІ) сульфіду
(якісна реакція)
Виконання досліду: В пробірку внести 3-4 краплі 0,5н розчину Купрум (ІІ) сульфату і добавити стільки ж крапель Натрій сульфіду.
Завдання і запитання:
- Відмітьте колір утвореного осаду Купрум (ІІ) сульфіду.
- Чи розчиняється осад CuS у концентрованому розчині нітратної кислоти?
- Напишіть рівняння відповідних реакцій.
|
Спостереження |
Рівняння реакції |
|
|
|
Дослід № 4. Якісна реакція на катіони Cu 2+ з Натрій тіосульфатом
Виконання досліду: У пробірку слід помістити 3-4 краплі розчину солі Купруму (ІІ), додати 1-2 краплі розчину сульфатної кислоти і декілька кристаликів твердого Натрій тіосульфату. Спостерігають утворення осаду. Нагрійте пробірку з осадом до зміни забарвлення.
Завдання і запитання:
- Напишіть рівняння відповідних реакцій.
- Який колір утвореного осаду Купрум (ІІ) тіосульфату і як змінюватиметься його забарвлення при нагріванні?
|
Спостереження |
Рівняння реакції |
|
|
|
Дослід № 5. Гідроліз солей Купруму (II)
Виконання досліду: В дві пробірки внесіть по 2-3 краплі 0,5н розчину Купрум (II) сульфату (або хлориду) і за допомогою індикатора визначіть реакцію середовища. В одну пробірку додайте 2‑3 краплі 2н розчину Натрій карбонату. Спостерігайте утворення зеленого осаду Купрум (ІІ) гідроксокарбонату і виділення газу.
Завдання і запитання:
- Написати рівняння реакції гідролізу солі Купруму(II) в молекулярному і йонному вигляді.
- Чому карбонат – йон прискорює гідроліз солі Купруму (II)?
|
Спостереження |
Рівняння реакції |
|
|
|
Робота №2. Одержання комплексних сполук Купруму
Дослід № 6. Одержання амінокомплексу Купруму (II)
(фармакопейна реакція)
Виконання досліду. В пробірку з 0,5н розчином Купрум (II) сульфату (3 - 4 краплі) додайте по краплям розчин амоніаку. Спостерігайте утворення основної солі (CuOH)2SO4. Доливайте реактив до повного розчинення осаду, спостерігайте зміну забарвлення.
Завдання і запитання:
- Напишіть рівняння реакцій одержання основної солі Купруму і її взаємодію з розчином амоніаку.
- Відмітьте забарвлення амінокомплексу Купруму (II).
|
Спостереження |
Рівняння реакції |
|
|
|
Дослід № 7. Одержання малорозчинної сполуки Купруму (II) з комплексним аніоном (якісна реакція з жовтою кров’яною сіллю)
Виконання досліду. В пробірку, що містить 4-5 крапель розчину Купрум (ІІ) сульфату, добавте стільки ж крапель розчину комплексної солі K4[Fe(CN)6].
Завдання і запитання:
- Напишіть рівняння реакції в молекулярному і йонному вигляді.
- Відмітьте колір утвореного осаду.
|
Спостереження |
Рівняння реакції |
|
|
|
Робота №3. Витіснення Купруму з солей активнішими металами
Дослід № 8. Відновлення йонів Cu2+ до вільного металу
Виконання досліду. У дві пробірки наберіть невелику кількість Купрум(ІІ) сульфату. У першу пробірку занурте залізну, а в другу — цинкову пластину (або гранули).
Завдання і запитання:
- Що спостерігаєте?
- Складіть відповідні рівняння реакцій.
- Чи зміняться ознаки реакції, якщо використати срібну пластину?
- Зробіть висновок, де обґрунтуйте можливість взаємодії солей із металами з погляду розташування металів у ряді активності.
|
Спостереження |
Рівняння реакції |
|
|
|
Робота №4. Представлення студентських проектів
План
- Біоглогічна роль сполук Купруму.
- Наслідки дефіциту і надлишку сполук Купруму для організму людини.
- Застосування сполук Купруму у медицині та фармації.
VІІ. 3. МАТЕРІАЛИ МЕТОДИЧНОГО ЗАБЕЗПЕЧЕННЯ ЗАКЛЮЧНОГО ЕТАПУ
І. ПИТАННЯ ДЛЯ САМОКОНТРОЛЮ:
- Як мідь взаємодіє з концентрованими та розбавленими кислотами? Чи впливає температура на цю взаємодію?
- Як можна добути Купрум (ІІ) гідроксид та Купрум (ІІ) оксид? Які властивості вони проявляють?
- Які властивості (окисні чи відновні) проявляє Купрум (ІІ) у своїх сполуках?
- Які реактиви є якісними на йон Cu 2+?
- Чому мідь не реагує з водою за кімнатної температури?
- Встановіть відповідність між реагентами і продуктами реакції:

ІІ. КОНТРОЛЬ ЗНАНЬ: тестування у Classtime
|
|
ТЕСТИ з теми «Властивості сполук елементів ІВ групи»
|
1. Купрум (II) сульфат використовують в офтальмології, гінекології, урології, а також як протиотруту при отруєнні білим фосфором. При взаємодії з надлишком водного розчину аміаку CuSO4 утворює сполуку, яка містить йон:
А. [Cu(NH3 )4 ]2+
B. CuOH+
C. [Cu(OH)NH3 ]+
D. [Cu(NH3)2 ]+
E. [Cu(H2O)4 ]2+
2. Відновлення катіонів Cu2+ до металічної міді можна здійснити за допомогою
А. Ag
B. Zn
C. Hg
D. Na
E. K
3. Закінчити рівняння реакції, вказати суму коефіцієнтів:
СuSO4 + K4[Fe(CN)6 ] →
А. 10
B. 9
C. 12
D. 5
E. 6
4. У якій кислоті мідь розчиняється за кімнатної температури з утворенням солей Cu (II)
А. розв. HNO3
B. HCl
C. розв. H2SO4
D. розв. H3РO4
E. НІ
5. Взаємодія міді з концентрованою сульфатною кислотою супроводжується виділенням:
А. H2S
B. H2
C. S
D. SO2
E. SO3
6. Деякі сполуки, які знаходять застосування при дослідженнях фармпрепаратів, стійкі тільки у кислотному середовищі. Яку сіль треба розчинити у воді, щоб збільшити в ній концентрацію йонів Гідрогену?
А. СuSO4
B. Cu3(PO4)2
C. Cu(CH3COO)2
D. CuCO3
E. CuS
7. Купрум відіграє важливу роль в багатьох процесах, що відбуваються в організмі. Біологічна активність Купруму зумовлена здатністю йонів Cu2+:
А. руйнувати клітинні мембрани
B. зв’язувати вуглекислий газ
C. утворювати координаційні сполуки з біолігандами
D. підтримувати сталий осмотичний тиск біологічних рідин
E. стабілізувати клітинні мембрани
8. Купрум (ІІ) гідроксид проявляє амфотерні властивості тому що:
А. розкладається при нагріванні
B. диспропорціонує
C. реагує тільки з кислотами
D. реагує з кислотами і основами
E. реагує тільки з основами
9. Для перехідних металів характерна здатність до:
А. регулювання кислотно-основних властивостей біосистем
B. регулювання кислотних властивостей біосистем
C. участі тільки у реакціях комплексоутворення
D. участі тільки в окисно-відновних процесах
E. участі в окисно-відновних процесах та комплексоутворення
10. При вивченні хімії біогенних елементів треба знати приблизну розчинність речовин. Які йони не можуть одночасно знаходитись в розчині?
А. Cu2+, OH–
B. Cu2+, SO42–
C. Cu2+, Br–
D. Cu2+, Cl–
E. Cu2+ , NO3 –
11. Червона кров’яна сіль K3[Fe(CN)6] з розчинами солей Купруму (ІІ) утворює:
А. білий осад
B. чорний осад
С. синій розчин
D. червоно-бурий осад
Е. волошковий розчин
12. Який продукт утвориться при розчиненні Cu(OH)2 у надлишку концентрованого КОН?
А. K2 [Cu(OH)4]
B. реакція не проходить
C. [Cu(H2O)4 ](OH)2
D. K[Cu(OH)3]
E. [Cu(OH)2(H2O)2]
13. Фармакопейною реакцією на катіон Купруму (ІІ) є взаємодія з розчином:
А. амоніаку
B. Натрій тіосульфату
C. Натрій сульфіду
D. Натрій гідроксиду
E. Калій гексаціаноферату (ІІ)
14. При взаємодії надлишку розчину амоній гідроксиду з розчином Купрум(II) сульфату утворюється:
А. блакитнувато – зелений осад
B. волошковий розчин
C. білий осад
D. чорний осад
E. червоно – бурий осад
15. Чорний осад утворюється внаслідок додавання до розчину CuSO4:
А. NaOH
B. NH4OH
C. Na2S
D. Zn
E. Fe
16. Внаслідок взаємодії яких речовин утвориться Купрум (ІІ) гідроксид:
А. СuSO4 i NaOH
B. CuSO4 i NH4OH
C. Cu i H2O
D. CuO i H2O
E. СuCO3 i NaOH
17. Кристалогідрат CuSO4 ⋅5H2O використовують у медичній практиці:
А. як в’яжучий та антисептичний засіб
B. як седативний засіб
C. як антацидний засіб
D. як гіпоглікемічний засіб
E. як протизапальний препарат
18. Купрум(ІІ) гідроксид утворює з лугами комплексні сполуки, в яких Купрум проявляє координаційне число
А. 3
B. 6
C. 4
D. 5
E. 2
19. Яка з наведених формул відповідає електронній конфігурації атома Купруму

20. Яке молекулярне рівняння відповідає такому скороченому йонному рівнянню?
Cu2+ + S2- = CuS
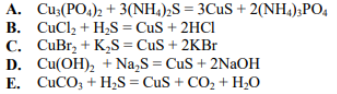
ЕТАЛОН ВІДПОВІДЕЙ ДО ТЕСТІВ
з теми «Властивості сполук елементів ІВ групи»
|
|
A |
11. |
D |
|
|
B |
12. |
A |
|
|
E |
13. |
A |
|
|
A |
14. |
B |
|
|
D |
15. |
C |
|
|
A |
16. |
A |
|
|
C |
17. |
A |
|
|
D |
18. |
C |
|
|
E |
19. |
A |
|
|
A |
20. |
C |
ПІДСУМКИ ЗАНЯТТЯ. ОГОЛОШЕННЯ ОЦІНОК


VІІІ. ДОМАШНЄ ЗАВДАННЯ
- Підготуватись до модульного контролю №2 з розділу
«Неорганічна хімія»
РЕКОМЕНДОВАНА ЛІТЕРАТУРА:
Основна: Левітін Є.Я. Загальна та неорганічна хімія
В:Нова кн.,2003 р., ст. 272-459
Додаткова: Романова Н.В. Загальна та неорганічна хімія
К.: Ірпінь : ВТФ “Перун”, 2002 р., ст. 209-457
- Опрацювати базу завдань модульного контролю №2.
Вебсервіс Google Classroom.
1

про публікацію авторської розробки
Додати розробку

