Методична розробка практичного заняття з дисципліни "Медична хімія" на тему: "Комплексні сполуки. Вчення про розчини".
Комунальний вищий навчальний заклад
«Нікопольський медичний коледж»
Дніпропетровської обласної ради»
Методична розробка
практичного заняття № 1
з дисципліни «Медична хімія»
Тема: «Комплексні сполуки. Вчення про розчини».
Спеціальність 223 «Медсестринство»
Спеціалізація «Лікувальна справа»
Курс: І Семестр: І
Кількість навчальних годин: 4
Викладач: Шевченко В.Г.

Розглянуто та схвалено на засіданні циклової
комісії природничо-наукових дисциплін
Протокол від «_______________» № ____
Голова циклової комісії ______С.В. Говоруха
Тема заняття: Комплексні сполуки. Вчення про розчини.
Кількість навчальних годин: 4 години.
1. Актуальність теми
Комплексні сполуки - це сполуки з особливою будовою і типом зв’язку. Значна кількість природних сполук є комплексними за будовою, властивостями та біологічною дією. Металоферменти, гемоглобін, міоглобін, вітамін В12, хлорофіл - ось приклади фізіологічно активних речовин, що є комплексними сполуками. Особлива група сполук, яка здатна утворювати комплекси з багатьма катіонами, комплексони широко використовуються як лікарські засоби для розчинення каменів нирок, жовчного міхура. Вони застосовуються як стабілізатори при зберіганні крові, так як зв’язують іони металів, що каталізують реакції окиснення; для виведення з організму іонів токсичних металів, радіоактивних ізотопів і продуктів їх розпаду. Знання особливостей будови комплексних сполук необхідні для вивчення біохімії, фармакології, гігієни, дисциплін медичного профілю.






2.Результати навчання:
- фахові (предметні) компетентності (знати, вміти, практичні навички)
- здатність до клінічного мислення
- здатність до критичного мислення
- дослідницькі вміння
Після вивчення теми студенти повинні знати і володіти:
Знати
- Характер зв’язків та будову комплексних сполук;
- Класифікацію комплексних сполук;
- Роль комплексних сполук у процесах життєдіяльності;
- Суть металолігандного гомеостазу;
- Комплексони та їх застосування в медицині;
- Величини, що характеризують кількісний склад розчинів;
- Формули для визначення масової частки, молярної концентрації, молярної концентрації еквівалента, титру та моляльної концентрації;
- Формули для визначення кількості речовини, кількості речовини еквівалента, молярної маси еквівалента, фактора еквівалентності;
- Види мірного посуду.
Оволодіти
- методикою виконування хімічних дослідів ;
- навиками розрахунку: за масовою часткою, малярною часткою,молярною концентрацією еквівалента.
Вміти
- складати формули та рівняння реакцій комплексоутворення;
- виконувати реакції, в результаті яких одержують комплексні сполуки;
- складати рівняння окисно-відновних реакцій ;
- проводити окисно-відновні реакції;
- дотримуватися правил техніки безпеки, охорони праці під час проведення окисно-відновних реакцій та добування комплексних сполук.
- проводити розрахунки по визначенню маси (об’єму) розчиненої речовини, необхідної для приготування розчинів певної концентрації;
- переводити одну форму вираження концентрації в іншу.
- загальні компетентності:
- здатність застосовувати отриманні знання з даної теми в майбутній медичній практиці;
- здатність працювати автономно;
- здатність бути спостережливим;
- здатність до творчості;
- здатність до пошуку, оброблення та аналізу інформації з різних джерел;
- здатність бути критичним та самокритичним;
- навички міжособистісної взаємодії;
- уміння працювати індивідуально та в команді;
- оцінювати результати своєї діяльності та діяльності інших
- здатність проявляти ініціативність, самостійність, відповідальність, лідерські якості.
3.Методи і прийоми навчання:
- Словесні: бесіда; індивідуальне та фронтальне опитування, презентація студентами результатів дослідів.
- Наочні: робота з роздатковим матеріалом; робота з підручником, таблицями та німими графами; демонстрація відеофільмів та презентацій з теми.
- Практичні: вивчення методики виконання хімічних дослідів;
навиками розрахунку: за масовою часткою, малярною часткою,молярною концентрацією еквівалента;
проведення дослідів, вирішення типових і нетипових клінічних навчальних задач.
- Інтерактивні: робота в малих групах; робота в парах, метод кооперативних груп, метод конкурентних груп, мозковий штурм.
4.Методи контролю:
Фронтальне опитування, індивідуальне опитування з демонстрацією топографії та анатомічних структур і їх аналізом; тестовий контроль, вирішення навчальних задач.
5.Міждисциплінарна інтеграція
|
Дисципліни |
Знати |
Вміти |
|
1. Наступні дисципліни Фармакологія та медична рецептура. Внутрішня медицина. Дерматологія та венерологія
Онкологія . |
Лікування ревматоїдних артритів. Хризалон, Кризалон, Санакризин. Комплекси Ауруму з органічними лігандами Фероцерон (сендвічеві комплекси Феруму). Сполуки платини Ферумдефіцитні анемії Комплексони цинку. Протипухлинна активність (інгібують синтез молекул ДНК).
|
Аналізувати що інгібують гідролітичні ферменти, що ушкоджують суглоби. Диференціювати сполуки залежно від їх дії чи активності стосовно медичного застосування
|
6.Література
Навчальна
Основна:
- Музиченко В.П., Луцевич Д.Д.,Яворська Л.П. Медична хімія – Київ ВСВ «Медицина, 2015р с.78-106
- Порецький А.В., Баннікова-Безродна О.В., Філіппова Л.В. Медична хімія Київ ВСВ «Медицина, 2012р с. 29-41
- Галяс В.Л., Колотницький А.Г. Фізична і колоїдна хімія / В.Л. Галяс, А.Г. Колотницький. — Львів, 2003. — 453 с.
- Гомонай В.І. Фізична та колоїдна хімія. — Вінниця: Нова книга, 2007
- Губський Ю.І. Біоорганічна хімія. — Вінниця: Нова Книга, 2005. — 464 с.
- Луцевич Д.Д. Аналітична хімія / Д.Д. Луцевич, А.С. Мороз, О.В. Грибальська, В.В. Огурцов: 2-ге вид., перероб. і доп. — К.: Медицина, 2009. — 416 с.
- Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. / А.С. Мороз, Д.Д. Луцевич, Л.П. Яворська. — Вінниця: Нова Книга, 2006. — 776 с.
- Мороз А.С., Луцевич Д.Д., Яворська Л.П. Біофізична та колоїдна хімія / А.С. Мороз, Д.Д. Луцевич, Л.П. Яворська. — Вінниця: Нова Книга, 2007. — 725 с.
- Миронович Л.Л. Біоорганічна хімія. — К.: Каравела, 2008.
- Миронович Л.Л., Мордашко О.О. Медична хімія. — К.: Каравела, 2008.
- Музиченко В.П., Луцевич Д.Д., Яворська Л.П. Медична хімія / За ред. Б.С. Зіменковського. — К.: Медицина, 2010. — 496 с.
Додаткова:
- Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006,
- Стрельцов О.А., Мельничук Д.О., Снітинський В.В. Фізична і колоїдна хімія / О.А. Стрельцов, Д.О. Мельничук, В.В. Снітинський. — Львів: Ліга-Прес, 2003. — 443 с.
- Степаненко О.М. та ін. Загальна та неорганічна хімія: Ч. 1 / О.М. Степаненко, Л.Г. Рейтер, В.М. Ледовських. — К.: Педагогічна преса, 2001. — 518 с.
- Степаненко О.М. та ін. Загальна та неорганічна хімія: Ч. 2 / О.М. Степаненко, Л.Г. Рейтер, В.М. Ледовських. — К.: Педагогічна преса, 2001. — 733 с.
- Лебідь В.І. Фізична хімія: підруч. для студ. вищ. навч. закл. / В.І. Лебідь. — Х.: Фоліо, 2005. — 478 с.
- Мчедлов-Петросян М.О. та ін. Колоїдна хімія: підруч. для студ. вищ. навч. закл. / М.О. Мчедлов-Петросян, В.І. Лебідь, О.М. Глазкова, С.В. Єльцов, О.М. Дубина, В.Г. Панченко. — Х.: Фоліо, 2005. — 302 с.
- Лєвітін Є.Я. Загальна та неорганічна хімія / Є.Я. Лєвітіню. — Вінниця: Нова книга, 2003. — 480 с.
Методична
Основна
- Філоненко М.М. Методика викладання у вищій медичній школі на засадах компетентісного підходу: Методичні рекомендації для викладачів та здобувачів наукового ступеню доктора філософії ВМНЗ України. – К., 2016.-88с.
- С.Д.Максименко, М.М.Філоненко «Педагогіка вищої медичної освіти», підручник:-К: «Центр учбової літератури», 2014р.
Планування роботи на занятті
«Комплексні сполуки. Вчення про розчини»
|
Етап заняття |
Зміст заняття |
|
Підготовчий етап: (25 хв) 1. Організація навчання.
2. Мотивація навчальної діяльності.
3. Оголошення теми та мети заняття.
4. Контроль вхідного рівня знань
|
Бесіда викладача з черговим студентом; заповнення журналу.
Розповідь викладача. Актуалізація теми.
Розповідь викладача. Інструкція
Фронтальне опитування студентів. Усне опитування. Робота з німими графами. |
|
Основний етап. Формування професійних навичок та вмінь (110 хв)
|
Індивідуальні завдання. Проведення дослідів. Умови проведення дослідів. Хід досліду. Тести. Вирішення навчальних задач.
|
|
Заключний етап: (25 хв)
1. Контроль та корекція рівня професійних вмінь і навичок.
2. Підбиття підсумків заняття. Рефлексія діяльності. Виставлення оцінок.
3. Домашнє завдання.
|
Рішення ситуаційних задач.
Тестові питання.
Гра-лото.
Гра Скласти з фрагментів ізомерів (розрізаних)транс-ізомери та цис-ізомери Просторова (геометрична ізомерія)
Рефлексія діяльності на занятті (співставлення завдань заняття із власною діяльністю на занятті) у формі бесіди.
«
|
7. Підготовчий етап: (25 хвилин)
Мотивація навчальної діяльності.
Перевірка вхідного рівня знань.
Матеріали методичного забезпечення підготовчого етапу заняття.
7.1. Мотивація навчальної діяльності.
Вивчення хімії неможливе без засвоєння таких початкових понять, як величини, що характеризують кількісний склад розчинів, сумішей та систем.
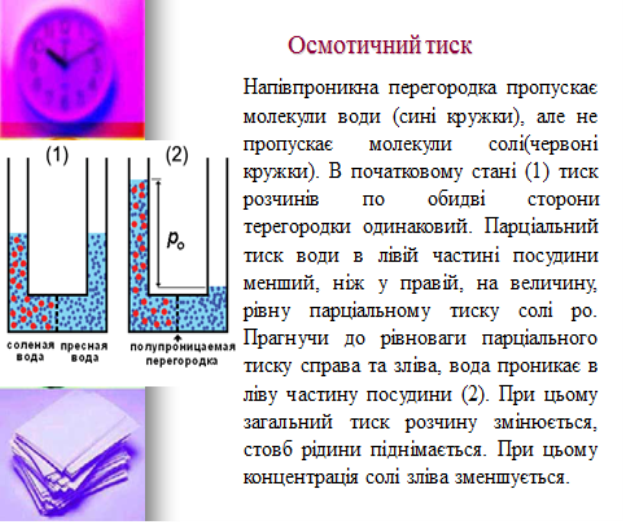
Колігативні властивості розчинів (дифузія, осмос та ін.) обумовлюють найважливіші аспекти життєдіяльності організму. Осмотичний тиск обумовлює розподіл води і поживних речовин між різними органами і тканинами організму. Механізм осмосу залежить від природи мембран. За рахунок вибіркової проникності мембран відбувається перенесення поживних речовин і виведення продуктів метаболізму. Вивчення осмотичних явищ показало, що в середині клітини осмотичний тиск більший, ніж у позаклітинній рідині. Методи осмометрії, кріометріі та ебуліометріі використовуються для дослідження біологічних рідин, визначення їх осмоляльності, середньої молекулярної маси білка та молекулярних мас інших фізіологічно активних сполук.
7.2. Оголошення теми та мети заняття.
Тема сьогоднішьго заняття: «Комплексні сполуки. Вчення про розчини».
Мета нашого заняття:
Знати
- Характер зв’язків та будову комплексних сполук;
- Класифікацію комплексних сполук;
- Роль комплексних сполук у процесах життєдіяльності;
- Суть металолігандного гомеостазу;
- Комплексони та їх застосування в медицині;
- Величини, що характеризують кількісний склад розчинів;
- Формули для визначення масової частки, молярної концентрації, молярної концентрації еквівалента, титру та моляльної концентрації;
- Формули для визначення кількості речовини, кількості речовини еквівалента, молярної маси еквівалента, фактора еквівалентності;
- Види мірного посуду.
Оволодіти
- методикою виконування хімічних дослідів ;
- навиками розрахунку: за масовою часткою, малярною часткою,молярною концентрацією еквівалента.
Вміти
- складати формули та рівняння реакцій комплексоутворення;
- виконувати реакції, в результаті яких одержують комплексні сполуки;
- складати рівняння окисно-відновних реакцій ;
- проводити окисно-відновні реакції;
- дотримуватися правил техніки безпеки, охорони праці під час проведення окисно-відновних реакцій та добування комплексних сполук.
- проводити розрахунки по визначенню маси (об’єму) розчиненої речовини, необхідної для приготування розчинів певної концентрації;
- переводити одну форму вираження концентрації в іншу.
7.3. Контроль вхідного рівня знань
ГРАФОЛОГІЧНА СТРУКТУРА
Комплексні сполуки
![]()
![]()
![]()
|
Будова, класифікація, типи зв’язків, дисоціація комплексних сполук. |
Комплексони та їх застосування в медицині. |
Біологічно активні комплексні сполуки. |
![]()
![]()
|
Реакції комплексоутворення |
Металолігандний гомеостаз
|
ГРАФОЛОГІЧНА СТРУКТУРА
Розчини
|
Класифікація розчинів. |
Склад розчинів. |
![]()
![]()
|
Розчини у життєдіяльності організму. |
Величини, що характеризують кількісний склад розчинів. |
![]()
|
Розрахунки по визначенню кількості розчиненої речовини для приготування розчинів певної концентрації |
![]()
|
Зважування наважки на терезах. |
ГРАФОЛОГІЧНА СТРУКТУРА
|
Колігативні властивості розчинів (неелектролітів та електролітів) |
Значення колігативних властивостей розчинів для життєдіяльності організму. |
![]()
![]()
![]()
|
Дифузія (Закон Фіка) |
Осмос (Закон Вант-Гоффа) |
Зниження тиску насиченої пари розчинника над розчином (Закон Рауля) |
![]()
![]()
|
Осмометрія; ізотонічні, гіпертонічні, гіпотонічні розчини, плазмоліз, гемоліз. |
Кріоскопія, ебуліоскопія |
![]()
![]()
|
Спостереження явища осмосу в осмометрі, та явищ гемолізу і плазмолізу.
|
Визначення осмолярності біологічних рідин |
Німі графи
ГРАФОЛОГІЧНА СТРУКТУРА
Комплексні сполуки
![]()
![]()
![]()
|
Будова, класифікація, типи зв’язків, дисоціація комплексних сполук. |
Комплексони та їх застосування в медицині. |
Біологічно активні комплексні сполуки. |
![]()
![]()
|
|
|
ГРАФОЛОГІЧНА СТРУКТУРА
Розчини
|
Класифікація розчинів. |
Склад розчинів. |
![]()
![]()
|
|
|
![]()
|
|
![]()
|
. |
ГРАФОЛОГІЧНА СТРУКТУРА
|
Колігативні властивості розчинів (неелектролітів та електролітів) |
Значення колігативних властивостей розчинів для життєдіяльності організму. |
![]()
![]()
![]()
|
Дифузія (Закон Фіка) |
Осмос (Закон Вант-Гоффа) |
Зниження тиску насиченої пари розчинника над розчином (Закон Рауля) |
![]()
![]()
|
|
|
![]()
![]()
|
|
|
Питання для фронтального опитування
- Сучасні уявлення про будову комплексних сполук.
- Наведіть приклад складу комплексних сполук.
- Які характерні реакції комплексоутворення.
- В чому суть координаційної теорі А. Вернера.
- Чим зумовлений хімічний зв’язок у комплексних сполуках.
- Назвіть приклади просторової будови комплексних сполук.
- Які існують види ізомерії комплексних сполук.
- Біологічно важливі типи координаційних сполук.
- Що таке металолігандний гомеостаз.
- Застосування комплексних сполук у медицині.
- Значення води і водних розчинів у біології та медицині.
- Загальні відомості про розчини, їх склад і типи.
- Теорії розчинів.
- Теплові явища при розчиненні.
- Розчинність газів у рідинах.
- Залежність розчинності газів від тиску (закон Генрі—Дальтона), природи газу та розчинника, температури.
- Вплив електролітів на розчинність газів (закон Сєченова).
- Розчинність газів у крові.
- Кесонна хвороба.
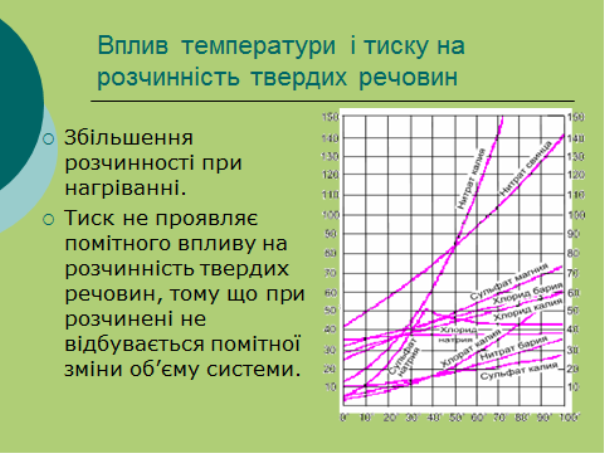
- Розчинність рідин і твердих речовин у рідинах.
- Залежність розчинності від температури, природи розчинюваної речовини та розчинника.
- Розподіл речовини між двома рідинами, що не змішуються.
- Закон розподілу Нернста та його значення в явищі проникності біологічних мембран.
- Способи вираження кількісного складу розчинів.
- Колігативні властивості розчинів.
- Дифузія та осмос.
- Осмотичний тиск розчинів.
- Біологічне значення осмосу, осмотичного тиску.
8. Основний етап: (110 хвилин)
Матеріали методичного забезпечення основного етапу заняття
Дати правильні відповіді на запитання
Запитання
1) Що обумовлює величину осмотичного тиску плазми крові?
2) У чому суть поняття "ізотонічний коефіцієнт Вант-Гоффа"?
3) У чому полягає відмінність дії морської води від річкової на очі людини, яка пірнає?
4) В якому випадку перший розчин є гіпертонічним по відношенню до другого?
а) розчин сахарози (5 моль/л) і розчин сечовини (5 моль/л);
б) розчин глюкози (1 моль/л) і розчин сахарози (0,1 моль/л);
в) розчин сахарози (0,1 моль/л) і розчин нітрату калію (0,08 моль/л);
г) розчин нітрату калію (0,1 моль/л) і розчин хлориду кальцію
(0,8 моль/л).
5) Над яким розчином тиск насиченї водяної пари буде максимальним, що призведе до мінімальної температури кипіння цього розчину?
а) розчин хлориду кальцію (0,4 моль/л);
б) розчин хлориду калію (1,0 моль/л);
в) розчин сечовини (0,4 моль/л);
г) розчин сахарози (1,0 моль/л).
6) При розчиненні 13 г камфори в 400 г диетилового ефіру температура кипіння підвищилась на 0,453°. Визначити молярну масу камфори.
Правильні відповіді
1) Величина осмотичного тиску плазми крові обумовлена вмістом електролітів, концентрацією низькомолекулярних неелектролітів і біополімерів. Вирішальну роль відіграють катіони та аніони електролітів. Осмотичний тиск крові людини при 37°С досягає величини 0,74-0,78 МПа. Внесок колоїдних частинок та біополімерів (онкотичний тиск) значно менший - до 0,004 МПа (до 5%). Постійність осмотичного тиску в крові людини регулюється шляхом виділення парів води при диханні, роботою нирок, виділенням поту та ін.
2) Ізотонічний коефіцієнт Вант-Гоффа дозволяє врахувати вплив на колігативні властивості розчинів збільшення кількості частинок у розчинах електролітів, що відбувається внаслідок їх дисоціації. При повній дисоціації (ступінь дисоціації α = 1,0) з одного моль електроліту утворюється n моль іонів, що поводяться як самостійні частинки в розчині (для розведених розчинів). Ізотонічний коефіцієнт визначається за формулою: i = 1+α(n-1)
3) Загальна концентрація розчинених речовин (перш за все солей)
в очній тканині є вищою, ніж їх концентрація в прісній воді і нижчою, ніж у морській воді. При контакті з прісною водою очна тканина внаслідок осмосу "розбухає" (відчуття різі в очах), а при контакті з морською водою дещо "всихає" (почервоніння очного яблука).
4) У випадку б). Одномолярний розчин глюкози є гіпертонічним до децимолярного розчину сахарози, тому що він містить більшу кількість молекул і його осмотичний тиск буде більшим. У випадках в) і г) треба врахувати певну дисоціацію розчинених солей, які є сильними електролітами. У цих випадках певні розчини будуть гіпотонічними по відношенню до других.
5) Над розчином в). Над розчином з концентрацією 0,4 моль/л сечовини тиск насиченої водяної пари буде максимальним, тому що кількість розчинених частинок у ньому буде мінімальною.
6) Згідно з наслідком із закону Рауля: Δtк= E × Cm,
підвищення температури кипіння розчину (Δtк) пропорційне моляльній (Сm) концентрації розчиненої речовини. Змінимо рівняння відносно моляльної концентрації і перетворимо його у форму, необхідну для розрахунку молярної маси розчиненої речовини: 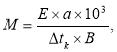
де: М - молярна маса камфори, г/моль;
Е - ебуліоскопічна константа розчинника, кг×град/моль;
а - маса розчиненої речовини, кг;
В - маса розчинника, кг.
Для діетилового ефіру: Е = 2,12 кг×град/моль
Проводимо розрахунки;
Δtк = 0,4530 a = 13×10-3 кг В = 0,4 кг
![]()
8.1. Вказівки до роботи студентів на занятті.
1. Одержання аміакату міді.
До розчину солі Cu2+ додати краплями розчин NH4OH. Одержаний осад гідроксиду міді розчинити у надлишку реактиву NH4OH. при цьому утворюється сполука, яка містить комплексний іон [Cu(NH3)4]2+.
Написати рівняння цієї реакції.та назвати одержану комплексну сполуку.
Випробувати дію сильних кислот на розчин, що містить катіон тетрааміакату міді (ІІ). Написати рівняння реакцій руйнування комплексу у кислому середовищі
2. Одержання гідроксисолі олова.
До розчину солі олова Sn2+ додати розчин лугу. Утворений осад гідроксиду олова розчинити в надлишку реактиву. Утворюється комплексна сполука, яка містить комплексний іон [Sn(OH)4]2-.
Написати рівняння реакції утворення комплексної сполуки та назвати її.
3. Одержання комплексної сполуки реакцією обміну.
До розчину FeCl3 додати декілька крапель розчину калій гексаціаноферрату (ІІ) (жовтої кров’яної солі) К4[Fe(CN)6]
Утворюється осад синього кольору – "берлінська лазурь" Fe4[Fe(CN)6]3.
Написати рівняння реакції утворення комплексної сполуки та назвати її.
Перевірити розчинність осаду у сильних кислотах і лугах.
Написати рівняння реакції розчинення осаду.
4. Визначення впливу розчинника на стійкість комплексної сполуки.
До 1 мл розчину солі кобальта додати стільки ж розчину роданіду амонію NH4SCN.
Утворюється комплексна сполука (NH4)2[Co(SCN)4] яскраво-червоного кольору.
Написати рівняння цієї реакції.та назвати одержану комплексну сполуку.
Розчин розділити на дві частини. до першої додати аміловий спирт, до другої – воду. Порівняти забарвлення одержаних розчинів та стійкість комплексів у аміловому спирті та у воді.
8.2 Вирішиння задач
Задача № 1.
Вміст катіонів натрію в плазмі крові складає 142 ммоль/л.
Визначити титр плазми по катіону натрію.
Задача № 2.
Водний розчин, одержаний розчиненням 0,005 кг глюкози (Мr = 180) у 0,095 кг води, є ізотонічним по відношенню до плазми крові. Визначити масову та молярну частки глюкози в розчині.
Задача № 3.
Титр розчину хлориду кальцію (Мr = 111), що використовується в медичній практиці при алергічних, шкіряних та інших захворюваннях дорівнює 0,0999 г/мл. Розрахувати молярну концентрацію та молярну концентрацію еквівалента хлориду кальцію в розчині та співвідношення між ними.
Задача № 4.
Визначити моляльність фізіологічного розчину, масова частка хлориду натрію в якому дорівнює 0,85%.
Задача № 5.
У лабораторії є розчин з масовою часткою хлориду натрію 10% та 0,5%. Визначити масу кожного з розчинів, що необхідна для приготування 0,5 л фізіологічного розчину з масовою часткою 0,85% та густиною 1,003 кг/л.
Правильні відповіді
Задача № 1.
Титр (Т) означає масу розчиненої речовини, що міститься в 1 мл розчину. Масу частіше виражають у грамах (г).
Отже, маємо:
![]()
![]()
![]() , де :
, де :
m(Na+) - маса катіонів натрію, г ;
V (розчину) - об'єм розчину, мл;
n(Na+) - кількість речовини катіонів натрію, моль;
М (Na+) - молярна маса катіону натрію, г/моль;
Т (Na+)![]()
![]() г/мл
г/мл
Задача № 2.
Масова частка ( W ) - це відношення маси компоненту (розчиненої речовини) до загальної маси системи (розчину, суміші). Це безрозмірна величина, що виражається частками одиниці, відсотками (частки сотні), проміле (частки тисячі), млн-1 (частки мільйону).
![]()
Молярна частка ( χ ) - це відношення кількості речовини компонента (розчиненої речовини) до загальної кількості речовини системи (розчину, суміші). Вона має таку ж розмірність, як і масова частка.

Задача № 3.
Молярна концентрація речовини X, що позначається С(Х), - це відношення кількості речовини Х до об’єму розчину V. Молярна концентрація виражається в моль/м3, моль/л, або в їх похідних (ммоль/л).
![]() де:
де:
n – кількість речовини СаСl2, моль;
V(розчину) – об’єм розчину, л.
Якщо Т(СаСl2) = 0,0999 г/мл = 0,0999 кг/л, то в 1 л розчину маємо 0,0999 кг солі.
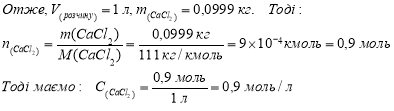
Молярна концентрація еквівалента речовини X, що позначається як С(fX), - це відношення кількості речовини еквівалента n(fX) дo об’єму розчину.
Молярна концентрація еквівалента виражається в моль/м3, моль/л, або в їх похідних (ммоль/л)

Еквівалент - це така частина речовини Х (реальна або умовна), що в реакції еквівалентна (відовідає)одному моль атомів водню (Гідрогену), або одному моль катіонів водню (Гідрогену), або в окисно-відновних реакціях - одному електрону. Фактор еквівалентності f показує, яка частка моль речовини відповідає її еквіваленту. Отже, для речовини Х фактор еквівалентності f(X) показує співвідношення між молярною масою еквівалента M(fХ) та молярною масою М(Х) речовини:
![]()
Наприклад для сірчаної кислоти Н2SO4:
![]()
Отже, для СaCl2:
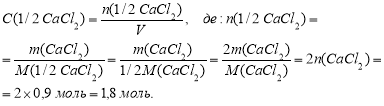
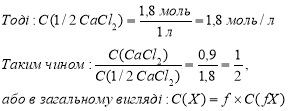
Задача № 4.
Моляльна концентрація речовини X, що позначається Сm(X) є відношенням кількості речовини Х до маси розчинника У.
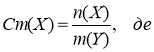 : n(Х) - кількість речовини X, моль;
: n(Х) - кількість речовини X, моль;
m(У) - маса розчинника, кг.
Якщо масова частка хлориду натрію в розчині дорівнює 0,85%, то це означає, що 0,85 г солі припадає на 99,15 г води. Отже,
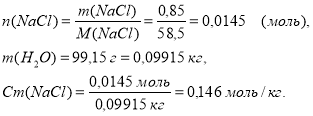
Задача № 5.
По-перше, зробимо необхідні позначення: W1(NaCl) = 10%
W2(NaCl) = 0,5%
Wx(NaCl) = 0,85%
Vx(розчину) = 0,5л
ρx(розчину) = 1,003 кг/л
Знайдемо масу розчину, який треба приготувати:
mx(розчину) = Vx(розчину) ×ρx(розчину) = 0,5×1,003 = 0,5015 кг
2) Проведемо розрахунки за правилом змішування ("хреста"). У загальному вигляді:
![]()
![]()
![]() W1(NaCl)
W1(NaCl) ![]()
![]()
![]() Wx(NaCl)
Wx(NaCl)
![]() W2(NaCl)
W2(NaCl) 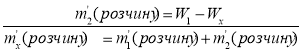
Або:
![]()
![]()
![]() 10% 0,35 кг
10% 0,35 кг
![]()
![]() 0,85%
0,85%
![]()
![]() 0,5% 9,15 кг
0,5% 9,15 кг
![]() (розчину) = 9,5 кг
(розчину) = 9,5 кг
Знаходимо необхідні маси розчинів:
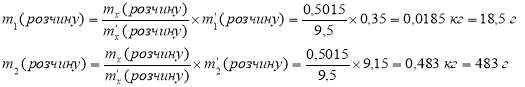 Висновок: треба змішати 18,5 г розчину з W1=10% та 483 г розчину з W2= 0,5%.
Висновок: треба змішати 18,5 г розчину з W1=10% та 483 г розчину з W2= 0,5%.







Вказівки до роботи студентів на занятті.
1. Проведення якісної реакції на катіон срібла (І). Реакція з розчином хлориду або соляною кислотою.
У пробірку внести 1 мл розчину солі срібла і додати такий же об’єм соляної кислоти або солі соляної кислоти. Спостерігається утворення білого осаду хлориду срібла.
AgNO3 + NaCl = AgCl + NaNO3
Ag+ + Cl- = AgCl
Перевірити розчинність осаду у сильних мінеральних кислотах та розчині аміаку.
Написати рівняння реакції розчинення осаду в розчині аміаку. Зробити висновок про умови відкриття іона срібла (І) у вигляді хлориду срібла.
2. Проведення якісної реакції на катіон міді (ІІ). Реакція з жовтою кров’яною сіллю (калій гексаціаноферратом (ІІ).
У пробірку внести 1 мл розчину солі міді (ІІ) і таку ж кількість розчину калій гексаціаноферрату (ІІ) (жовтої кров’яної солі - К4 [Fe(CN)6]). Спосетрігається утворення червоно-бурого осаду купрум гексаціаноферрату (ІІ):
2CuSO4 + К4 [Fe(CN)6]) = Cu2[Fe(CN)6] + K2SO4
2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]
Перевірити розчинність осаду у сильних мінеральних кислотах та лугах. Написати рівняння реакцій розчинення осаду в кислотах і лугах. Зробити висновок про умови відкриття катіону міді (І) у вигляді купрум (ІІ) гексаціаноферрату.
3. Проведення якісної реакції на катіон цинку (ІІ). Реакція з розчином лугу.
У пробирку внести 1 мл розчину солі цинку, краплями додати розчин лугу до утворення осаду.
ZnSO4 +2NaOH = Zn(ОН)2 ↓ + Na2SO4
Zn2+ + 2OH-= Zn(OH)2 ↓
Вміст пробірки поділити на дві частини. До однієї частини додати соляну кислоту, до другої - надлишок розчину лугу.
Написати рівняння реакцій розчинення осаду в кислотах та в лугах;
зробити висновок про умови відкриття іона Zn2+ в вигляді гідроксиду.
4. Проведення якісної реакції на катіон заліза (ІІІ). Реакція з розчином роданіду амонію NH4CNS.
До 1 мл розчину солі заліза (ІІІ) додати такий же об’єм розчину роданіду амонію або калію. Утворюється розчин криваво-червоного кольору.
Fe2(SO4)3 + 6NH4CNS = 2Fe(CNS)3 + 3(NH4)2SO4
Fе3+ +3CNS– =Fe(CNS)3
Перевірити дію на роданід заліза (ІІІ) сильної кислоти та лугу. Написати рівняння реакції руйнування роданідів у лужному середовищі. Зробити висновок про умови відкриття катіона заліза (ІІІ) роданід-іоном.
5. Проведення якісної реакції на перманганат-іон. Реакція з перекисом водню у кислому середовищі.
У пробірку внести 1 мл розчину перманганату калію, додати 2-3 краплі розчину сірчаної кислоти та 5 крапель розчину перикису водню з масовою часткою Н2О2 10%.
Спостерігається знебарвлення розчину перманганату калію.
Cкласти рівняння реакції за схемою:
КМпО4 + Н2SO4 + H2O2 MnSO4 + O2 + K2SO4 + H2O

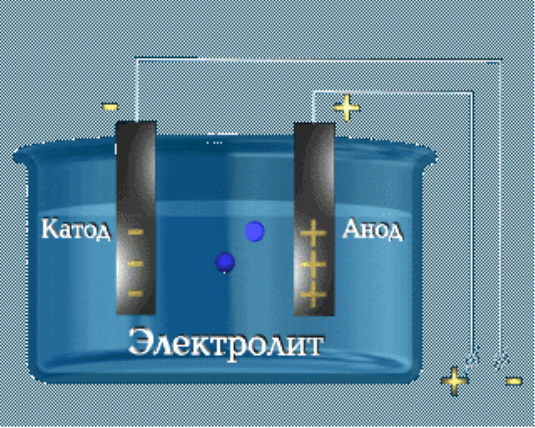
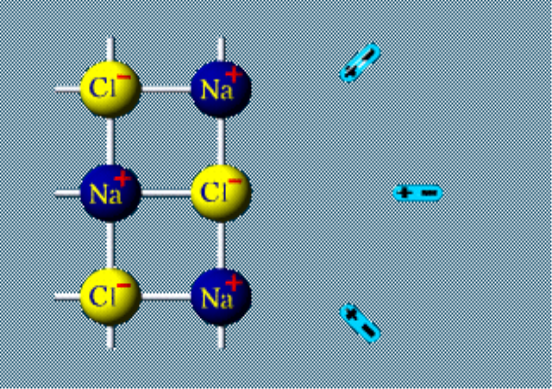
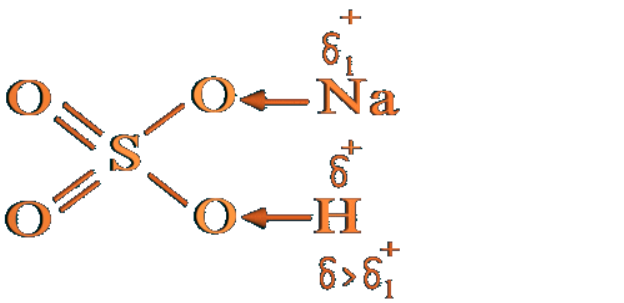
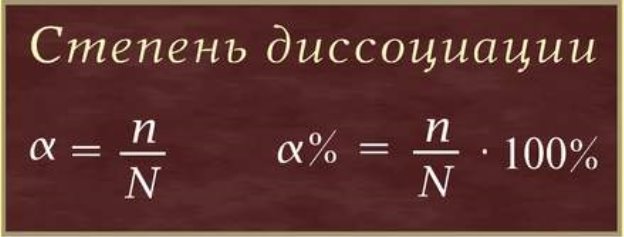

9.Заключний етап (25 хвилин).
9.1. Підведення підсумків заняття.
Матеріали методичного забезпечення заключного етапу заняття.
Г Р А
Скласти з фрагментів ізомерів (розрізаних) транс-ізомери та цис-ізомери
Просторова (геометрична ізомерія)


Просторова будова геометричних ізомерів
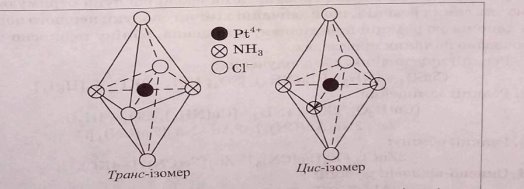
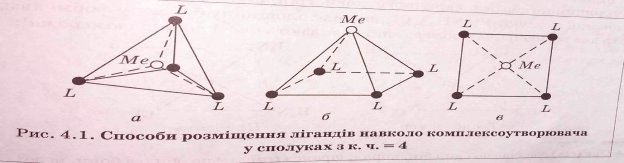
Скласти геометричну конфігурацію комплексних сполук шляхом гібридизації АО центрального атома та природою лігандів.
Просторова будова комплексних сполук у яких координаційне число дорівнює 4.
З фрагментів
![]()
Гра-лото
Класифікація комплексних сполук
Добування комплексних сполук. КС одержують за допомогою тих самих реакцій, що й звичайні хімічні сполуки. Це реакції приєднання, заміщення, обміну та окисно-відновні. Розглянемо їх на конкретних прикладах.
- Реакції приєднання (сполучення):
CuSO4 +4NH3 → [Cu (NH3)4] SO4;
HgI2+2KI→K2[HgI4]
- Реакції заміщення:
[Cu (H2О)4] SO4+4NH3 → [Cu (NH3)4] SO4+ H2О;
Zn+2Na [Au(CN)2] →2Au+ Na2 [Zn(CH)4]
- Реакції обміну:
2 ZnCl2+К4[Fe(CN)6] → Zn2[Fe (CN)6] +4КСl
- Окисно-відновні реакції:
2Аl+6КОН+6 H2О→2 К3[Аl(ОН)6]+3Н2↑;
2 К4[Fe (CN)6]+ Cl→2К3[Fe (CN)6]+2К Cl
Орієнтовна карта для організації самостійної роботи
студентів з навчальною літературою
|
Зміст і послідовність дій |
Вказівки до навчальних дій |
|
1. Будова комплексних сполук |
1.1. Теорія будови комплексних сполук 1.2. Природа хімічних зв’язків у комплексних сполуках 1.3. Дисоціація комплексних сполук. Константа нестійкості комплексного іона. |
|
2. Класифікація комплексних сполук |
2.1. Класифікація за зарядом внутрішньої сфери. 2.2. Класифікація за природою лігандів. 2.3. Внутрішньокомплексні сполуки. 2.4. Поліядерні комплекси. |
|
3. Біологічно активні природні комплекси. |
3.1. Залізо-, кобальто-, міде-, цинковмісні біокомплексні сполуки. 3.2. Металолігандний гомеостаз та його порушення. |
|
4. Комплексони та їх застосування в медицині. |
4.1 Властивості та застосування |
|
5. Реакції комплексоутворення. |
5.1 Утворення аміно-, аква- та гідроксокомплексів. 5.2 Отримання комплексних сполук реакцією обміну. 5.3 Вплив розчинника на стійкість комплексної сполуки. |
ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ
(самостійна позааудиторна робота студентів)
1) Координаційне число – це:
а) число зв’язків, за допомогою яких ліганди безпосередньо сполучені з комплексоутво-рювачем;
б) число місць, які ліганди займають у внутрішній координаційній сфері комплексу;
в) число реальних або умовних частинок, які вміщує 1 моль речовини;
г) сумарне число нуклонів у ядрі.
2) Вказати комплексоутворювач, його ступінь окиснення, координаційне число та заряд комплексного іона у сполуці K[Cr(H2O)2 (CN)4]
![]() а) К, +I, 4, -I б) Сr, +3, 6, -І в) Н2О, 0, 6, -I г) Сr, +2, 4, 0
а) К, +I, 4, -I б) Сr, +3, 6, -І в) Н2О, 0, 6, -I г) Сr, +2, 4, 0
3) Який вид хімічного зв’язку утворюється між комплексоутворювачем і лігандами у більшості комплексних іонів?
а) іонний; б) ковалентний; в) водневий; г) металічний.
4) Константи нестійкості (КH) ціанідних комплексів деяких металів мають такі значення:
KH[Ag(CN)2]- = 1∙10-21 KH[Cd(CN)4]2- =7,7∙10-18
KH[Fe(CN)6]4- = 1∙10-24 KH[Hg(CN)4]2- = 3∙10-42
Визначити, катіон якого металу утворює найстійкіший ціанідний комплекс.
а) Ag+; б) Cd2+; в) Нg2+; г) Fe2+.
5) Вказати, які з іонів Fe2+, Fe3+, Cl-, HCO3-, K+, Ca2+, Na+, Cu2+, Zn2+ є комплексоутворювачами у ферментах.
а) K+, Na+, Cl-; б) K+, Ca2+, Na+; в) Fe2+, Fe3+, Ca2+, Cu2+, Zn2+; г) Cl-, HCO3-.
6) Яка функція не характерна для гемоглобіну?
а) зв’язування молекул кисню іонами феруму (ІІ) та перенесення його з легень до м’язів;
б) передача кисню до молекули міоглобіну в м’язах ;
в) зв’язування молекул вуглекислого газу та перенесення його до легень;
г) перенесення електронів.
Правильні відповіді
1) Правильна відповідь а).
2) Правильна відповідь б).
Комплексоутворювачем є хром (ІІІ), координаційне число (кількість лігандів Н2О і СN-) дорівнює 6, заряд комплексного іона буде -1:
4 ∙ (-1) + (+3) + 2 ∙ (0) = -1
3) Правильна відповідь б).
Переважний вид хімічного зв’язку між комплексоутворювачем і лігандами - це ковалентний зв’язок, утворений за донорно-акцепторним механізмом. Найчастіше ліганди - це донори електронних пар, а комплексоутворювач - акцептор.
4) Правильна відповідь в).
Константа нестійкості комплексного іона - це константа його дисоціації, отже, чим більше значення константи, тим краще дисоціює комплексний іон, тим менша його стійкість. Цианід Меркурію (Нg2+) має найменше значення константи, тому він є найстійкішим.
5) Правильна відповідь в).
Комплексоутворювачами у складі ферментів та інших білків найчастіше виступають іони d-елементів. Крім цього, кальцій і натрій в організмі частіше зустрічаються у вигляді вільних іонів, ніж у вигляді сполук з білками.
6) Правильна відповідь г).
На відміну від міоглобіну, функцією якого є тільки перенесення кисню, гемоглобін має декілька функцій. Крім транспорту кисню, гемоглобін переносить від 3 до 10 % вуглекислого газу від тканин у вигляді карбамінової форми, де вуглекислий газ вступає в реакцію з N-кінцем поліпептидного ланцюга глобіну. Віддача кисню гемоглобіном стимулюється підвищеною концентрацією іонів водню, що вступають в реакцію з гемоглобіном. Таким чином, гемоглобін переносить H+ з тканин до легень. При приєднанні кисню у нормі не відбувається окислення Fe2+ до Fe3+ (гемоглобін, у якому залізо знаходиться у окисленій формі, втрачає здатність переносити кисень). Тому, на відміну від цитохромів, гемоглобін не переносить електрони.




9.2. Домашнє завдання.
- Водневий показник (рН) як кількісна міра активної кислотності та основності.
- Гідроліз солей. Ступінь гідролізу, залежність його від концентрації та температури. Константа гідролізу. Зміщення рівноваги гідролізу.
- Значення гідролізу в життєдіяльності організму
- Буферні системи та їх класифікація, рН буферних розчинів. Механізм дії буферних систем. Буферні системи крові. Приготування буферних розчинів та обчислення їніх значень рН.
- Визначення впливу різних факторів на швидкість розкладання гідрогенпероксиду волюмометричним методом.


про публікацію авторської розробки
Додати розробку
