Методичні основи формування в учнів 11-х класів відповідального ставлення до навчання при вивченні хімії
Методичні основи формування в учнів 11-х класів відповідального ставлення до навчання при вивченні хімії
В основу розробки методичних підходів до формування в учнів 10-х класів відповідального ставлення до навчання при вивченні хімії був покладений аналіз труднощів у формуванні відповідального ставлення до навчання на уроках хімії й виявлені та обґрунтовані педагогічні умови.
На основі передового педагогічного досвіду, держаних вимог до рівня стандарту була створена та апробована програма з формування в учнів відповідального ставлення до навчання на уроках хімії у 11-му класі на прикладі частини теми «Неметалічні елементи та їх сполуки» (6 годин).
Під час своєї роботи ми врахували необхідність:
- формування позитивної мотивації навчальної діяльності учнів завдяки введенню як обов’язкового етапу на уроках хімії, із застосуванням спеціальних засобів – стимулювання, заохочення, підтримка школярів; уведення постійно діючої рубрики «Цікаво знати»;
- широкого використання групових і кооперативних форм навчальної роботи з розподілом обов’язків та повноважень між учнями;
- включення старшокласників до проектної діяльності, введення уроків-проектів, міні-проектів;
- запровадження рейтингової системи навчальних досягнень школярів;
- роботи над підвищенням якості знань учнів з хімії;
- формування позитивного ставлення до навчання, відчуттів боргу й відповідальності перед однокласниками, вчителем і батьками.
Більш детально програму показано у табл.
Таблиця
Програма формування відповідального ставлення учнів до навчання на уроках хімії
|
№ п/п |
Тема уроку. Тип уроку |
Засоби формування в учнів відповідального ставлення до навчання |
Компоненти відповідального ставлення до навчання, що формуються |
|
1 |
2 |
3 |
4 |
|
1. |
Загальна характеристика неметалічних елементів. Неметали як прості речовини. |
«Мозкова атака»: учні відповідають на питання з попередньої теми. Мотивація навчальної діяльності: розповідь учителя щодо місця неметалів у повсякденному житті, побуті, промисловості. Рубрика «Цікаво знати». Робота в парах на створення узагальнюючої таблиці з |
Упорядкування системи знань; вміння вирішувати проблеми у співпраці; вміння працювати з джерелами знань; поглиблення інтересу до хімії; уміння |
Продовження табл.
|
1 |
2 |
3 |
4 |
|
|
Урок вивчення нового матеріалу. |
символами хімічних елементів-неметалів. Робота в малих групах на обговорення теми, складання опорного конспекту, формулювання висновків. Гра «Вірю – не вірю». Метод «Мікрофон» на підбиття підсумків уроку й характеристику властивостей Металів і неМеталів. |
гнучко, швидко, критично, самостійно усвідомлювати навчальну проблему; експериментальні уміння. |
|
2. |
Основні фізичні та хімічні властивості неметалів. Застосування неметалів. Урок – лекція. |
Урок проводиться в формі евристичної бесіди. Вчитель, залучаючи учнів до діалогу, розповідає їм про основні фізичні та хімічні властивості неметалічних елементів у природі, повідомляє про поширення сполук неметалічних елементів у природі, розповідає про важливість застосування неметалів та речовин до складу яких вони входять у сферах людського життя (промисловості, побуті, тощо); залучає учнів до аналізу демонстрацій «Ознайомлення зі зразками прости речовин неметалів» у парній роботі. Метод «Мікрофон» на підбиття підсумків уроку. |
Підвищення рівня пізнавальної активності учнів; удосконалення умінь класифікації, встановлення причинно-наслідкових зв’язків; удосконалення умінь аналізувати інформацію, робити висновки та узагальнення.
|
|
3. |
Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії амоніаку і гідроген хлориду. Урок удосконалення умінь і навичок |
Фронтальне опитування, експрес-тестування із взаємоперевіркою. Аналіз демонстраційних дослідів: добування амоніаку й розчинення його у воді («фонтан»), випробовування розчину фенолфталеїном; діалог з учнями на визначення складу та фізичних властивостей амоніаку і гідроген хлориду. Хімічний диктант за темою уроку із фронтальною перевіркою. |
Стимулювання пізнавальних інтересів учнів; розвиток здатності до виділення навчальної проблеми й побудови способів її вирішення; умінь цілеспрямованого спостереження, узагальнення та аналізу. |
|
4. |
Взаємодія амоніаку та гідроген хлориду з водою. Солі амонію. Якісна реакція на |
Прийом «Незакінчені речення» на актуалізацію опорних знань. Самостійна робота з підручником за варіантами, кожен з яких характеризує окремі властивості гідроген хлориду та амоніаку; аналіз демонстраційного досліду «Якісна реакція на хлорид-йон» із |
Удосконалення умінь працювати з джерелами знань; упорядкування системи знань й предметних умінь; удосконалення експериментальних |
Продовження табл.
|
1 |
2 |
3 |
4 |
|
|
йони амонію та хлорид-йони. Урок засвоєння нових знань. |
визначенням основних хімічних властивостей гідроген хлориду. Письмова самостійна робота із взаємоперевіркою. |
умінь і навичок; здатності до узагальнення, самоаналізу, самоконтролю і взаємоконтролю. |
|
5. |
Урок – проект Хімічні реакції, покладені в основу виробництва сульфатної кислоти, закономірності їх перебігу, охорона праці і довкілля Урок узагальнення знань. |
«Мозкова атака», підведення учнів до формулювання проблеми проекту. Проблемне завдання із наступним обговоренням в малих групах: у таблиці вказано умови, які впливають на швидкість хімічних реакцій; треба навести по одному прикладу для кожної умови, скласти рівняння реакцій, обґрунтувати їх проходження. Об’єднання учнів у гетерогенні групи,які виконують різні завдання: перша група наукового прогнозування – обговорює питання наукових основ будь-якого виробництва, друга група технологів – описує технологічний процес виробництва, третя група виробнича – вивчає виробничі процеси, 4 група – охорони праці і довкілля – вивчає умови захисту кожного працівника підприємства, охорони довкілля. Підготовка, презентація і захист міні-проектів. |
Поглиблення інтересу до дослідження неживої природи; підвищення рівня відповідального ставлення до навчання; формування здатності до творчої переробки інформації; удосконалення інтелектуальних умінь. |
|
6. |
Урок огляд знань Неметалічні елементи та їх сполуки Урок контролю та корекції знань.
|
Протягом уроку відбувається змагання в ігровій формі. Учні поділяються на 2 команди, які виконують завдання різних типів: конкурси «Вікторина», «Віртуальний експеримент», «Відкриття», «Лабораторія», «Розрахунковий». Рейтингова оцінка і нагородження переможців. |
Стимулювання пізнавальних інтересів учнів; поглиблення інтересу до дослідження живої природи. удосконалення умінь аналізувати і систематизувати інформацію, встановлювати причинно-наслідкові зв’язки. |
Як бачимо з табл., програма передбачає створення в навчальному процесі визначених нами педагогічних умов. Так, формування позитивної мотивації навчальної діяльності учнів мало на увазі вироблення в старшокласників свідомого позитивного ставлення до виучуваного матеріалу, умінь практично застосовувати набуті знання, вдосконалення методів і прийомів роботи, спрямованих на підвищення інтересу до предмета, стимулювання пізнавальної активності учнів.
Для прикладу наведемо етап мотивації навчальної діяльності учнів з уроку 1 «Загальна характеристика неметалічних елементів. Неметали як прості речовини».
- Розповідь учителя про роль неметалічних елементів у житті і діяльності людини. Людині для життя потрібно не так вже й багато: кисень (повітря), вода, їжа, одяг та житло. Однак людина, освоюючи навколишній світ, отримуючи нові знання про нього, постійно змінює своє життя на краще. Наприклад, створюючи новий одяг, він робить його більш зручним; отримуючи нові ліки, лікується від хвороб; синтезуючи нові барвники та волокна, робить красивими одяг, житло тощо. Для розв’язання цих та багатьох інших задач, необхідні знання про властивості речовин та їх перетворення, способах керування цими перетвореннями.
- Рубрика «Цікаво знати». Гра «Най... най... най...»
- Найбільш тугоплавкий метал – вольфрам (tплавлення = 3420 °С).
- Найнижча температура плавлення – у ртуті (-30 °С).
- Найбільш ковкий метал – золото (з 1 г можна витягнути дріт завдовжки 2,4 км).
- Найкраща електрична провідність у срібла.
- Метали натрій і калій легко ріжуться ножем.
- Найважчий метал – осмій.
- Метод проблемних питань
Учитель. У VIII столітті група вчених вирішила визначити, з якого елемента складається алмаз. Вони зібрали гроші й купили його, помістили в герметичний циліндр, заповнений киснем, і прожарювали протягом доби на великому полум’ї. Потім вивчили склад газу в циліндрі. Як же вони здивувалися, коли з’ясували, що після згоряння алмазу в кисні утворився тільки вуглекислий газ. Отже, алмаз складався з Карбону, як графіт і сажа. Чому ж прості речовини, утворені атомами того самого хімічного елемента, мають такі різні властивості? За якими ознаками відбувається поділ елементів на металічні й неметалічні? Наскільки поширеними в природі є неметалічні елементи? Де застосовуються неметали? Наше завдання – у процесі вивчення нового матеріалу дати відповіді на ці та інші запитання.
Така педагогічна умова, як використання групових форм роботи з розподілом обов’язків і повноважень мала на увазі роботу в парах, у малих групах, уведення різноманітних інтерактивних методів і прийомів групової роботи (прийом «Незакінчене речення», «Мозковий штурм», «Експрес-тестування», «Експертна думка», «Спільний проект», «2 – 4 – всі разом» тощо). Для того, щоб активізувати роботу в групах, ми підготовили приписи для учнів та вчителів.
Як організувати роботу в парах
- Запропонуйте учням завдання, поставте запитання для невеличкої дискусії чи аналізу гіпотетичної ситуації. Після пояснення питання або фактів, наведених у завданні, дайте їм 1-2 хвилини для продумування можливих відповідей або рішень індивідуально.
- Об’єднайте учнів у пари, визначте, хто з них буде висловлюватись першим, і попросіть обговорити свої ідеї один з одним. Краще відразу визначити час на висловлення кожного в парі й спільне обговорення. Це допомагає учням звикнути до чіткої організації роботи в парах. Вони мають досягти згоди (консенсусу) щодо відповіді або рішення.
- По закінченні часу на обговорення, кожна пара представляє результати роботи, обмінюється своїми ідеями та аргументами з усім класом. За потребою, це може бути початком дискусії або іншої пізнавальної діяльності.
Як організувати роботу в малих групах за методом «2- 4 – всі разом»
- Поставте учням запитання для обговорення, дискусії або аналізу гіпотетичної ситуації. Після пояснення питання або фактів, наведених у ситуації, дайте їм 1-2 хвилини для продумування можливих відповідей або рішень індивідуально.
- Об’єднайте учнів у пари і попросіть обговорити свої ідеї один з одним. Визначте час на висловлення кожного в парі і спільне обговорення. Попередьте, що пари обов’язково мають дійти згоди (консенсусу) щодо відповіді або рішення.
- Об’єднайте пари в четвірки і попросіть обговорити попередньо досягненні рішення щодо поставленої проблеми. Як і в парах, прийняття спільного рішення обов’язкове.
- Залежно від кількості учнів у класі можна об’єднати четвірки в більші групи чи перейти до колективного обговорення проблеми.
Наприклад, до уроку 1 «Загальна характеристика неметалічних елементів. Неметали як прості речовини»:
1) Вступне слово вчителя: Ми вже з’ясували, що неметалічні елементи розташовано в головних підгрупах ІІІ-VІІІ груп періодичної системи Д. Менделєєва у правій верхній частині. Визначимо, які особливості будови їх атомів.
2) Організація роботи груп. Кожна група отримує завдання, яке учні виконують разом, дійшовши згоди, і через 2-3 хв. звітують перед класом про його виконання, роблять відповідні записи, характеризують зміну неметалічних властивостей у періоді та групі.
Завдання 1. Охарактеризуйте хімічні елементи за планом:
1. Порядковий номер елемента та його назва.
2. Період, група, підгрупа.
3. Будова атома: а) заряд ядра; б) кількість електронів та шарів енергетичних рівнів, розподіл електронів на них; в) кількість електронів зовнішнього енергетичного рівня та його завершеність.
4. Металічний чи неметалічний елемент.
5. Формула вищого оксиду і валентність елемента в ньому.
6. Характер вищого оксиду та гідроксиду.
7. Порівняння металічних властивостей із властивостями елементів, що стоять поряд у періоді та групі.
Група 1. Бор. Група 2. Карбон. Група 3. Нітроген.
Група 4. Сульфур. Група 5. Хлор. Група 6. Гелій.
Запитання. Яка кількість електронів є на зовнішньому енергетичному рівні в неметалічних елементів? (На зовнішньому енергетичному рівні атомів неметалічних елементів знаходиться від трьох до восьми електронів. Тому їх атоми приймають електрони для завершення зовнішнього енергетичного рівня, утворюючи при цьому. негативно заряджені йони. Неметалічні властивості посилюються в періодах зліва направо, а в групах – знизу вгору)
Робота в групах. Клас поділено на дві групи: перша група – «Метали», друга група – «Неметали».
Учитель. На торги представлено лот «Розташування у Періодичній системі Д. І. Менделєєва». Ціна – 2 бали. Представник групи приносить бали за отриману інформацію і кладе їх у «Банк знань» іншої групи.
Зразкові відповіді групи «Метали». Давньогрецький історик та географ Страбон писав, що в глибині Африки живуть племена, які за зливок заліза дають десять зливків золота. В «Одіссеї» Гомера розповідається про те, що переможцям спортивних змагань вручали шматок заліза та шматок золота – найцінніші на той час коштовності. На частку заліза та його сплави припадає близько 95 % усіх вироблених у світі металів.
Метали мають велике значення для функціонування організму людини.
Калій – уміст у клітині 0,15-0,4 %, один із основних позитивно заряджених йонів у організмі (людини) тварини, забезпечує транспорт речовин через клітинні мембрани; впливає на діяльність серця людини.
Кальцій – уміст у клітині 0,04-2,0 % , входить до складу кісток і черепашок, бере участь у реакції метаболічних процесів, скорочень м’язів, діяльності серця людини.
Натрій – уміст у клітині 0,02-0,03 %, один із головних внутрішньоклітинних позитивно заряджених йонів, забезпечує транспорт речовин через клітинні мембрани.
Магній – уміст у клітині 0,02–0,03 %, активізує діяльність ферментів; структурний компонент хлорофілу.
Ферум – уміст у клітині 0,01-0,015 %, входить до складу багатьох біомолекул, у тому числі гемоглобіну.
Цинк – уміст у клітині 0,0003 % , знайдено в деяких ферментах, гормонах.
Купрум – уміст у клітині 0,0002 % , входить до складу деяких ферментів, які беруть участь у реакціях окиснення, а також дихальних пігментів деяких безхребетних тварин.
Як організувати роботу для реалізації прийому «Незакінчене речення»
Визначивши тему, з якої учні будуть висловлюватись в колі ідей, учитель формулює незакінчене речення і пропонує учням висловлюючись закінчувати його. Кожний наступний учасник обговорення повинен починати свій виступ із запропонованої формули.
Наприклад, для уроку 3 «Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії амоніаку і гідроген хлориду»:
- Амоніак добре розчиняється у …(воді). Розчин виявляє властивості…(основні). Переконатись можна за допомогою…(фенолфталеїну).
- Водний розчин амоніаку має технічну назву …(аміачна вода)
- Побутова назва водного розчину амоніаку …(нашатирний спирт)
- Сполука, формула якої НСІ, може мати назви…(гідроген хлорид, хлоридна або соляна кислота)
- Солі – складні речовини,…
- Солі – це електроліти,…
- Хлоридна кислота – це електроліт,…
- Основи, взаємодіючи з кислотами, утворюють…(сіль і воду)
- Основи, взаємодіючи з солями, утворюють…(сіль і основу чи амфотерний гідроксид).
Як організувати роботу за методом «Мозковий штурм»
Після презентації проблеми та чіткого формулювання проблемного питання (його краще записати на дошці) запропонуйте всім висловити ідеї, коментарі, нанести фрази чи слова пов’язані з цією проблемою. Запишіть усі пропозиції на дошці чи на великому аркуші паперу в порядку їх виголошення без зауважень, коментарів запитань.
Наприклад, для уроку 1 «Загальна характеристика неметалічних елементів. Неметали як прості речовини», можуть бути такі питання для мозкового штурму:
- Як класифікують речовини?
- На які групи поділяють прості речовини?
- Як змінюються неметалічні властивості в межах періоду?
- Як змінюються неметалічні властивості в межах головної підгрупи?
- Усно охарактеризуйте елемент № 8, виходячи із розташування в Періодичній таблиці, за планом: а) період; б) група; в) підгрупа; г) порядковий номер; д) відносна атомна маса.
6. Назвіть найтвердішу з природних твердих речовин.
7. Із якої речовини складається грифель для олівця? Це м’яка чи тверда речовина?
8. Який шар в атмосфері захищає все живе від УФ випромінювання?
9. Для чого ми використовуємо активоване вугілля?
Для економії часу питання можна висвітлити на екрані або заздалегідь написати на дошці.
Створення наступної педагогічної умови як включення старшокласників у проектну діяльність проілюструємо фрагментом уроку 4 «Хімічні реакції, покладені в основу виробництва сульфатної кислоти, закономірності їх перебігу, охорона праці і довкілля»
Тип проекту: Дослідницький
Ідея проекту. Питання виробництва неорганічних та органічних речовин в курсі вивчення хімії є складним і не зрозумілим для учнів. Діти не можуть застосувати набуті знання про закономірності перебігу хімічних реакцій, на конкретних прикладах пояснити вибір умов проведення виробничого процесу, необхідної апаратури. На цьому уроці я вирішила вперше використати метод проектів. Запитань виникло багато: чи зможуть учні самостійно опрацювати цей матеріал, зробити логічні й правильні висновки, де вони візьмуть необхідну літературу, як підвести дітей до формулювання проблеми?
Етапи роботи над проектом.
I етап. Вибір проблеми, яка була б достатньо складною і одночасно доступною та зрозумілою кожному учневі.
II етап. Вибір об’єкта дослідження (бесіда з теми).
III етап. Вибір предмета дослідження (пояснення вчителя, виявлення питань, які потрібно обговорити в групах).
IV етап. Формулювання гіпотез.
V етап. Визначення напрямків роботи, безпосередніх завдань.
VI етап. Визначення шляхів пошуку інформації.
VII етап. Захист власних ідей.
VIII етап. Оцінювання роботи над проблемою.
Мета проекту: розширити уявлення учнів про хімічне виробництво і загальні наукові принципи на прикладі виробництва сульфатної кислоти.
Завдання проекту:
- навчитися формулювати основні наукові принципи хімічних виробництв; навчитися складати технологічні схеми хімічних процесів;
- навчитися визначити оптимальні умови проведення процесу;
- уміти проводити економічний аналіз;
- уміти складати план природоохоронних заходів та заходів з охорони праці на виробництві.
Обладнання: схеми «Наукові основи виробництва», «Комплексне використання мідної руди», «Контактний спосіб виробництва сульфатної кислоти».
Виконання проекту.
І. Організація класу.
II. Підведення учнів до формулювання проблеми.
«Мозкова атака» (5 хв). У таблиці вказано умови, які впливають на швидкість хімічних реакцій. Навести по одному прикладу для кожної умови, скласти рівняння реакцій, обґрунтувати їх здійснення.
1. Природа реагуючих речовин.
2. Концентрація реагуючих речовин ( рідини і гази);
3. Поверхня реагуючих речовин (тверді речовини).
4. Температура.
5. Наявність каталізатора (інгібітору).
Допоміжні запитання вчителя (3 хв):
- Чому сульфатна кислота є одним з найважливіших хімічних продуктів?
- Які властивості Н2SO4 зумовлюють таку її «популярність»?
- Які існують вимоги до якості кислоти?
- Які ви знаєте нові галузі використання кислоти?
Формулювання проблеми: наукові аспекти процесу виробництва сульфатної кислоти.
ІІІ. Вибір предмета дослідження.
Обговорення проблеми в групах (8-10 хв.)
І група – група наукового прогнозування – обговорює питання наукових основ будь-якого виробництва. Результати роботи оформляє у вигляді схеми. Кожний напрямок захищає один учень.
II група – група технологів – описує технологічний процес виробництва.
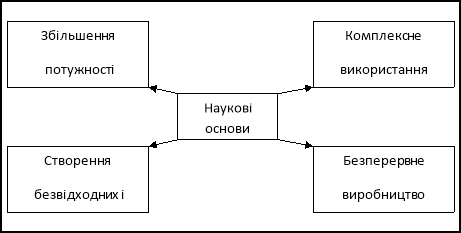
1. Добування сульфур (IV) оксиду SO2, випалювання піриту FeS2
2. Очищення сульфур (IV) оксиду.
3. Окиснення сульфур (IV) оксиду до сульфур (VI) оксиду.
4. Гідратація сульфур (VI) оксиду: FeS2 → SO2 →SОз →Н2 SО4
Проблема вибору сировини.
ІІІ група – виробнича – вивчає виробничі процеси: подача піриту, повітря, відведення SO2, умови проведення процесу випалювання , пояснення їх з точки зору закономірностей перебігу реакцій, очищення і окиснення SO2, гідратація SO2 в SО3, апарати, які використовуються (схема «Контактний спосіб виробництва, сульфатної кислоти»).
IV група – група охорони праці і довкілля – вивчає умови захисту кожного працівника підприємства, охорони довкілля.
IV. Захист проектів – 5-7 хв. На кожну групу
V. Висновок (спосіб розв’язання проблеми). Майбутнє належить новим екологічно безпечним, маловідходним і, де можливо, безвідходним технологічним процесам.
VI. Узагальнення, висновки, оцінювання роботи учасників проекту.
Запровадження рейтингової системи навчальних досягнень школярів, як важлива педагогічна умова, мала на увазі оцінювання умінь і навичок старшокласників на уроках хімії за допомогою спеціально розробленої системи та проведення наприкінці вивчення теми уроку – огляду знань.
За результатами проведеної роботи нами було вивчено показники відповідального ставлення до навчання на уроках хімії у 10-му класі. А саме:
- підвищення активності учнів на уроці;
- інтерес до вивчення нового матеріалу;
- систематична, ґрунтовна підготовка домашнього завдання;
- зацікавленість в отриманні знань.
Отримані результати занесено в табл.
Таблиця
Динаміка зрушень у показниках сформованості відповідального ставлення старшокласників до навчання (у %)
|
Критерії
|
До початку дослідження |
Після дослідження |
|
Мотиваційний: усвідомлення значущості відповідального ставлення до навчання. |
43,4 |
48,5 |
|
Діяльнісно-практичний: потреба розвивати відповідальність як якість особистості й усвідомлювати її; сумлінність. |
40,4 |
46,2 |
|
Емоційно-вольовий: уміння оцінювати соціальне бачення ситуацій – самовладання, стриманість, дисциплінованість, обов’язковість, впевненість у собі, цілеспрямованість, наполегливість, рішучість, почуття задоволення, почуття успіху, радість. |
29,5 |
35,3 |
|
Середній показник |
37,8 |
43,3 |
Можна стверджувати, що рівень сформованості відповідального ставлення до навчання в учнів підвищився в середньому з 37,8 % до 43,3 %.
За співбесідами з учнями та вчителем було з’ясовано, що розроблені засоби внесли певні зміни у навчально-виховний процес, зокрема: покращилися стосунки між учнями; учні стали більш згуртованими; в них розвинулося почуття справедливості; покращилися стосунки з вчителем, оскільки учні відчували об’єктивність його вимог.
Спираючись на вищесказане можна переконливо говорити про ефективність обґрунтованих на теоретичному рівні педагогічних умов формування відповідального ставлення старшокласників до навчання.
Матеріали дослідження можуть бути використані у практиці роботи вчителів хімії загальноосвітньої школи, які працюють у напрямку формування у учнів відповідального ставлення до навчання.


про публікацію авторської розробки
Додати розробку
