Методичні рекомендації з вивчення розділу "Металічні елементи та їхні сполуки"
 |
Укладач: Мельник Н.М. – викладач хімії Відокремленого структурного підрозділу – Львівський коледж «Інфокомунікації» Національного університету
«Львівська політехніка»
Схвалено цикловою комісією математичних, природничо-наукових дисциплін Відокремленого структурного підрозділу – Львівський коледж «Інфокомунікації» Національного університету «Львівська політехніка», протокол № 1 від 29.08.2019 р.
Методичні рекомендації містять теоретичні поняття і формули з розділів хімії згідно програми, тестові і контрольні завдання.
Зміст
Передмова……………………………………………………………………...……..4
І. Теоретичні відомості ……………………………………………………………...5
1.1.Загальна характеристика металів………………………………………………5
1.2.Загальні способи добування металів……………...…………………………...8
1.3. Чавун і сталь…………………………………………………………………….9
1.4. Відмінності між чавуном і сталлю……………………………………………11
1.5. Загальна характеристика лужних металів……………………………………15
1.6. Натрій і Калій…………………………………………………………………..17
1.7. Кальцій………………………………………………………………………….18 1.8. Алюміній…………………...…………………………………………………..20
1.9. Ферум…………….…………………………………………………………......22
ІІ. Контрольні запитання …………………………………………………………..27
2.1. Тестові завдання і задачі на тему:” Загальна характеристика металів”…………………………………………………………...…………………27
2.2. Тестові завдання і задачі на тему: “Лужні елементи і Кальцій та їх
сполуки”………………………………………………………..…………………...32
2.3. Тестові завдання і задачі на тему: “Алюміній і Ферум та їх
сполуки”………………...…………………………………………………………..42
Список використаної літератури…………………………………………………..49
ПЕРЕДМОВА
Хімія належить до природничих наук, які вивчають матеріальний світ у всій різноманітності його існування та перетворення. Предметом природничих наук є матерія і рух у їх нерозривній єдності.
Хімії, як одній із фундаментальних наук, нині в Україні приділяється недостатньо уваги, що призвело до зниження рівня хімічної освіти.
Цей факт є однією з причин значного загострення екологічного стану в переважній більшості регіонів. Проте завданням хімії не є боротьба з екологічним забрудненням, а допомога при розробці екологічно чистих технологій.
Дана методична розробка має за мету допомогти студентам в процесі самостійної роботи над предметом, оволодіти основами розділу із курсу загальної хімії та навчитись розв'язувати нескладні типові задачі. В розробці значну увагу приділено питанням практичного використання речовин, методам їх добування. Тести і задачі згруповано за рівнями складності, що дає можливість не тільки усунути прогалини у знаннях і вміннях, а й сприяє формуванню в студентів умінь самоконтролю та самокорегування.
Використання методичної розробки сприятиме навчанню організації самостійної навчальної роботи, допоможе вирішувати завдання швидко та правильно, розумно керувати собою та розпоряджатись своїм часом.
І. ТЕОРЕТИЧНІ ВІДОМОСТІ
1.1. Загальна характеристика металів
Загальні фізичні властивості металів
Металічні елементи займають в основному ліву нижню частину Періодичної системи хімічних елементів Д.І. Менделєєва. До металічних елементів належить ті елементи, в чиїх атомах на зовнішньому електронному рівні перебуває невелике (від одного до чотирьох) число електронів, які атоми можуть легко віддавати.
Метали мають низку загальних фізичних властивостей:
- добру електропровідність;
- добру теплопровідність;
- металічний блиск;
- добру пластичність (ковкість);
- зазвичай високу твердість;
- найчастіше перебувають у твердому агрегатному стані.
Про приналежність речовини до металів не можна судити тільки за однією ознакою. Так, деякі елементи можуть проводити електричний струм (графіт), мають металічний блиск (йод), мають пластичність (пластична сірка).Таким чином, відносити ту чи іншу просту речовину до металів або неметалів можна тільки за сукупністю ознак.
Завдяки металічному зв’язку окремі шари в кристалах металів можуть зміщуватися відносно один до одного. Це надає їм пластичності – здатності змінювати свою форму без розливу хімічних зв’язків. Наприклад, найбільш ковким металом є золото – з 1 г. золота можна витягнути дріт завдожки 2,4 км і завтовшки в кількасот разів менший від товщини волосся. Водночас метал сурма дуже крихкий – його навіть можна розтирати на порошок у ступці.
Оскільки різні метали мають подібні металічні зв’язки, а в ряді випадків утворюють подібні металічні кристали, то багато з них при переході в розплавлений стан можуть змішуватися один з одним, утворюючи сплави. Сплави мають більш різноманітні властивості порівняно з металами, тому в промисловості рідко використовуються чисті метали. У більшості випадків для виготовлення деталей різних машин та приладів застосовують сплави. Так, мідь, олово й цинк – це м’які метали, тимчасом як сплав на їхній основі – бронза- дуже твердий, тому бронзу люди здавна використовували для виготовлення зброї, плугів та інших виробів, де потрібна підвищена твердість. Сплав олова зі свинцем застосовують при паянні, тому що він має порівняно низьку температуру плавлення. Найпоширенішим зі сплавів є чавун і сталь – сплав заліза з вуглецем та іншими неметалами.
Загальні хімічні властивості металів
В атомах металів на зовнішній електронній оболонці утримується невелике число електронів. Ці електрони порівняно легко можуть відриватися від атомів. Така особливість металів є причиною не тільки їхніх фізичних, але й хімічних властивостей. Виходячи з того, що метали здатні тільки віддавати електрони зовнішнього електронного рівня, можна зробити висновок, що в хімічних реакціях метали здатні проявляти тільки властивості відновника. Основний процес, який характеризує хімічні властивості металів, можна записати у вигляді такої схеми:
Me0 __ ne → Me+n.
Взаємодія металів з неметалами
Більшість металів активно реагують із неметалами, при цьому метали виконують роль відновника, а неметали – окисника. У результаті реакцій утворюються бінарні сполуки: солі оксигенових кислот:
2ex2 2e
![]()
![]()
2Mg + O2 = 2Mg+2O-2 Fe + S = Fe+2S-2
3ex2
![]()
2Al+3I2=2Al+3I-23
Або в загальному вигляді:
ne
![]()
Me0 + неMe0 = Me+n неMe-n
Відновник Окиснювач Сіль безкисневої кислоти
Взаємодія металів з водою
|
Метали |
Хімічні процеси при реакції з водою |
Продукти реакції |
|
Лужні метали, а також Ca та Ba |
Me0 + HOH →
|
H2 і Me(OH)n |
|
Mg, Al, Mn, Zn, Cr, Fe, Ni, Pb |
Me0 + HOH → →Me+nO-2 + H2 |
H2 і MeO |
|
Cu, Ag, Au |
З водою не взаємодіють |
|
Взаємодія металів з кислотами
Активні метали, розташовані в ряді напруг до водню, витискують Гідроген із розчинів кислот. Метали, які розташовані в ряді напруг після водню, з розчинами кислот (окрім нітратної та сульфатної) не взаємодіють:
![]() Zn + 2HCl = ZnCl2 + H2
Zn + 2HCl = ZnCl2 + H2
Zn0 + 2H+ = Zn2+ + H2
![]() ВідновникСu + Cl Окиснювач2 = не взаємодіють
ВідновникСu + Cl Окиснювач2 = не взаємодіють
Якщо метал здатний проявити кількість ступенів окиснення, то при взаємодії з безоксигеновою кислотою утворюється сіль, у якій метал, як правило, має нижчий ступінь окиснення, наприклад:
![]() Fe + 2HCl =FeCl2 + H2 Fe0 + 2H+ = Fe2+ + H2
Fe + 2HCl =FeCl2 + H2 Fe0 + 2H+ = Fe2+ + H2
Взаємодія металів із солями
Більш активні метали здатні витісняти менш активні з їхніх солей:
Fe0 + Cu 2+ → Fe2+ + Cu0; Cu0 + Fe2+≠
Zn0 + Fe2+ →Zn2+ + Fe0; Fe0 + Zn2+ ![]()
1.2. Загальні способи добування металів
Лабораторні методи добування
а) відновлення оксидів металів воднем; таким способом зазвичай добувають не дуже активні метали, які не взаємодіють із воднем:
CuO + H2 → Cu + H2O;
WO3 + 3H2 → W + 3H2O;
б) розкладання оксидів важких металів:
2HgO→2Hgt + O2;
в) витіснення металів з їхніх солей більш активними металами: Fe + CuSO4 → FeSo4 + Cu; Zn + HgCl2 →ZnCl2 +Hg.
Добування металів у промисловості
а) відновлення оксидів металів вуглецем або кремнієм:
2CuО + C → 2Cu + CО2;
2FeO + Si → 2Fe + SiO2;
б) відновлення оксидів металів карбон монооксидом:
Fe2O3 + CO →2Fe + 3CO2;
в) відновлення металів з оксидів більш активними металами в розплавах: 3V2O5 + 10Al → 6V + 5Al2O3; MnO2 + Mg → Mn + 2MgO.
Відновлення металів з оксидів більш активними металами називають металотермічним методом. Найпоширенішим металом, що його використовують як відновник, є алюміній (алюмінотермія).
1.3. Чавун і сталь
Найпоширеніші сплави – це чавун і сталь. Обидва ці сплави є на основі заліза. Головна відмінність між ними – це вміст вуглецю. Якщо вміст вуглецю перевищує 4%, то такий сплав називають чавуном. Якщо ж вміст вуглецю менший 4%, то такий сплав називають сталлю. Вміст вуглецю в цих сплавах посутньо впливає на їхні фізичні властивості. Якщо чавун є твердим і крихкими, то, на відміну від нього, сталь являє собою більш м’який і пластичний сплав. Окрім того, до складу сталі додають ще деякі інші метали задля добування сталі з необхідними характеристиками. Так, додавання до сталі марганцю підвищує її зносостійкість, що дозволяє використовувати її для виготовлення залізничних рейок. А додавання хрому збільшує стійкість до корозії, таку сталь називають іржостійкою.
Відповідно, вміст у цих сплавах певних добавок визначає галузь їхнього застосування в народному господарстві.
Виробництво чавуну
Ще в прадавні часи, кілька тисячоліть тому, металурги вміли добувати безпосередньо з руди (ферум оксиду) м’який сорт сталі. Для цього в невеликих печах (горнах) укладали шарами залізну руду й деревне вугілля. Температуру, необхідну для перетворення руди в метал (відновлення заліза), отримували за допомогою дуття. Наприкінці процесу, що тривав кілька годин, виходив метал у твердому стані, у вигляді губчастої маси. Його витягували з горнів і кували. У XVIII ст. почалася промислова революція. Під впливом зростаючого попиту на метал почали будувати більш об’ємні горни й застосовувати більш інтенсивне дуття. Зміна технології призвела до небажаних результатів: у горнах, окрім твердої сталі, виходив побічний продукт – рідкий чавун. На відміну від сталі, він нековкий і непридатний для застосування. Пізніше був розроблений відносно простий спосіб переробки чавуну в сталь: через рідкий чавун продували повітря. При цьому вуглець вигорав, і сплав набував пластичності. З відкриттям способу переробки чавуну в сталь почали будувати більші печі й усю руду перетворювати в чавун.
Як сировину для виробництва чавуну використовують залізну руду, що складається з оксидів Феруму, найчастіше Fe2O3 . Вона містить також порожню породу, до складу якої входять сполуки Силіцію ( SiO2), Мангану (MnO2), Алюміню (Al2O3), Фосфору (Са3(РO4)2), Сульфуру (FeS2, CaSO4) та ін.
Перед плавкою руду збагачують – видаляють із неї певну частину порожньої породи, потім подрібнюють великі шматки руди до необхідних (оптимальних) розмірів, а пилувату руду спікають із вугіллям – піддають агломерації.
У доменній печі протікає величезна кількість реакцій, які поділяють на кілька груп.
1-ша група реакцій.
Горіння коксу й утворення відновника – карбон (ІІ) оксиду. Сьогодні в домни, окрім повітря, надходить природний газ, який інтенсифікує процес плавки й дозволяє зменшувати витрату дорогого коксу: C + O2 →CO2; CO2 + C → 2CO; 2CH4 + 3O2 → 2CO + 4H2O.
2-га група реакцій.
Відновлення ферум (ІІІ) оксиду карбон (ІІ) оксидом протікає трьома послідовними стадіями:
Fe2O3 → Fe3O4 → FeO → Fe
3FeW(Fe)2O3 + CO → 2Fe 70 % 3O4 +CO72% 2 ; 76%
Fe3O4 + CO → 3FeO + CO2; FeO + CO → Fe + CO2.
3-тя група реакцій.
Відновлення домішок. Завдяки цій групі реакцій багато елементів порожньої породи переходять у чавун:
SiO2 + 2CO → Si + CO2;
MnO2 + 2CO → Mn + 2CO2;
Ca3(PO4)2 + 5CO = 2P +5CO2 + 3CaO.
Частина Сульфуру з природних сполук переходять у чавун у вигляді сполуки, а частина – в сірчистий газ , який виходить із доменної печі в суміші з іншими газами, а потім вловлюється.
4-та група реакцій.
Утворення чавуну найчастіше описують за допомогою рівняння реакцій між залізом та коксом, а також між залізом та чадним газом:
3Fe + C = Fe3C,
3Fe + 2CO = Fe3C + CO2.
5-та група реакцій.
Утворення шлаку відбувається в такий спосіб. Флюси під впливом високих температур розкладаються з утворенням реакційно здатних основних оксидів CaO та MnO . Вони реагують із тими компонентами порожньої породи, які мають кислотні або амфотерні властивості, наприклад із SiO2 та Al2O3 .
Утворювані в процесі плавки силікати, алюмосилікати, алюмінати, деякі сульфіди утворюють побічний продукт доменного виробництва – шлак. Він відзначається невеликою густиною й тому накопичується на поверхні чавуну, запобігаючи його окисненню.
1.4. Відмінності між чавуном і сталю.
Способи виробництва сталі.
Склад чавуну
Масова частка елементів у чавуні: Карбону – до 4,5%, Фосфору – 2, 5%, Сульфуру – до 0,8%. Від вмісту того чи іншого елемента та домішок залежить властивості чавуну й поділ його на сорти. Розрізняють чавун білий і сірий. Якщо Карбон у чавуні перебуває у вигляді граніту, то такий чавун називають сірим або ливарним. Його використовують для виготовлення відливків (великих деталей машин, маховиків, плит), які не піддають ударам та механічній обробці. Білий чавун (на зламі він має світло-сірий колір) містить Карбон у вигляді ферум карбіду Fe3C . Такий чавун називають переробним, його використовують для переробки в сталь.
Склад сталі
Сталь – це сплав заліза з вуглецем, масова частка вуглецю в якому не перевищує 4,0 %. Сталь із найбільшим вмістом вуглецю 4,0% називають твердою. Її використовують для виготовлення інструментів. Сталь із мінімальним вмістом вуглецю (до 0,3%) називають м’якою й ковкою. Вона містить також деякі технологічні домішки, які можуть бути як корисними, так і шкідливими. До корисних домішок відносять марганець і кремній, вони мають входити до сталі будь-яких марок (марганцю від 0,3 до 0,9%, кремнію від 0,2 до 0,5%). Якщо в процесі переробки чавуну в сталь ці елементи переходять у шлак, їх спеціально додають наприкінці плавки. Марганець зменшує червоноламкість сталі, тобто ламкість при обробці нагрітої сталі, а кремній запобігає утворенню пористості у відливках, що може бути спричинене наявністю пухирців карбон (ІІ) оксиду. Добавки кремнію й марганцю роблять сталь більш якісною (легованою), тобто більш зносостійкою, жароміцною тощо. До корисних легувальних добавок, які спеціально додають у сталь, відносять також хром, нікель, вольфрам, молібден, ванадій, титан, алюміній. При виплавці сталі з чавуну до її складу переходять шкідливі домішки: Сульфур, Фосфор, Арсен, Стибій, Плюмбум, Цинк, Станум. Окрім того у процесі плавки в сталь потрапляють Оксиген, Нітроген, Гідроген. Ці газуваті речовини в рідкій сталі реагують між собою або з легувальними добавками (алюмінієм, кремнієм, марганцем) і утворюють крихкі хімічні сполуки (оксиди, сульфіди, нітриди), що знижують такі домішки як Сульфур та Фосфор. Сульфур, а точніше ферум (ІІ) сульфід, надає сталі ламкості при гарячій обробці (червоноламкість), а Фосфор (фосфор (V) оксид і фосфіди) надає холодноламкості. Частину домішок (Сульфур й Фосфор) можна видалити в процесі плавки сталі, якщо до неї додати флюси. Деякі небажані домішки (Стибій, Плюмбум, Станум, Цинк) видалити зі сталі неможливо. Такі небажані домішки, як водень, кисень, азот, видаляють із рідкої сталі тільки після її виплавки за допомогою вакуумування або продувки аргоном.
Хімічні реакції, які перебувають в основі переробки чавуну в сталь 1-ша група реакцій.
При виплавці чавуну протікають реакції відновлення Феруму, а при переробці чавуну в сталь – реакції окиснення домішок. Подібно до того, як у доменному процесі протікали небажані процеси відновлення домішок, так і при виплавці сталі відбувається небажана реакція – окиснення Феруму. Слід зазначити, що атмосфера в сталеплавильних печах є окисною. У ній міститься повітря, кисень та пари води. Саме вони й спричиняють окиснення Феруму, перетворення його в ферум (ІІ) оксид, що можна зобразити рівнянням: 2Fe + O2 = 2FeO + Q.
Доведено, що при плавці сталі ніякий інший ферум оксид не утворюється. Більше того, якщо в сталеплавильну піч помістити оксиди Fe3O4 або Fe2O3 , що містяться в залізній руді або іржі металобрухту, то вони реагують із залізом як окисники, утворюючи все той же ферум (ІІ) оксид: Fe + Fe3O4 = 4FeO.
2-га група реакцій.
Окиснення домішок (кремнію, марганцю, фосфору) ферум (ІІ) оксидом протікає за типом заміщення. Утворювані оксиди, крім СО, являють собою пористі тверді речовини, й тому поступово спливають на поверхню сталі. Окиснення вуглецю спричинює в розплаві ефект кипіння, що викликаний виділенням пухирців газу карбон (ІІ) оксиду. Їхній рух відіграє позитивну роль, оскільки сприяє перемішуванню металу, очищенню від шлаку, що утворився в ньому, а також від пухирців азоту й водню.
3-тя група реакцій.
До неї входять процеси усунення сполук Сульфуру й Фосфору негашеним вапном СаО. Для більш повного зв’язування зазначених домішок вапно використовують не тільки для футерування внутрішніх поверхонь печей, але й добавки до сталі. Кальцій оксид при цьому вступає в такі реакції: 3CaO + P2O5 = Ca3(PO4)2, CaO + FeS = CaS + FeO.
Сульфід і фосфат Кальцію утворюють шлак, що спливає на поверхню сталі, а ферум оксид FeO залишається в розплаві сталі. Його усувають тоді, коли кількість вуглецю зменшиться до необхідного значення. Процес усунення оксиду FeO називають розкисненням сталі. Цього досягають додаванням у розплав таких відновників, надлишок яких не знизить якості сталі. До розкислювачів відносять сплави заліза з марганцем або кремнієм, а також алюміній.
Способи виробництва сталі
Сьогодні плавку сталі здійснюють різноманітними способами в печах різної конструкції. Це залежить від того, яким критеріям має відповідати виплавлювана сталь, які шихтові матеріали використовують та за допомогою якого методу створюють тепло, необхідне для плавки. Найбільш перспективний із сучасних способів – конвертерний. Основні технологічні особливості киснево-конвертерного способу виробництва сталі полягають у використанні як сировини рідкого чавуну. Перевагою цього способу є те, що процес здійснюється досить швидко, а собівартість добутої сталі відносно низька. Тим часом недоліками конвертерного процесу вважають періодичність та невисоку якість сталі. Застосування кисневого дуття дозволяє інтенсифікувати процес, скоротити час плавки до 20 хв., добути високоякісну м’яку сталь, яка характеризується значною чистотою.
При мартенівському способі переробки чавуну в сталь можливе використання як вихідного матеріалу твердого чавуну, металобрухту, залізної руди, що одночасно виконує роль окисника, а як паливо застосовують газ. Найважливішою перевагою мартенівського способу переробки чавуну є можливість добування якісної сталі. З 1970 року будівництво мартенівських печей зупинено, тому що вони громіздкі й непристосовані до роботи з перервами. Щоб мартенівська піч не охолонула, навіть у період випуску сталі не припиняють спалювати паливо. У цих печах важко добути високоякісні леговані сорти сталі, оскільки атмосфера печі й шлаки є окисними.
Високоякісні сорти сталі добувають електротермічним (але електродуговим) способом, на сьогоднішній день це найпоширеніший метод. Джерелом тепла в даному процесі є електрична дуга, яка виникає між графітними (вугільними) електродами. Температура дуги сягає +3000 – 4000 С, унаслідок чого відбувається швидкий розігрів сировини й плавлення металу. Атмосфера в печі відносна, оскільки згоряння електродів призводить до утворення карбон (ІІ) оксиду. У шлаку так само міститься невелика кількість оксидів Феруму, що дозволяє здійснювати легування сталі з незначною втратою добавок. Однак електродуговим способом не можна добувати сорти сталі, в яких вуглецю міститься менше 0,1%, оскільки частина вуглецю обов’язково переходить у сталь при згоранні електродів.
1.5. Загальна характеристика лужних металів
Будова атомів лужних металів
У зовнішньому електронному шарі атоми лужних металів мають по одному електрону. У передзовнішньому електронному шарі в атома Літію 2 електрони, а в атомів інших металів по 8 електронів. Однакова будова не тільки зовнішнього, але й передостаннього електронного шару атомів усіх лужних металів, окрім Літію, обумовлює велику подібність властивостей цих елементів. Водночас збільшення заряду ядра й загального числа електронів в атомі зі збільшенням порядкового номера, збільшення числа електронних шарів (збільшення радіуса) спричиняє деякі відмінності в їхніх властивостях (збільшення легкості віддачі валентних електронів, посилання металічних властивостей).
Маючи в зовнішньому електронному шарі тільки по одному електрону, що перебуває на порівняно великій відстані від ядра, атоми цих елементів досить легко віддають електрон, тобто характеризуються низькою енергією йонізації. Утворювані при цьому однозарядні позитивні йони мають стійку електронну структуру відповідного інертного газу (Li+→He; Na+→Ne тощо).
Легкість віддачі зовнішніх електронів характеризує розглянуті елементи як найбільш типових представників металів: металічні властивості в лужних металів виражені дуже чітко.
Загальні фізичні властивості лужних металів
Усі лужні метали мають кубічну об’ємноцентровану кристалічну гратку, яка не є щільно упакованою (атоми займають у ній лише 68% наявного об’єму), тому всі лужні метали – легкі. Вони мають металічний блиск на свіжому зрізі металу.
Лужні метали характеризуються незначною твердістю, малою густиною, низькими температурами кипіння й плавлення, що пояснюється слабкими хімічними зв’язками в кристалічних гратках цих металів.
Загальні хімічні властивості лужних металів
Лужні метали належать до числа найбільш активних у хімічному відношенні елементів. На свіжому зрізі лужні метали мають блискучу поверхню, однак, вступаючи в контакт із киснем повітря, вони окиснюються й швидко тьмяніють, тому в разі потреби їх зберігають під шаром гасу. Усі лужні метали горять в атмосфері повітря, утворюючи оксиди одного або кількох типів – нормальні оксиди складу , пероксиди складу та супероксиди. При цьому тільки літій згоряє на повітрі з утворенням оксиду:
4Li + O2 = 2Li2O,
а інші лужні метали утворюють пероксиди й супероксиди (або їхню суміш): 3Na + 2O2 = Na2O2 + NaO2.
Оксиди Натрію й Калію можуть бути отримані тільки при нагріванні суміші пероксиду з надлишком металу за відсутності кисню: K2O2 + 2K = 2K2O.
Легко віддаючи в хімічних реакціях свої валентні електрони, лужні метали сполучають з воднем при нагріванні, утворюючи гідриди:
2Me + H2 = 2MeH.
При взаємодії з галогенами, сіркою, азотом, фосфором, вуглецем та кремнієм утворюються відповідно галогеніди, сульфіди, нітриди, фосфіди, карбіди та силіциди.
При взаємодії лужних металів з водою утворюються луги й водень: 2Me + 2H2O = 2MeOH + H2.
Активність металів зростає згори вниз за групою.
Із кислотами всі лужні метали реагують із вибухом, тому такі реакції спеціально не проводять.
Солі лужних металів розчиняються у воді, за винятком деяких солей Літію: фториду, карбонату, фосфату.
Якщо внести в полум’я газового пальника сіль лужного металу, то вона розкладається, і пари вивільненого металу забарвлюють полум’я в характерний для даного металу колір. Калій забарвлює полум’я у фіолетовий колір, Натрій – у жовтий, а Літій – у малиновий. Леткі солі Рубідію та Цезію забарвлюють безбарвне полум’я пальника в рожево-фіолетовий колір.
1.6. Натрій і Калій
Поширеність у природі
Зі сполуки лужних металів широко розповсюджені в природі лише сполуки Натрію й Калію. У вигляді простих речовин у середовищі вони не зустрічаються, тому що занадто активні.
Найважливішими природними сполуками Натрію й Калію є: натрій хлорид (NaCl), натрій сульфат – мірабіліт (Na2SO4 ∙ 10H2O), сильвініт (NaCl ∙ KCl), карналіт ( KCl ∙ MgCl2 ∙ 6H2O ). Сполуки інших лужних металів зустрічаються дуже рідко. Францій отриманий штучно в ядерних реакціях.
Добування натрію й калію
Лужні метали надзвичайно активні і є найсильнішими серед відомих відновників, тому електроліз водних розчинів солей цих металів не призводить до добування самих металів, а лише до утворення лугів. Прості речовини добувають електролізом розплавів їхніх галогенідів, найчастіше – хлоридів, що утворюють природні мінерали. Металічний натрій у промисловості добувають електролізом розплаву натрій хлориду з інертними (графітними) електродами.
Фізичні властивості натрію й калію
Натрій і калій – сріблясто-білі метали, що мають добру
електропровідність; м’які, легші від води (плавають на її поверхні, реагуючи з нею).
Хімічні властивості натрію й калію Натрій і калій активно взаємодіють із галогенами: 2Na + Cl2 → 2NaCl; 2K + Br2 → 2KBr.
На повітрі натрій і калій активно згорають. Причому продуктом реакції є не оксиди, а пероксиди або надпероксиди:
2Na + O2→ Na2O2;
K + O2 → KO2
H2 + O2 → H2O2
Як і всі лужні метали, натрій і калій активно взаємодіють із водою, з утворенням водню та відновних лугів. Калій найчастіше при такій взаємодії набухає:
2H2O+ O2 → 2H2O2
2Na + 2H2O → 2NaOH + H2
Застосування сполук натрію й калію
Натрій та його сплав з калієм застосовують як рідкометалеві теплоносії. У металургії натрій метричним методом добувають низку тугоплавких металів, а відновлюючи натрієм КОН, виділяють калій. Окрім того, натрій використовують як зміцнювальну добавку свинцевих сплавів. В органічному синтезі натрій використовують для добування багатьох речовин. Він слугує також каталізатором при добуванні деяких органічних полімерів. Із ртуттю натрій утворює твердий сплав – амальгаму натрію, яку іноді використовують як більш м’який відновник замість чистого металу. Натрій гідроксид застосовують для очищення продуктів переробки нафти, у миловарній, паперовій, текстильній та інших галузях промисловості, а також при виробництві штучного волокна.
Калій потрібен у значній кількості для живлення рослин, тому його широко використовують як добриво у вигляді нітрату. Поташ K2CO3 використовують при виробництві скла та рідкого мила.
1.7. Кальцій
Характеристика хімічного елемента
Кальцій перебуває в головній підгрупі ІІ групи, належить до лужноземельних металів разом з Барієм та Стронцієм. У зовнішній оболонці він має два електрони й може легко віддавати їх, утворюючи йони зі стійкими конфігураціями інертних газів.
Поширеність у природі
Кальцій має велику хімічну активність, тому зустрічається в природі тільки у вигляді сполук. Найважливіші природні сполуки Кальцію: а)вапняк, мармур, крейда (CaCO3); б) гіпс (CaSO4∙ 2H2O); в) фосфорит і апатит (Ca3(PO4)2); г) доломіт ( CaCO3 ∙ MgCO3).
Фізичні властивості
Кальцій – метал сріблясто-білого кольору, дуже легкий, як і лужні метали, але значно твердіший за них і має більш високу температуру плавлення (+851 С). Кальцій зберігають під шаром гасу.
Добування
Кальцій добувають шляхом електролізу його розплавленого хлориду.
CaClел. струм2 → Ca + Cl2
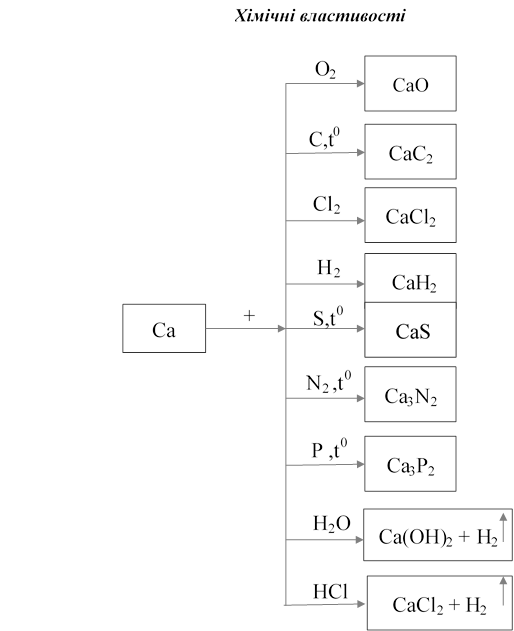
Застосування
Найважливішою сполукою Кальцію є його карбонат CaCO3 . Він являє собою основну складову частину вапняку, мармуру, крейди, а також входить до складу доломіту (CaCO3∙MgCO3). Кальцій карбонат використовують у виробництві цементу, сталі, скла. Кальцій карбід застосовують в органічній хімії. А ще він відіграє важливу роль у біохімічних процесах, які протікають у живих організмах.
1.8. Алюміній
Характеристика хімічного елемента
Алюміній перебуває в головній підгрупі ІІІ групи, належить до рідкісноземельних металів. На його зовнішньому електронному шарі міститься три електрони, які він здатний віддати.
Порівнюючи Алюміній з іншими елементами цієї підгрупи, можна відзначити неметалічність Бору, який стоїть після Берилію в періоді, металічні властивості Галію, із чого можна припустити амфотерності сполук Алюмінію, тобто проміжних (від металічних до неметалічних) властивостей цього елемента.
Поширеність у природі
Алюміній – найпоширеніший метал на Землі (3-тє місце серед усіх елементів; 8% складу земної кори). У вигляді простої речовини він у природі не зустрічається; входить до складу багатьох сполук, які утворюють грунт: глиноземів (Al2O3) та бокситів ( Al2O3∙ xH2O).
Фізичні властивості
Алюміній – сріблясто-білий метал. Він ковкий, легко витягується в дріт, температура плавлення дорівнює +660 градусів Цельсія, температура кипіння дорівнює +2520 градусів Цельсія. При кімнатній температурі алюміній не змінюється в повітрі, тому що його поверхня покрита тонкою оксидною плівкою, яка характеризується сильною захисною дією.
Хімічні властивості 1)Взаємодія з киснем.
Алюміній є активним металом, тому на повітрі швидко реагує з киснем. Але перетворенню піддається тільки та частина алюмінію, яка перебуває на поверхні зразка, тому що продукт взаємодії – алюміній оксид – утворює щільну оксидну плівку:
4Al + 3O2 = 2Al2O3.
2) Взаємодія з галогенами.
Порошкоподібний алюміній активно взаємодіє з йодом за звичайних умов у присутності каталітичної кількості води:
2Al + 3I2 = 2AlI3.
3) Взаємодія з сіркою.
2Al + 3S = Al2S3.
4) Взаємодія з водою.
Незважаючи на високу хімічну активність, з водою алюміній не взаємодіє. У першу чергу, завдяки захисній плівці, а також тому, що продукт взаємодії алюмінію з водою – нерозчинна речовина.
5) Взаємодія з кислотами.
Аналогічно до всіх активних металів алюміній витісняє водень із розчинів кислот:
2Al + 6HCl = 2AlCl3 + 3H2; 2Al + 3H2SO4 =Al2(SO4)3 + 3H2.
6) Взаємодія з лугами.
Завдяки тому, що алюміній утворює амфотерні сполуки, він також здатний витісняти водень із розчинів лугів:
2Al + 2NaOH + 6H2O → 2NaAl(OH)4 + 3H2.
Добування алюмінію
Алюміній є одним із багатотонажних продуктів металургійної промисловості. Його добувають у величезних кількостях, тому що він є цінним матеріалом і реагентом. У сучасній металургії алюміній добувають електролізом бокситів (алюміній оксиду). Оскільки сам алюміній оксид є дуже тугоплавкою речовиною, для зменшення енерговитрат у боксит додають плавиковий шпат (кальцій фторид), що знижує температуру плавлення руди.
Застосування алюмінію
Алюміній є цінним конструкційним матеріалом. Маючи відносну легкість (густина алюмінію набагато легша, ніж у сталі), він є досить міцним металом. Його використовують для виготовлення легких конструкцій, у сплаві з магнієм для обшивки літаків ,тощо. З алюмінію виготовляють столові прибори й посуд. У великих кількостях алюміній використовують у металургії для добування металів алюмотермічним способом.
1.9. Ферум
Властивості хімічного елемента
Ферум належить до металічних елементів. За будовою електронної оболонки його відносять до d-елементів, тому що в нього відбувається заповнення електронами d-підрівня.
Здебільшого Ферум виявляє окиснення +2 (за рахунок двох електронів зовнішнього рівня) або +3 (віддаючи ще один електрон з передзовнішнього рівня). Ступінь окиснення +3 для Феруму більш стабільний, оскільки передзовнішній d-підрівень у цьому разі стає наполовину заповненим, що є більш вигідним. Ферум є досить активним елементом. У хімічних реакціях він проявляє здебільшого металічні властивості.

У виняткових випадках Ферум може віддавати шість електронів і виявляє ступінь окиснення +6. Однак такі сполуки, в яких міститься Fe+6 , зустрічаються досить рідко.
Поширеність у природі
Ферум є одним з найпоширеніших елементів-металів на Землі. У земній корі 5% маси припадає на атоми Феруму. Тільки Алюмінію в літосфері міститься більше (8,13%).
У природі Ферум зустрічається у вигляді сполук. Найпоширеніші сполуки феруму – оксиди: ферум (ІІ) оксид FeO , ферум (ІІІ) оксид Fe2O3, а також змішаний оксид Fe3O4, який іще називають залізною окалиною. Сполуки тривалентного Феруму мають колір – від жовтого до бурого, залежно від складу. Саме вони надають жовтуватого кольору піску та бурого забарвлення багатьом грунтам.
Ферум входить до складу великої кількості різних мінералів у вигляді оксидів, сульфідів та сполук з іншими елементами. Зазвичай ці речовини розсіяні в земній корі, але зустрічаються й скупчення мінералів. Саме вони є джерелом залізної руди, з якої потім добувають залізо.
Сполуки Феруму розчинені у водах деяких мінеральних джерел. Наявність у воді сполук двовалентного Феруму надає їй присмаку металу. Іноді у водопровідній воді, яка тече по старих іржавих трубах, розчинені сполуки тривалентного Феруму, що надає воді кольору іржі.
Атоми Феруму також є складовою частиною багатьох живих організмів: в організмі дорослої людини міститься близько 4-5 г. атомів Феруму. Він входить до складу деяких вітамінів, білків, зокрема гемоглобіну – речовини, завдяки якій кров може переносити кисень по організму й виводити вуглекислий газ. У вигляді простої речовини залізо входить до складу деяких метеоритів. Іноді зустрічаються злитки самородного заліза, хоча більшість учених вважають, що вони теж мають «метеоритне» походження.
Фізичні властивості заліза
Залізо є речовиною з немолекулярною будовою. У звичайних умовах являє собою метал сірого кольору з металічним блиском, добре проводить електричний струм і теплоту. Залізо є досить пластичним металом і добре піддається куванню. Температура плавлення заліза +1540 оС, густина 7,87 г/см3. Як і багато інших металів, залізо не розчиняється у воді та в інших розчинниках, але розчиняється в ртуті.
Залізо притягується магнітом, тобто є парамагнетиком. Для нього також характерне явище феромагнетизму – воно зберігає намагніченість після усунення зовнішнього магнітного поля. Завдяки цьому із заліза можна виготовляти магніти, а також матеріали для запису інформації.
Хімічні властивості заліза
Залізо досить активно вступає в хімічні взаємодії. Оскільки має явні металічні властивості, то воно вступає переважно в реакції з неметалами.
Залізо активно вступає у взаємодію з киснем навіть у звичайних умовах.
При нагріванні його на повітрі поверхня покривається залізною окалиною: 3Fe + 2O2 → Fet3 O4.
Якщо розжарений залізний дріт помістити в посудину, заповнену чистим киснем, то залізо спалахне, розкидаючи яскраві іскри.
Залізо може активно згорати навіть на повітрі. Однак це можливо тільки тоді, коли воно подрібнене до дуже дрібного порошку, його називають пірофорним залізом. Якщо такий порошок потрапляє в повітря, то він яскраво спалахує навіть при кімнатній температурі. Подрібнити залізо до дрібного порошку звичайними методами неможливо. Це роблять за допомогою хімічних методів.
Залізний дріт також дуже активно згоряє, якщо його помістити в посудину, наповнену хлором. При цьому утворюється ферум (ІІІ) хлорид: 2Fe + 3Cl2 → 2FeCl3.
Залізо також активно взаємодіє із сіркою. У результаті цієї реакції утворюється ферум (ІІ) сульфід:
Fe + S → FeS
Залізо здатне реагувати з водою. При пропусканні перегрітої пари через розжарені залізні ошурки перетворюється в залізну окалину й при цьому виділяється водень:
3Fe + 4H2O → Fet 3O4 + 4H2.
У звичайних умовах залізо активно реагує з кислотами. При цьому утворюються солі, до яких Ферум входить зі ступенем окиснення +2: Fe + H2SO4 → FeSO4 + H2.
Ферум також здатен витіснити менш активні метали з розчинів солей: Fe + CuSO4 → FeSO4 + Cu.
Зі ступенем окиснення +3 він може проявляти амфотерні властивості. Це можна довести тим, що ферум (ІІІ) гідроксид розчиняється в гарячому концентрованому лузі:
Fe(OH)3 + NaOH = Na [ Fe(OH)4].
Амфотерні властивості Феруму проявляються значно слабше, ніж в Алюмінію, тому що алюміній гідроксид розчиняється в лугах у звичайних умовах, а ферум (ІІІ) гідроксид – при нагріванні й за умови високої концентрації лугу.
Застосування заліза
Залізо є одним із семи найстарших металів , відомих людству з давніх часів. Унаслідок високої хімічної активності самородне залізо (тобто у вигляді простої речовини) на Землі не зустрічається. Люди навчилися добувати залізо на початку першого тисячоліття до нашої ери. Звідтоді почався залізний вік розвитку нашої цивілізації. Хоча в археологічних розкопках іноді зустрічаються залізні вироби, датовані другим і третім тисячоліттям до нашої ери, це так зване космічне залізо – уламки залізних метеоритів, які впали на Землю.
Залізо є набагато твердішим металом, аніж мідь, тому знаряддя праці та зброю для полювання було зручніше виготовляти саме з нього. Однак для добування заліза необхідна більш висока температура вогню, ніж для добування міді. І хоча міді в земній корі міститься приблизно в 1000 разів менше, ніж заліза, її було простіше виплавляти й обробляти. Отож першим металом, який почали обробляти люди, була мідь, а не залізо.
Залізо здебільшого використовують у вигляді сплавів: чавуну й сталі. Чавун за фізичними властивостями посутньо відрізняються від заліза: він набагато твердіший і крихкіший. Саме тому чавун не піддається куванню, однак із нього виходять предмети, які можуть витримувати великі механічні навантаження. Раніше з нього виплавляли гармати та ядра й навіть посуд. Зараз із чавуну роблять станини для верстатів, лещата та інші вироби, для яких більше важить механічна міцність, а не пластичність. Такі вироби дуже бояться ударів, від сильного удару чавун розбивається.
Широко розповсюджена іржостійка сталь, її добувають додаванням у сталь нікелю й хрому, а для виготовлення зносостійкої сталі додають марганець (таку сталь використовують для залізничних рейок).
ІІ. КОНТРОЛЬНІ ЗАПИТАННЯ
2.1. Тестові завдання і задачі на тему: «Загальна характеристика металів»
Загальна характеристика металів
У кожному завданні серед чотирьох наведених варіантів відповідей виберіть один правильний.
1. Позначте характерні риси металів:
А) пластичність;
Б) золотистий колір;
В) не проводить теплоту;
Г) рідкий агрегатний стан.
2. Позначте метали, що мають характерне забарвлення:
А) залізо та цинк;
Б) алюміній та хром;
В) калій і натрій;
Г) мідь та золото.
3. Позначте благородні метали:
А) золото і платина;
Б) залізо і хром;
В) мідь і алюміній;
Г) магній і кальцій.
4. Позначте тип хімічного зв’язку в металах:
А) ковалентний;
Б) йонний;
В) металічний;
Г) водневий.
5. Позначте ряд елементів, у якому наведено тільки металічні елементи:
А) Купрум, Аргентум, Ферум;
Б) Натрій, Магній, Сульфур;
В) Алюміній, Силіцій, Плюмбум;
Г) Нітроген, Фосфор, Хлор.
6. Позначте правильне твердження щодо захисту металів від корозії:
А) метали, що перебувають під водою, не піддаються корозії; Б) для захисту від корозії необхідно припинити контакт металевої поверхні з навколишнім середовищем;
В) для захисту від корозії необхідно металеві поверхні робити дзеркальними;
Г) для захисту від корозії необхідно металеві поверхні зачищати наждачним папером.
7. Позначте правильне твердження щодо чавуну:
А) це розчин вуглецю в залізі;
Б) залізо, що виготовлене в мартенівській печі;
В) чисте залізо без домішок інших речовин;
Г) інша назва сталі.
8. Позначте металічні р - елементи:
А) Купрум;
Б) Станум;
В) Хром;
Г) Аурум.
9. Позначте метали, що трапляються в природі в самородному стані:
А) золото і срібло;
Б) залізо і хром;
В) калій і натрій;
Г) магній і кальцій.
10. Позначте відновник, що використовують для добування металів у промисловості:
А) сірководень;
Б) натрій сульфат;
В) амоніак;
Г) вуглець.
11. Позначте метод, за допомогою якого добувають метали в промисловості:
А) пірометалургія;
Б) крекінг;
В) ректифікація;
Г) випалювання.
Установіть відповідність між інформацією, позначеною цифрою, і варіантом відповіді, позначеним літерою.
12. Установіть відповідність металічного елементу властивостям його сполуки.
Металічний елемент Властивості сполуки
1) Калій; А) Гідроксид належить до лугів;
2) Купрум; Б) Сполуки з валентністю металу ІІ в розчинах
3) Кальцій; блакитного забарвлення;
4) Алюміній. В) Гідроксид – амфотерна сполука;
Г) Оксид дуже енергійно взаємодіє з водою;
Д) Оксид має кислотні властивості.
13. Установіть відповідність між металом та його властивостями.
Метали Властивості
1) Залізо; А) Активно розчиняється в розчинах лугів;
2) Цинк; Б) Пасивується концентрованою сульфатною кислотою;
3) Натрій; В) Активно реагує з водою за кімнатної температури;
4) Срібло. Г) За звичайних умов не взаємодіє з киснем; Д) Проявляє стійкість відносно фтору.
Наведіть варіанти відповіді розташуйте в правильній послідовності, відповідно до наведеного завдання.
14. Установіть елементи в порядку зростання їхніх металічних властивостей:
А) К; Б) Rb; В) Na; Г) Li.
15. Установіть генетичний ланцюжок добування цинку:
А) ZnCl2 ;
Б) Zn(OH)2; В) ZnO;
Г) Zn.
16. Установіть послідовність зростання металічних властивостей елементів:
А) Аргентум;
Б) Стронцій;
В) Іод;
Г) Станум.
Після проведення певних обчислень напишіть свою відповідь за допомогою цифр, починаючи з останньої клітинки. Якщо відповідь дробова, округліть її до цілого числа.
17. Обчисліть масу алюмінію (в грамах), що необхідна для добування марганцю з піролюзиту MnO2 масою 217,5 г.
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________ _______________________________________________________________ ________________________
18. Обчисліть об’єм вуглекислого газу (в м3 за н.у.), що виділяється під час виготовлення сталі із чавуну масою 3 тонни, якщо при цьому вміст
Карбону знижується від 3 до 1%.
_______________________________________________________________ _______________________________________________________________
_______________________________________________________________
_______________________________________________________________
________________________
19. Обчисліть об’єм водню (в літрах за н.у.), що виділяється при взаємодії магнію масою 60 г з надлишком хлоридної кислоти.
_______________________________________________________________
_______________________________________________________________ _______________________________________________________________ _______________________________________________________________
________________________
2.2. . Тестові завдання і задачі на тему: «Лужні елементи і Кальцій та їх сполуки»
У кожному завданні серед чотирьох наведених варіантів відповідей виберіть один правильний.
1. Позначте групу металів, до якої належать Натрій і Калій:
А) лужні метали;
Б) лужноземельні метали; В) рідкісноземельні метали;
Г) благородні метали.
2. Позначте групу металів, до якої належить Кальцій:
А) лужні метали;
Б) лужноземельні метали; В) рідкісноземельні метали;
Г) благородні метали.
3. Позначте, у вигляді якої сполуки Натрій найчастіше трапляється в побуті:
А) кухoнної солі і соди ;
Б) сплавів з інших металів;
В) крейди;
Г) мармуру.
4. Позначте назву мінералу, що містить іони Кальцію:
А) малахіт;
Б) гіпс;
В) сильвініт;
Г) кам’яна сіль.
5. Позначте метали, які добувають електролізом розплавів:
А) чорні метали;
Б) благородні метали; В) малоактивні метали;
Г) активні метали.
6. Позначте номер групи Періодичної системи, до якої входять лужні метали:
А) I;
Б) VI;
В) VII;
Г) IX.
7. Позначте число валентних електронів в електронній оболонці атома Кальцію:
А) 2;
Б) 1;
В) 4;
Г) 5.
8. Позначте властивості, що характерні для лужних металів:
А) кислотні;
Б) відновні;
В) окисні;
Г) амфотерні.
9. Позначте, яким чином добувають натрій і кальцій у промисловості:
А) в доменній печі;
Б) алюмінотермією;
В) електролізом розплавів солей;
Г) відновленням воднем.
10. Позначте, як взаємодіє кальцій з водою:
А) дуже бурхливо, із запаленням;
Б) не дуже активно;
В) повільно, з виділенням світла;
Г) не реагують.
11. Позначте формулу гашеного вапна:
А) CaO;
Б) Ca(OH)2;
В) CaCO3;
Г) Ca(HCO3)2.
12. Позначте формулу гашеного вапняку:
А) CaO;
Б) Ca(OH)2; В) CaCO3;
Г) CaSO4.
13. Позначте формулу сполуки що входить до складу гіпсу:
А) CaO;
Б) Ca(OH)2; В) CaCO3;
Г) CaSO4.
14. Позначте тип оксидів, до яких належать оксиди Натрію, Калію і Кальцію:
А) основні оксиди;
Б) кислотні оксиди;
В) амфотерні оксиди;
Г) несолетворні оксиди.
15. Позначте формулу калій гідроксиду:
А) KOH;
Б) CaO ; В) Ca(OH)2;
Г) K(OH)2.
16. Позначте сполуку, що утворюється при взаємодії літію з киснем:
А) LiO; Б) Li2O;
В) Li2O2;
Г) LiOH.
17. Позначте сполуку, що утворюється при взаємодії натрію з киснем:
А) Na2O;
Б) Na2O2;
В) NaO2;
Г) NaO3.
18. Позначте, у який колір забарвлюють полум’я йони Натрію:
А) жовтий;
Б) червоний;
В) зелений;
Г) блакитний.
19. Позначте процес, за допомогою якого добувають калій у промисловості:
А) електроліз водних розчинів його солей;
Б) електроліз розплавів його солей;
В) відновлення його оксиду коксом;
Г) відновлення його солей чадним газом.
20. Позначте властивість, характерну для лужних металів:
А) м’які;
Б) не проводять електричний струм; В) за звичайних умов аморфні речовини;
Г) вибухонебезпечні.
21. Позначте властивість, характерну для лужних металів:
А) за звичайних умов інертні;
Б) не реагують з киснем;
В) відновлюють активніші метали;
Г) реагують з водою, утворюючи луги.
22. Позначте символ хімічного елемента Кальцій:
А) K;
Б) Ka;
В) Ca;
Г) C.
23. Позначте, що має статися з атомом Кальцію, щоб утворився йон
Са :
А) він повинен віддати 2 електрони;
Б) прийняти 1 електрон;
В) віддати 3 електрони;
Г) прийняти 2 електрони.
24. Позначте формулу кальцій гідроксиду:
А) KOH;
Б) CaO; В) Ca(OH)2;
Г) K(OH)2.
25. Укажіть масову частку Кальцію в кальцій карбіді СаС2 :
А) 79%;
Б) 62,5%;
В) 75%;
Г) 40%.
26. Позначте властивість, характерну для кальцію:
А) за звичайних умов інертна речовина;
Б) на повітрі не окиснюється;
В) не реагує з мінеральними кислотами;
Г) відновлює неактивні метали з оксидів.
27. Позначте властивість, характерну для кальцій карбонату:
А) біла кристалічна речовина;
Б) проводить електричний струм;
В) надзвичайно токсичний;
Г) за звичайних умов рідка речовина.
28. Позначте електронну конфігурацію атома Кальцію:
А) 1s22s23p63s2; Б) 1s22s22p63s23p64s2; В) 1s22s22p63s23p64s1;
Г) 1s22s22p63s1.
2+ :
29. Позначте електронну конфігурацію йона Са
А) 1s22s23p63s23p64s2;
Б) 1s22s22p63s23p6; В) 1s22s22p63s23p64s1;
Г) 1s22s22p6.
Установіть відповідність між інформацією, позначеною цифрою, і варіантом відповіді, позначеним літерою.
30. Установіть відповідність між назвою лужного металу та його символом:
Назва Символ
1) Натрій; А) Li;
2) Калій; Б) Na;
3) Літій; В) K;
4) Цезій. Г) Rb; Д) Cs.
31. Установіть відповідність між реагентами і продуктами реакції:
Реагенти Продукти реакції
1) Na + Cl2; А) Na2S;
2) Na + O2; Б) Na2O2;
3) Na + H2O; В) NaOH + H2;
4) Na + S. Г) Na2O; Д) NaCl.
32. Установіть відповідність між назвою речовини та її хімічною формулою:
Назва речовини Формула
1) Кальцій; А) CaO;
2) гашене вапно; Б) Ca;
3) негашене вапно; В) CaCO3; 4) гіпс. Г) Ca(OH)2;
Д) CaSO4∙2H2O.
33. Установіть відповідність між реагентами і продуктами реакції:
Реагенти Продукти реакції
1) CA + P4; А) CaO;
2) Ca + O2; Б) Ca3P2;
3) CaO + H2O; В) CaO + Fe;
4) Fe2O3 + Ca. Г) CaH2;
Д) Ca(OH)2.
Наведені варіанти відповіді розташуйте в правильній послідовності, відповідно до наведеного завдання.
34. Установіть лужні метали в порядку зростання атомного радіуса:
А) K;
Б) Rb;
В) Na;
Г) Li.
35. Установіть символи елементів у порядку зростання їх електронегативності:
А)Cs;
Б) Na;
В) K;
Г) Li.
36. Установіть символи елементів у порядку зростання їхніх металічних властивостей:
А) Na;
Б) Rb; В) Cs;
Г) K.
37. Установіть сполуки в порядку збільшення в них масової частки
Кальцію:
А) CaCO3;
Б) CaCl2;
В) Ca(OH)2;
Г) CaO.
38. Установіть генетичний ланцюжок добування солі:
А) C;
Б) H2CO3;
В) K2CO3;
Г) CO2.
39. Установіть сполуки в порядку збільшення величини ступеня окиснення Оксигену:
А) KO3;
Б) KO2;
В) K2O;
Г) K2O2.
40. Установіть речовини в порядку збільшення в них масової частки
Кальцію:
А) CaC2;
Б) CaO; В) Ca(OH)2;
Г) CaCO3.
41. Установіть послідовність одержання речовин при здійснення такої схеми перетворень:
H
Ca → 12O →CO 22 CO→2 3 →HCl 4 .
А) Ca(OH)2;
Б) CO2; В) Ca(HCO3)2;
Г) CaCO3.
42. Установіть послідовність застосування речовин для здійснення перетворень: CaCO3 → CO2 →CO →CO2 → CaCO3.
А) O2;
Б) CaO;
В) C;
Г) HCl.
Після проведення певних обчислень напишіть свою відповідь за допомогою цифр, починаючи з останньої клітинки. Якщо відповідь дробна, округлість її до цілого числа.
43. Обчисліть об’єм водню (за н.у.), що виділиться в результаті реакції 10 г.
натрію з надлишком води.
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
44. У крейді на кожні 25 атомів Кальцію припадає 25 атомів Карбону та 75 атомів Оксигену. Складіть молекулярну формулу крейди та вкажіть у відповіді число атомів, що містяться в одній формульній одиниці.
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
45. У зразку крейди масою 156 г міститься кальцій карбонат масою 123 г. Обчисліть масову частку домішок у цьому зразку (у відсотках).
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
46. Для повної нейтралізації розчину хлоридної кислоти масою 150 г з масовою часткою кислоти 7,3%необхідний розчин натрій гідроксиду масою 200 г. Обчисліть масову частку лугу в розчині (у відсотках).
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________ ___________________________________________________________________
47. Обчисліть об’єм вуглекислого газу (в літрах за н.у.), що можна добути зі зразка технічного кальцій карбонату масою 150 г, що містить 16,7% домішок.
___________________________________________________________________
___________________________________________________________________ ___________________________________________________________________
__________________________________________________________________
48. Обчисліть об’єм вуглекислого газу (в літрах за н.у.), який можна поглинути гашеним вапном масою 5 кг, що містить 7,5 % домішок кальцій карбонату.
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________ 49. Визначити масу осаду, що утворюється при зливанні розчинів натрій хлориду й аргентум нітрату масою по 400 г, у яких масова частка розчинених речовин становить по 10% .
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
50. Обчисліть масову частку домішок (у відсотках) у технічному кальцій карбіді, якщо при повному розкладанні його зразка масою 2 кг. надлишком води утворився ацетилен об’ємом 560 л.
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
__________________________________________________________________
2.3. . Тестові завдання і задачі на тему: «Алюміній і Ферум та їх сполуки»
У кожному завданні серед чотирьох наведених варіантів відповідей виберіть один правильний.
1. Позначте властивість заліза, завдяки якому воно знаходить своє використання:
А) легший за воду;
Б) пластичне (ковке);
В) легко переходить у рідкий стан;
Г) має високу температуру плавлення.
2. Позначте процес, за допомогою якого добувають у промисловості алюміній
А) відновлення коксом;
Б) відновлення чадним газом;
В) електроліз;
Г) алюмотермія.
3. Позначте фізичну властивість, притаманну залізу:
А) добре розчиняється у воді;
Б) за звичайних умов рідка речовина; В) температура плавлення вища за 1000 С;
Г) температура кипіння нижча за 1000 С.
4. Позначте фізичну властивість, притаманну алюмінію:
А) за звичайних умов рідка речовина;
Б) температура плавлення 0 С;
В) прозора речовина;
Г) добре проводить електричний струм.
5. Позначте сполуку, в якій валентність Феруму дорівнює двом:
А) Fe2O3;
Б) Fe3O4; В) FeBr3;
Г) FeO.
6. Позначте номер періоду Періодичної системи, в якій перебуває
Ферум:
А) 8;
Б) 6;
В) 4;
Г) 3.
7. Позначте число електронів в атомі Алюмінію:
А) 3; Б) 13;
В) 27; Г) 50.
8. Позначте число електронів в атомі Феруму:
А) 2;
Б) 3;
В) 26;
Г) 56.
9. Позначте , що має статися з атомом Алюмінію, щоб утворився йон Al3+ :
А) він повинен віддати 2 електрони;
Б) прийняти 1 електрон;
В) віддати 3 електрони;
Г) прийняти 3 електрони.
10. Позначте атомну масу Алюмінію:
А) 112;
Б) 13;
В) 27;
Г) 56.
11. Позначте речовину, з якою може взаємодіяти алюміній:
А) гелій;
Б) розведена нітратна кислота;
В) вуглекислий газ;
Г) залізо.
12. Позначте, що має статися з атомом Феруму, щоб утворився йон:
А) він повинен віддати 2 електрони;
Б) прийняти 1 електрон;
В) віддати 1 електрон;
Г) прийняти 2 електрони.
13. Позначте формулу ферум (ІІІ) оксиду:
А) Fe3O4;
Б) Fe2O;
В) Fe2O3;
Г) F2O3.
14. Позначте правильне твердження щодо захисту заліза від корозії:
А) при перебуванні під водою залізо не піддається корозії; Б) для захисту від корозії необхідно припинити контакт металевої поверхні з навколишнім середовищем; В) для захисту від корозії необхідно металеві поверхні робити дзеркальними;
Г) для захисту від корозії необхідно металеві поверхні зачищати наждаковим папером.
15. Позначте атомну масу Феруму:
А) 112;
Б) 14;
В) 26;
Г) 56.
16. Позначте можливі продукти взаємодії заліза з киснем:
А) Fe + H2;
Б) FeO + H2;
В) Fe + H2O;
Г) Fe3O4 + H2O.
17. Алюміній належить до групи:
А) лужні метали;
Б) лужноземельні метали;
В) рідкісноземельні метали.
Г) метали.
Установіть відповідність між інформацією, позначеною цифрою, і варіантом відповіді, позначеним літерою.
18. Установіть відповідність між реагентами і продуктами реакції:
Реагенти Продукти реакції
1) Al + N2; А) Al2O3 + Fe;
2) Al + 3O2; Б) Al2S3;
3) Al + S; В) AlN;
4) Fe2O3 + Al. Г) Al2O3;
Д) Al(OH)3.
19. Установіть відповідність між реагентами і продуктами реакції:
Реагенти Продукти реакції
1) 2FeS +3O2; А) 2FeO + 4SO2;
2) 4FeS + 7O2; Б) 2Fe0 + 2SO2;
3) 2FeS2 + 5O2; В) 2Fe2O3 + 4SO2;
4) 4FeS2 + 11O2. Г) 2Fe2O3 + 2SO2; Д) 2Fe2O3 + 8SO2.
20. Установіть відповідність між реагентами і продуктами реакції:
Реагенти Продукти реакції
1) 2Fe + O2 ; А) 2Fe2O3;
2) 4Fe3O4 + O2; Б) 2Fe3O4;
3) 3Fe + 2O2 ; В) 6Fe2O3;
4) 4FeO + O2. Г) 2FeO;
Д) Fe3O4.
Наведені варіанти відповіді розташуйте в правильній послідовності, відповідно до наведеного завдання.
21. Установіть сполуки в порядку збільшення в них масової частки
Алюмінію:
А) Al2O3;
Б) AlCl3;
В) Al(OH)3;
Г) NaAl(OH)4.
22. Установіть сполуки в порядку збільшення в них масової частки
Феруму:
А) Fe3O4;
Б) FeF3;
В) Fe2O3;
Г) FeO.
23. Установіть послідовність застосування реагентів для здійснення перетворень:
Al → NaAl(OH)4 → AlCl3 → K3Al(OH)6 → Al2(SO4)3 .
А) HCl;
Б) KOH;
В) H2SO4;
Г) NaOH.
24. Установіть послідовність застосування реагентів для здійснення перетворень:
Fe → Fe2O3 → Fe → FeCl3 → Fe(OH)3.
А) Cl2;
Б) O2;
В) C;
Г) KOH.
25. Установіть послідовність застосування реагентів для здійснення перетворень:
Fe → FeCl2 → Fe → FeCl3 → Fe(OH)3.
А) Cl2;
Б) Zn;
В) HCl;
Г) KOH.
26. Установіть послідовність застосування реагентів для здійснення перетворень:
Fe2O3 → Fe → FeCl2 → Fe(OH)2 → Fe(OH)3.
А) KOH;
Б) O2;
В) C;
Г) HCl.
Після проведення певних обчислень напишіть свою відповідь за допомогою цифр, починаючи з останньої клітинки. Якщо відповідь дробна, округлість її до цілого числа.
27. Обчисліть об’єм алюмінію (в грамах), що необхідно взяти для добування 56 г заліза із феруму (ІІІ) оксиду.
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
28. При згорянні заліза масою 14 г було витрачено кисень масою 4 г.
Обчисліть масу продукту реакції.
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________ ___________________________________________________________________
29. Суміш солей феруму (ІІІ) сульфату і натрій сульфату масою 200г розчинили у воді й додали надлишок розчину натрій гідроксиду, в результаті чого утворився осад масою 64,2 г. Обчисліть масову частку феруму (ІІІ) сульфату у вихідній суміші (у відсотках).
__________________________________________________________________
___________________________________________________________________ ___________________________________________________________________
30. Для дослідження взяли три зразки алюмінієвої руди масою 3 г, 3,5 г і 4 г. Виявилося, що вміст алюміній оксиду в цих зразках дорівнює 0,156 г, 0,203 г і 0,192 г. Обчисліть середній вміст (у відсотках) Алюмінію в цих зразках.
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
31. Обчисліть об’єм (в літрах за н.у.) чадного газу, необхідного для відновлення ферум (ІІІ) оксиду масою 320 г.
___________________________________________________________________
___________________________________________________________________
___________________________________________________________________
32. У виробництві алюмінію з алюміній оксиду масою 2 т одержують алюміній масою 1 т. Обчисліть вихід продукту реакції від теоретично можливого (у відсотках).
__________________________________________________________________
___________________________________________________________________
___________________________________________________________________
33. Обчисліть масу алюмінію (в грамах), необхідного для відновлення заліза з ферум (ІІІ) оксиду масою 160 г.
__________________________________________________________________
___________________________________________________________________ ___________________________________________________________________ Список використаної літератури
1. Каличак Я. М., Кінжибало В. В., Котур Б. Я. та ін. Хімія. Задачі, вправи, тести: Навч. посібник. – Львів. “Світ”, 2001. -176 с.
2. Лашевська Г. А., Лашевська А.А. Хімія. 11 клас (рівень стандарту). - К:
Генеза, 2011.
3. Луцевич Д. Д. Довідник з хімії. Львів.- 2008. – 430 с.
4. Луцевич Д. Д. Типові тести з хімії. ч. 1. Загальна хімія. – Львів: ВАТ “Бібльос”, 2007. – 208 с.
5. Луцевич Д. Д., Березан О. В. Конспект-довідник з хімії. – К.: Вища шк., 1997.– 237 с.
6. Попель П. П., Крикля Л.С. Хімія. 11 клас (академічний рівень). - К: Академія, 2011
7. Хімія: Завдання і тести. Під редакцією проф. Корнілова М. Ю. – К.:
Школяр 2000.- 512 с.
8. Ярошенко О. Г. Хімія. 11 клас (рівень стандарту). - К: Грамота, 2011


про публікацію авторської розробки
Додати розробку
