Урок "Хімічні властивості металів"
Тема уроку: Хімічні властивості металів.
Навчальна мета: ознайомити учнів із загальними хімічними властивостями металі, рядом активності металів; показати взаємозв’язок між хімічними властивостями металів та будовою їхніх атомів;
Розвивальна мета – сприяти розвитку уявлень про будову речовини і залежність властивостей речовини від її природи; розвивати навички складання рівнянь окисно-відновних реакцій йонного обміну на прикладі хімічних властивостей металів.
Виховна мета – створювати передумови для вихання інтересу до знань, уміння працювати з великим об’ємом інформації
Очікувані результати: учні характеризують металічні елементи за їх місцем у Періодичній системі та будовою атома, фізичні та хімічні властивості металів складають рівняння відповідних реакцій, називають сполуки металічних елементів за сучасною українською номенклатурою, роблять висновки про зумовленість властивостей металів будовою їх атомів, дотримуються правил техніки безпеки під час виконання хімічних дослідів.
Тип уроку: засвоєння нових знань
Методи та прийоми: пояснювально-ілюстративні (розповідь, бесіда), наочні (демонстрації, лабораторний дослід), частково-пошукові, практичні(розв’язування задач і вправ)
Міжпредметні зв’язки: фізика, геологія
Форми роботи: фронтальна робота, робота з дидактичною схемою, лабораторна робота.
Обладнання: реактиви, лабораторний посуд, приладдя
Навчально-педагогічне забезпечення:
наочність: періодична таблиця хімічних елементів, таблиця розчинності, ряд активності металів.
Роздатковий матеріал: інструкції для проведення лабораторних дослідів, картки із завданнями для самостійної роботи
Демонстраційний дослід :
Демонстрація . Горіння магнію
Лабораторний дослід 1. Порівняння хімічної активності металів.
Лабораторний дослід 2. Взаємодія металів з розчинами кислот.
Використана література:
Попель П.П., Крикля Л.С. Хімія, 11 клас. – Академія, 2019
Старовойтова І. Ю., Люсай О. В. Усі уроки хімії, 10 клас. – Х.: Основа, 2010
Стеценко І.В., Овчаренко І. Ю. Усі уроки хімії, 11 клас. – Х.: Основа, 2019
Структура уроку
І. Організація класу……………………………………………………………(1хв)
ІІ. Перевірка домашнього завдання ………………………………………….(6хв)
ІІІ. Мотивування навчальної діяльності………………………………...……(2хв)
ІV. Вивчення нового матеріалу…………………………………………… .(23 хв)
V. Узагальнення й систематизація знань……………………………………(10 хв)
VІ. Підбиття підсумків уроку, оцінювання роботи учнів………………..…(2хв)
VІІ. Домашнє завдання…………………………………………………….…(1хв)
Хід уроку
І. Організація класу(1хв)
Привітання, налаштування учнів на робочий лад.
ІІ. Перевірка домашнього завдання (6 хв)
Хімічний диктант
- Найтвердіший метал – Cr
- Метал з найвищою електропровідністю – Ag
- Найважчий метал – Os
- Найм’якіший – Na
- Радіоактивний, що був відкритий першим – Ra
- Найактивніший у періодичній системі – Fr
- Найпластичніший – Au
- Найлегший – Li
- Найбільш легкоплавкий – Hg
- Метал найяскравішого червоного кольору – Cu
- «Найчорніший» метал – Fe
- Найбільш тугоплавкий – W
- Найпоширеніший у природі – Al
- Які фізичні властивості проявляють метали завдяки металевим кристалічним ґраткам?
- Чи можна стверджувати, що метали мають однакову хімічну активність? Наведіть приклади з життя.
- Чи однаково поводяться різні метали у воді?
- Чи можна стверджувати, що метали не взаємодіють з водою?
- Які метали найбільше використовує людина?
- Які фізичні й хімічні властивості цих металів сприяють їх широкому застосуванню?
ІІІ. Мотивування навчальної діяльності.(2хв)
Ми живемо у світі металів, а вірніше їх сполук . Через свою хімічну активність вони існують у зв’язаному вигляді. Зустрічаються в природі у вигляді оксидних, сульфатних, карбонатних, сульфідних руд. Щоб вивчити хімічні властивості металів, вони потрібні у чистому вигляді. Тому металургія займається виробництвом металів. Деякі їх зразки є в нашій лабораторії і сьогодні ми будемо їх досліджувати.
ІV. Вивчення нового матеріалу(23 хв)
Пояснення вчителя. Сьогодні на уроці ми маємо вивчити загальні властивості металів, для цього проведемо лабораторні досліди, опишемо їх хімічними рівняннями і ви будете моїми помічниками.
Проведення експерименту (вчительський хімічний експеримент)
1.Взаємодія натрію з водою (вчитель показує, коментує; учень на дошці записує рівняння реакції)
2Na + 2H2O =2NaOH +H2
2. У три кристалізатори з водою під витяжкою обережно занурюємо: у перший – шматочок заліза, у другий – шматочок кальцію, у третій – шматочок натрію.
Що спостерігаємо? Чому метали поводяться по-різному? (створення і розв’язання проблемної ситуації)
Висновок: метали мають різну хімічну активність.
Звертаємось до ряду активності металів М.М.Бекетова.
Порівняння хімічної активності металів
- Найбільш енергійно метали реагують з неметалами:
а) з галогенами :
Ca + Cl2 =CaCl2
2Fe + 3Cl2 = 2FeCl3
б) з сіркою:
Fe + S = FeS
2Al + 3S = Al2S3
в) з киснем:
2Mg + O2 = 2MgO
4Li + O2 = 2Li2O
|
Li, Ca, Na, Mg |
Al, Zn, Fe, Sn, Pb |
H, Cu, Hg |
Ag, Pt, Au |
|
I |
II |
III |
IV |
Метали, що знаходяться в ряду активності до Al, швидко й мимовільно окислюються киснем:
2Ca + O2 = 2CaO
Метали від Al до H окиснюються повільно або в разі нагрівання:
2Zn + O2 = 2ZnO
Метали від H до Pt окиснюються за високої температури:
2Cu + O2 = 2CuO
Такі метали, як платина й золото, не окиснюються киснем повітря.
Завдання 1. Троє учнів біля дошки записують ОВР, указують окисник і відновник:
- З водою метали також реагують неоднаково.
Метали до Al активно реагують з водою без нагрівання;
2Na + 2H2O = 2NaOH + H2
Метали до Н реагують з водою в разі нагрівання:
Zn + H2O = ZnO + H2
Метали, розташовані в ряду активності після водню, з водою не реагують.
Завдання 2. Двоє учнів біля дошки записують ОВР, указують окисник і відновник.
- Лабораторний дослід 2. Взаємодія металів з розчинами кислот
Взаємодія металів з кислотами також відбувається відповідно до їх положення в ряду активності металів.
Згадаємо закономірності взаємодії металів з кислотами.
Проведемо експеримент.
У чотири пробірки з розчином хлоридної кислоти занурюємо гранули міді, цинку, магнію й алюмінію.
Завдання 3. Запишіть рівняння ОВР, укажіть окисник і відновник.
Запишіть рівняння реакції у йонно - молекулярній формі.
Zn0 + 2H+Cl- = Zn+2Cl-2 + H20
Відновник: Zn0 – 2e- = Zn+2
Окисник: 2H+ + 2e- = H02
Zn0 + 2H+ = Zn2+ + H02
Різниця в активності дозволяє одним металам витісняти інші з розчинів їх солей.
Лабораторний дослід 1. Порівняння активності металів
У першу пробірку наливаємо розчин купрум (ІІ) хлориду й опускаємо туди гранули цинку; у другу пробірку наливаємо розчин цинк хлориду й опускаємо гранулу міді: у третю – розчин купрум (ІІ) хлориду й гранулу магнію; у четверту – розчин цинк хлориду й магній; у п’яту – розчин магній хлориду й цинк.
Що спостерігається? (Учні записують рівняння окисно-відновних реакцій, що протікають, указують окисник і відновник; записують скорочене йонне рівняння.)
Cu2+Cl2 + Zn0 = Zn+2Cl2 + Cu0
Окисник: Cu2++ 2e- = Cu0
Відновник: Zn0 – 2e- = Zn+2
Cu2+ + Zn0 = Zn2+ + Cu0
Висновок: ці метали можна розташувати в ряд за зниженням їх активності: Mg, Zn, Cu.
V. Узагальнення й систематизація знань (10хв)
- Розглянемо схему хімічних властивостей металів та її зв'язок з рядом активності, пропонуємо учням зробити узагальнюючий висновок про хімічні властивості металів:
- У реакціях метали проявляють відновні властивості.
- Активність металу можна оцінити за його положенням у ряду активності.
- Застосування металу визначається як його фізичними, так і хімічними властивостями.
- Робота в групах
Групові завдання
Скласти рівняння реакцій за схемою:
![]()
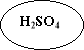

![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()


Метал
Група 1: Ca. Група 2: K.
Група 3: Zn. Група 4:Na.
Група 5: Mg. Група 6:АІ.
Групи виконують завдання та здають на перевірку вчителю.
VІ. Підбиття підсумків уроку, оцінювання роботи учнів.(2хв)
Пропоную учням зробити підсумок уроку самим.
Уважно заслуховуємо думки учнів.
Сьогодні на уроці я вивчив хімічні властивості металів; цікаво, що вони були підтверджені експериментом.
Цікаво було спостерігати за взаємодією різних по активності металів, порівнювати їх.
VІІ. Домашнє завдання (1хв)
Вивчити: Хімічні властивості металів.
Письмове завдання: скласти схеми хімічної взаємодії металів з різними хімічними речовинами та виконати їх; скласти задачу виробничого змісту на одержання чистого металу із природної сировини.
Повторити: Прості речовини неметали. Явище алотропії.
1


про публікацію авторської розробки
Додати розробку
