Молярний об’єм газів. Відносна густина газів
Конспект уроку 6.
Тема: Молярний об’єм газів. Відносна густина газів
Мета: формувати поняття «молярний об’єм газів» та «відносна густина газів», формувати вміння проводити обчислення кількості речовини газів за відомим об’ємом і навпаки та відносної густини газів.
Обладнання: роздатковий матеріал, підручник
Тип уроку: ВНМ (Д)
Форми роботи: бесіда, взаємоопитування, «Лови помилку», «Вірю – не вірю»
Хід уроку:
І. Організація класу.
ІІ. Оголошення теми і мети уроку.
ІІІ. Актуалізація опорних знань
Прийом «Лови помилку».
Обрати правильно записану формулу (дошка)
-
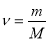 ;
; 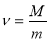 ;
; 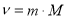
-
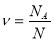 ;
; 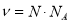 ;
;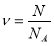
-
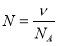 ;
; 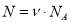 ;
; 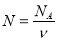
-
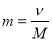 ;
; 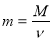 ;
; 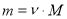
IV. Мотивація навчальної діяльності. Бесіда за питаннями
Працюючи з газоподібними речовинами, виміряти масу газу досить складно. Для газів легше виміряти об’єм.
Проблема: Як пов’язати кількість речовини і об’єм газу? (дошка)
Який об’єм займає 1 моль газу?
V. Вивчення нового матеріалу.
1) Молярний об’єм.
- Закон Авогадро.
Гази є одним із найпростіших об’єктів для досліджень. Тому А. Авогадро вивчав властивості газів. Проводячи свої дослідження відкрив закон, який отримав назву – закон Авогадро:
- в однакових об’ємах різних газів за однакових умов (температура і тиск) міститься однакова кількість молекул.
Наслідок із закона Авогадро:
- за однакових умов 1моль будь-якого газу займає однаковий об’єм.
Які ж це однакові умови?
- Дається поняття про нормальні і стандартні умови:
н.у. Т = 273К (0ºС), р = 101,325 кПа
ст.у. Т = 298К (25ºС), р = 101,325 кПа
- Речовини, що за звичайних умов гази, мають молекулярну будову. Відстані між молекулами, порівняно з їх розмірами, набагато більші і приблизно однакові для всіх газів. Якщо взяти 6,02•1023 молекул будь-якого газу за нормальних умов, то вони займуть однаковий об’єм.
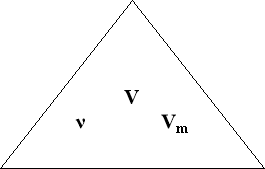
- За нормальних умов об’єм, що займає 1 моль любого газу дорівнює 22,4 л/моль – це молярний об’єм. Молярний об’єм: Vm = 22,4 л/моль.
- Дається поняття «молярний об’єм».
Молярний об’єм – це відношення об’єму речовини до кількості цієї речовини.
![]()
![]()
![]() ↔
↔ ![]() (дошка)
(дошка)
- Наводяться приклади розв’язування задач:
Обчислити кількість речовини кисню об’ємом 1,12 л.
Аналіз задачі: Що відомо? Що знайти? Як це зробити?
|
Дано: V (O2) = 1,12 л
|
Розв’язання: |
|
|
|
ν(Н2О) − ? |
Відповідь: ν(О2) = 0,05 моль |
2) Відносна густина газів
- 1 моль любого газу займає однаковий об’єм – 22,4 л/моль
- 1 моль любого газу містить однакову кількість молекул – 6,02*1023
- але 1 моль одного газу і 1моль іншого газу мають різні маси, т.я. атоми по масі відрізняються (кожен атом має свою масу)
- маса 1 моль одного газу більша за масу 1 моль іншого газу у стільки разів, у скільки більша відносна молекулярна маса одного газу за інший.
![]()
Таке відношення називається відносною густиною газів позначається D.
![]() ↔
↔ ![]()
- Наводяться приклади виразів для обчислення відносних густин різних газів.
Зазвичай густину газу визначають по відношенню до самого легкого газу водню. Позначають – DН2 = М1/М2, М2 = 2 г/моль, тоді
М1 = 2* DН2.
Часто густину газу визначають по відношенню до повітря. Повітря – це суміш газів, але найбільше в цій суміші азоту і кисню, тому враховуючи молекулярні маси цих газів розрахували середнє арифметичне, яке використовують для позначення молярної маси повітря: Мпов. = 29г/моль,
Тоді, М2 = 29* Dпов
- Наводяться приклади розв’язування задач:
1. Обчислити відносну густину вуглекислого газу за воднем.
Аналіз задачі: Що відомо? Що знайти? Як це зробити?
|
Дано: СO2
|
Розв’язання: |
|
|
|
|
Відповідь: |
VІ. Закріплення вивченого матеріалу
1. Який об’єм сульфур (ІV) оксиду масою 12,8г?
2. Якій масі відповідає карбон (ІV) оксид об’ємом 6, 72л?
3. Обчисліть масу та об’єм 12*1023 молекул водню.
4. Яка маса водню об’ємом 4,48л? Скільки молекул містить такий об’єм?
5. Обчисліть об’єм водню масою 8г. Яка кількість молекул там міститься? Якій кількості речовини це
відповідає?
6. Обчислити відносну густину карбон (IV) оксиду відносно повітря.
7. Аналіз показав, що сполука складається із 30, 43% Нітрогену і 69,57% Оксисену. Густина цієї
речовини за повітрям дорівнює 46. Визначте молекулярну масу і формулу сполуки.
Прийом «Вірю – не вірю»
- Температура за нормальних умов складає 20ºС.
- Молярний об’єм газів за нормальних умов складає 22,4 л/моль.
- Знаючи кількість речовини газу, можна обчислити його об’єм.
- 1 моль любого газу має масу 20 г.
- Відносна молекулярна маса повітря складає 29.
- Відносна густина кисню за воднем складає 32.
- Об’єм азоту кількістю речовини 2 моль складає 11,2 л.
VІІ. Підведення підсумків уроку
VІІІ. Домашнє завдання


про публікацію авторської розробки
Додати розробку
