Насичені одноатомні спирти. Ізомерія, номенклатура насичених одноатомних спиртів. Водневий зв'язок, його вплив на фізичні властивості спиртів. Хімічні властивості спиртів
Сформувати уявлення про оксигеновмісні органічні сполуки, функціональну групу; поглибити знання про взаємний вплив атомів у молекулах, про гомологію, ізомерію, генетичний зв'язок між класами сполук; вивчити будову, фізичні і хімічні властивості метанолу та етанолу, методи добування, можливості практичного застосування, фізіологічну дію спиртів.
Тема: Насичені одноатомні спирти. Ізомерія, номенклатура насичених одноатомних спиртів. Водневий зв'язок, його вплив на фізичні властивості спиртів. Хімічні властивості спиртів
Мета уроку:
Формування компетенцій: комунікативна, математична грамотності, технологічна, уміння вчитись упродовж життя.
Діяльнісна мета: Сформувати уявлення про оксигеновмісні органічні сполуки, функціональну групу; поглибити знання про взаємний вплив атомів у молекулах, про гомологію, ізомерію, генетичний зв'язок між класами сполук; вивчити будову, фізичні і хімічні властивості метанолу та етанолу, методи добування, можливості практичного застосування, фізіологічну дію спиртів.
Виховна мета: виховання в учнів зацікавленості, логічного мислення, розвитку творчих здібностей, що створює ситуацію успіху, за якої кожен відчуває свою інтелектуальну спроможність, любов до обраної професії, показати, що одна із складових успіху – вести здоровий спосіб життя.
Тип заняття – комбінований
Методи проведення: розповідь, бесіда з використанням евристичних та інтерактивних прийомів, використання дедуктивного підходу і послідовного застосування принципу унаочнення, демонстрація, розв'язування вправ , задач та тестів
Обладнання: Інтерактивна дошка, мультимедійний проектор, підручники.
Унаочнення: періодична система елементів, таблиця «Гомологічний ряд спиртів», опорний конспект, роздатковий матеріал, набір реактивів, кулестержневі моделі.
Епіграф уроку: «Знання можуть бути купою каміння, що задавило особистість. І знання можуть бути вершиною піраміди, на якій стоїть особистість» Валентин Розов
Хід уроку
І. Організаційна частина
Привітання, виявлення відсутніх. Перевірка готовності учнів до уроку, налаштування на позитивний настрій.
Хімія знаходить справжній ключ до істинної природи найважливіших тіл тільки при дослідженні органічних сполук.
Тому сьогодні ми продовжимо вивчення органічних сполук, відкриваючи нові грані хімічної науки.
Отже, давайте зосередимося, побажаємо один одному натхнення в роботі і почнемо наше заняття.
ІІ. Актуалізація опорних знань. Перевірка домашнього завдання
Задача. Вивести молекулярну формулу органічної сполуки, що містить 52,17% Карбону, 13,04% Гідрогену і 34,78% Оксисену (Відповідь (С2Н6О).
Здійснити перетворення і назвати сполуки:
СaC2 ![]() C2H2
C2H2 ![]() C2H4
C2H4 ![]() C2H5Cl
C2H5Cl ![]() C4H10
C4H10 ![]() C2H4
C2H4![]() C2H5OH.
C2H5OH.
Виконання вправ (завдання 3-ом учням на карточках різного ступеня складності). Учням пропонуються картки трьох кольорів (різного ступеня складності); вони самі визначають посильне їм завдання.
Завдання 1. (синя картка − середній рівень навчальних досягнень).
- Установіть відповідність між назвою вуглеводню та його формулою:
Бутан а) С3Н4
Етен б) С4Н10
Бензен в) С2Н4
Пропін г) С6Н6
- Згорів ацетилен кількістю речовини 4 моль. Обчисліть об’єм вуглекислого газу, що виділився.
-
Напишіть скорочену структурну формулу речовини за її назвою:
3,5 – діетилоктан.
Завдання 2. (зелена картка – достатній рівень навчальних досягнень).
1. Закінчити рівняння реакцій: а) C2H4 + О2![]()
б) С4 Н10 + Cl 2![]()
в) C2H4 + HCl ![]()
2. За загальною формулою алканів складіть формули сполук, що містять 3 та 8 атомів Карбону.
3. Бензен масою 15,6 г піддали нітруванню. Яка маса утвореного продукту? Назвіть речовину, що утворилася.
Завдання 3. (червона картка – високий рівень навчальних досягнень).
- Напишіть рівняння реакцій, що відповідають схемі:
C ![]() CH4
CH4 ![]() CH3Cl
CH3Cl ![]() C2H6
C2H6 ![]() C2H4
C2H4
- Напишіть скорочені структурні формули речовин за їх назвами:
3,5–диметилоктен-2; 3,4 – діетил-3,5- диметилгептин – 1.
- У двох пробірках під шифрами є гексан і бензен. Як розпізнати ці речовини? Напишіть відповідні рівняння реакцій.
Хімічна розминка («мікрофон»)
Під час хімічної розминки решта студентів, що не задіяні у виконанні вищенаведених завдань, задають один одному питання по темах «Насичені вуглеводні» і «Ненасичені вуглеводні».
ІІІ. Мотивація навчальної діяльності
До сьогоднішнього дня ми вивчали сполуки, що складалися із Карбону і Гідрогену. Із виконаних завдань видно, що до складу органічних речовин може входити і Оксиген.
Сьогодні ми розпочнемо вивчення сполук, що за складом, будовою і властивостями відрізняються від раніше вивчених речовин.
Які це речовини? Відповідь ми одержимо, розв’язавши кросворд.
|
|
|
|
|
|
① |
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
|
|
|
|
|
④ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
|
|
|
|
|
|
⑥ |
|
|
|
|
|
|
|
|
|
|
1. Символ хімічного елементу, що становить основу органічних сполук.
2. Назва насиченого вуглеводню, що містить 3 атоми карбону.
3. Атом або група атомів, що мають неспарені електрони.
4. Сполуки, що мають однакову молекулярну формулу, але різну хімічну будову і різні властивості.
5. Вчений, який сформулював основні положення теорії хімічної будови органічних сполук.
6. Органічна сполука, яку вперше було одержано в лабораторних умовах.
Відповідь -СПИРТИ
Хімію можна назвати наукою про якісні зміни тіл, що відбуваються під впливом зміни кількісного складу. Сьогодні на занятті ми розглянемо як впливає на властивості речовини наявність ще одного елемента – Оксигену.
Отже, тема заняття «Одноатомні насичені спирти».
Насичені одноатомні спирти знаходять широке застосування в народному господарстві, їх використання як моторного палива зменшує забруднення атмосфери; але необхідно пам’ятати, що метанол і етанол згубно впливають на організм людини.
Мета. Сформувати в учнів уявлення про оксигеновмісні органічні сполуки, дати визначення спиртам та їх функціональній групі, удосконалити вміння складати структурні та електронні формули органічних речовин. Поглибити знання про взаємний вплив атомів у молекулах, про гомологію, ізомерію, генетичний зв'язок між класами сполук. Вивчити будову, фізичні і хімічні властивості спиртів, методи добування, можливості практичного застосування, фізіологічну дію спиртів на прикладі етанолу та метанолу.
IV. Вивчення нового матеріалу.
Поняття про оксигеновмісні органічні речовини
Як ми вже побачили раніше, до складу органічних речовин може входити не тільки Карбон і Гідроген, а й атоми інших елементів, зокрема, Оксиген. Різних органічних оксигеновмісних сполук існує величезна кількість – набагато більше, ніж вуглеводнів.
Одним з найпростіших класів органічних оксигеновмісних сполук є спирти. Саме з цього класу розпочнемо вивчення гетероелементних органічних речовин.
Історична довідка. Термін «спирти» виник в часи алхімії і застосовувався у відношенні до всіх летких речовин, які перетворювалися в «дух» (від лат. «spiritus» - дух).
Будова спиртів, взаємний вплив атомів у молекулах спиртів, поняття про функціональну групу (Обговорення проблеми з учнями)
Бесіда
- Що ви знаєте про спирти?
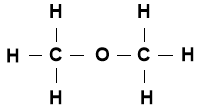
- Враховуючи основні положення теорії хімічної будови органічних речовин О. Бутлерова, спробуйте написати структурну формулу сполуки С2Н6О, що була виведена в задачі.
Варіанти можливих записів:
|
а) структурні формули |
|
|
|
|
|
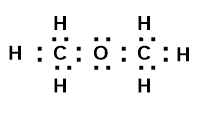
б) електронні формули |
|
|
|
|
|
Формула І |
Формула ІІ |
Аналіз: в формулі І всі атоми Н рівнозначні, зв’язані σ- зв’язком з атомами Карбону , в формулі ІІ – один атом Гідрогену сполучений з атомом Карбону через атом Оксигену, тобто знаходиться в особливому положенні.
Яка ж із наведених формул відповідає спирту?
Для цього проведемо такий дослід і зробимо відповідні розрахунки.
Дослід. До етилового спирту масою 4,6 г спирту додаємо металічний натрій. Виміряємо об’єм водню, що виділився - 1,12 л.
Такі дані показують, що провзаємодіяло 4,6г : 46 г/моль=0,1 моль спирту і виділилося 1,12л : 22,4 л/моль = 0,5 моль водню.
Висновок: з кожної молекули спирту натрій витісняє один атом Гідрогену тобто ½ молекули водню, а це відповідає реакції, рівняння якої можна представити таким чином:
С2Н6О + Na ![]() C2H5ONa + 1/2 Н2
C2H5ONa + 1/2 Н2
Результати кількісного досліду узгоджуються із формулою ІІ.
Історична довідка. Елементний склад етилового спирту встановив французький хімік А. Лавуазьє , а молекулярну формулу С2Н6О визначив у 1833 році шведський хімік Й. Берцеліус, він же запропонував усі подібні сполуки називати алкоголями.
Проблема: Як впливатиме атом Оксигену на властивості атомів Гідрогену в молекулі спирту?
Розгляньте уважно формули етану, спирту – етанолу і води:
С2Н6 C2H5OH H2O
Порівняйте спирт за радикалом з етаном, за групою ‒ОН ‒ з водою.
В ході обговорення встановлюємо, що в етані атоми Гідрогену не заміщуються натрієм, а в спирті заміщуються.
Висновок. Причиною цього явища є те, що один з атомів Гідрогену зв'язаний з радикалом через Оксиген.
Як впливає радикал на гідроксильну групу?
Порівнюємо здатність до заміщення атомів Гідрогену у воді і спирті.
Дослід. Додаємо до склянки з водою і до склянки з спиртом по шматочку висушеного фільтрувальним папером натрію. Натрій активніше взаємодіє з водою.
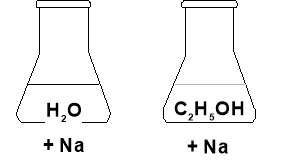
2Na + 2H2O→2NaOH + H2↑
2C2H5OH + 2Na → 2C2H5ONa +H2↑
Висновок: Атоми Гідрогену у воді більш рухливі, ніж у спирті.
Чим пояснюється причина цього явища?
В обох випадках у гідроксильній групі спільні електронні пари зміщені до атома Оксигену.
Вуглеводневі радикали мають властивість злегка відштовхувати від себе електрони, тому зміщення електронної густини завдяки радикалам веде до зменшення полярності зв'язку О─Н порівняно з водою, до зменшення рухливості атома Гідрогену гідроксильної групи у молекулі спирту.
Отже, радикал ─С2Н5 впливає на гідроксильну групу.
Аналізуючи й порівнюючи проведену реакцію з натрієм з властивостями етану, який не вступає в таку реакцію, пов'язуємо відмінність їх з наявністю в спирті реакційно здатної частини молекули − групи ─ОН.
Такі групи атомів, що зумовлюють характерні властивості речовин, називаються функціональними. Отже, група ─ОН − функціональна група спиртів.
Часто формула цього спирту записується так: CH3 ─ CH2 ─OH або
C2H5─OH. Такий запис означає, що в молекулі спирту міститься гідроксильна група ─ОН, з'єднана з вуглеводневим радикалом.
Загальну формулу для насичених одноатомних спиртів можна записати так:
CnH2n+1 ─OH або R ─OH.
Про просторове розташування атомів у молекулі спирту дають уявлення моделі
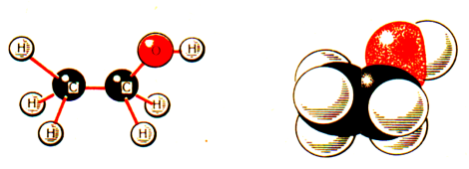
Проаналізуйте ще раз склад спиртів і спробуйте дати визначення спиртам.
Спирти — це похідні вуглеводнів, у яких один або декілька атомів Гідрогену заміщується гідроксильною групою ─OH.
Гомологічний ряд спиртів, ізомерія, номенклатура (робота в групах).
Учні об'єднуються в три початкові групи.
Кожна група одержує своє завдання: І група – прочитати у підручнику про гомологічний ряд насичених одноатомних спиртів, ІІ група – про ізомерію насичених одноатомних спиртів, ІІІ група – про номенклатуру насичених одноатомних спиртів.
Учні об'єднуються в експертні групи так, щоб до кожної групи ввійшли учні різних початкових груп. Експертна група аналізує рівень засвоєння вивченого матеріалу у початкових групах.
Один із учнів кожної початкової групи ділиться засвоєними знаннями. Основні положення вивченого матеріалу записуються в зошити.
Насиченими одноатомними спиртами називаються органічні речовини, в молекулах яких гідроксильна група ─ОН сполучена з вуглеводневим радикалом.
Гомологічний ряд насичених одноатомних спиртів
|
Традиційна назва |
Назва за UPAC |
Формула |
Температура кипіння, |
|
Метиловий |
Метанол |
СН3ОН |
64,7 |
|
Етиловий |
Етанол |
С2Н5ОН |
78,3 |
|
Пропіловий |
Пропанол-1 |
С3Н7ОН |
93,2 |
|
Бутиловий |
Бутанол-1 |
С4Н9ОН |
117,7 |
|
Аміловий |
Пентанол-1 |
С5Н11ОН |
137,8 |
|
Гексиловий |
Гексанол-1 |
С6Н13ОН |
157,2 |
|
Гептиловий |
Гептанол-1 |
С7Н15ОН |
176,3 |
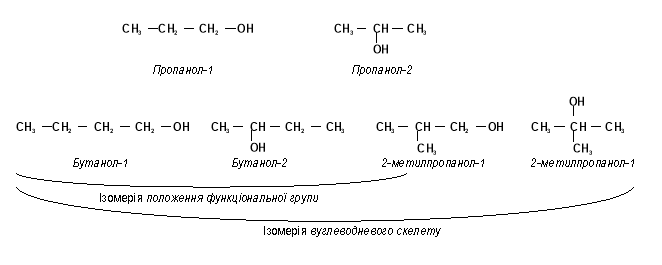
ВИДИ ІЗОМЕРІЇ
- Ізомерія вуглеводневого скелету (для спиртів, що містять чотири і більше атомів С)
- Ізомерія положення функціональної групи
- Міжгрупова ізомерія
Правила номенклатури
- Вибирають за основу найдовший вуглеводневий ланцюг, що містить атом С, сполучений з –ОН групою
- Нумерують атоми С, починаючи з того кінця, де ближче розташована функціональна група
- Перед назвою спирту зазначають місце радикалів та їх називають в алфавітному порядку
- Називають спирт, вказуючи місце розташування функціональної групи цифрою в кінці назви
Етап ІV. Закріплення і корегування знань.
Учням пропонується закріпити вивчений матеріал на прикладах (інтерактивний метод «Два, чотири, разом всі»).
Завдання на карточках для кожної з початкових груп (робота в парах):
Назвати сполуки за їх формулами
1 А
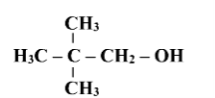
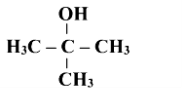
1 В
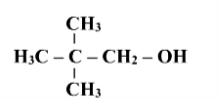
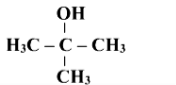
1 С
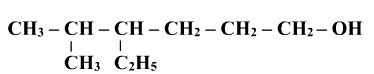
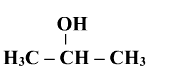
Після перевірки виконання завдання в контрпарах проводимо звірку отриманих результатів за допомогою інтерактивної дошки.
Працюємо разом.
- За наведеною формулою назвати сполуку:
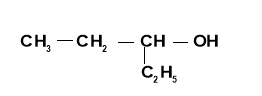
- Визначити, чи є серед сполук, запропонованих у завданнях, гомологи і ізомери.
Фізичні властивості спиртів, водневий зв'язок
У гомологічному ряду спиртів немає газоподібних речовин на відміну від насичених і ненасичених вуглеводнів. Перші члени гомологічного ряду – це рідини з специфічним запахом; спирти, що містять від 15 до 20 атомів Карбону – мазеподібні речовини; вищі – тверді речовини без запаху.
Пояснити відсутність газів серед спиртів можна будовою функціональної групи.
Зв'язки O─H та С─O — полярні ковалентні. Це випливає з відмінностей в електронегативності Оксигену (3,5), Гідрогену (2,1) і Карбону(2,4). Гідроксильний атом Гідрогену внаслідок зсуву електронної густини зв’язку O─H до атома Оксигену має частковий позитивний заряд, а атом Оксигену − частковий негативний заряд, який підсилюється зсувом електронної густини від вуглеводневого радикалу:
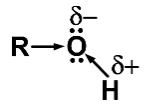
Між атомами Гідрогену і Оксигену різних молекул спирту встановлюється електростатична взаємодія. Крім того, атом Оксигену має ще вільні електронні пари, за рахунок яких утворюється донорно-акцепторний зв'язок з атомом Гідрогену. Така взаємодія називається водневим зв’язком. У формулах його позначають трьома крапками.
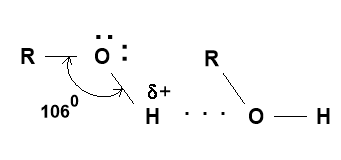
Водневий зв'язок - це особливий вид зв’язку, його довжина більша за звичайний зв'язок O─H, а міцність його значно менша.
Будова молекули води і спирту аналогічна, тому водневі зв’язки можуть утворюватися і між молекулами спиртів і води.
Утворенням водневих зв’язків з молекулами води пояснюється і розчинність спиртів.

Молекули спиртів складаються ніби з двох частин – розчинної у воді (гідрофільної), що містить гідроксильну групу і нерозчинної (гідрофобної), що складається з вуглеводневого радикалу. Якщо вуглеводневий радикал невеликий, то водневі зв’язки гідроксильної групи з молекулами води здатні утримувати молекулу спирту в розчині. Якщо ж молекула спирту має довгий вуглеводневий ланцюг, що перешкоджає розчиненню, то гідроксильна група не в змозі здійснити розчинення речовини.
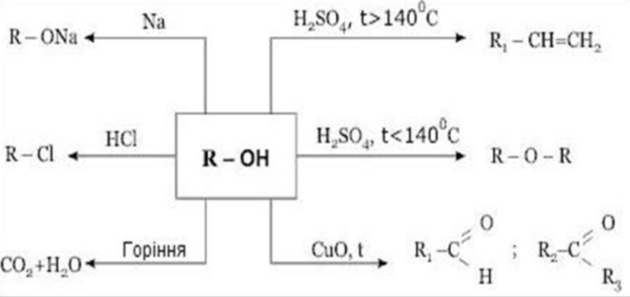
Хімічні властивості спиртів
Учням пропонується опорна схема, опираючись на яку розглядаються хімічні властивості насичених одноатомних спиртів.
Опорна схема
“Хімічні властивості насичених одноатомних спиртів”
2 С2Н5ОН + 2Na → 2 С2Н5ONa + H2↑ Етилат натрію
Дослід. а) Невеликий шматочок металічного натрію, висушеного фільтрувальним папером, вкидаємо в пробірку з етанолом. Спостерігаємо виділення газу. Який це газ? Перевіримо.
Підносимо до отвору пробірки палаючу скіпку: лунає характерний хлопок.
Як розривається σ-зв'язок O─H у цій реакції?
Які властивості спиртів (основні чи кислотні) виявляються в реакції з металічним натрієм?
б) Після завершення реакції до частини розчину додаємо води і кілька крапель розчину фенолфталеїну.
Чи змінюється забарвлення індикатора? Чому?
в) Кілька крапель розчину переносимо скляною паличкою на скляну пластинку і обережно нагріваємо її, утворюється білий твердий етилат натрію.
- Взаємодія спиртів з галогеноводнями
![]() На відміну від попередньої хімічної властивості, при взаємодії спиртів з галогеноводнями в процесі бере участь ОН─ група повністю:
На відміну від попередньої хімічної властивості, при взаємодії спиртів з галогеноводнями в процесі бере участь ОН─ група повністю:
C2H6 Наl → C2H5Hal + H2O
Бромоводень, необхідний для реакції взаємодії спиртів з галогеноводнями, утворюється в реакційній колбі при взаємодії броміду лужного металу і сульфатної кислоти. Процес одержання брометану оборотний:
NaBr + H2SO4 → NaHSO4 + HBr
C2H5OH + HBr → C2H5Br + H2O
Щоб зсунути рівновагу в бік утворення брометану, його видаляють з реакційного середовища. Тут враховується, що брометан — летка, важка (густина 1,46 г/мл) рідина, яка погано розчиняється у воді і легко закипає (tкип =38 0C).
- Дегідратація (відщеплення води)
Процес дегідратації може відбуватися двома різними шляхами за участі однієї молекули спирту і двох молекул спирту.
а) Внутрішньомолекулярна дегідратація
Під дією водовіднімаючого засобу (найчастіше для цього застосовується концентрована сульфатна кислота) від молекули спирту відщеплюється молекула води: гідроксильна група й атом Гідрогену від сусіднього атома Карбону. При цьому відсутні валентності двох сусідніх атомів Карбону насичуються за рахунок утворення додаткового зв'язку: у процесі внутрішньомолекулярної дегідратації спиртів утворюються ненасичені вуглеводні.
При складанні рівнянь внутрішньомолекулярної дегідратації необхідно враховувати, що поряд з гідроксильною групою відщеплюється атом Гідрогену саме сусіднього атома Карбону. Рівняння реакції має такий вигляд:
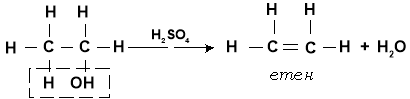
Реакція дегідратації є оборотною реакцією. Здійснюючи її в зворотному напрямку, тобто приєднуючи воду до ненасичених вуглеводнів, одержують спирти.
б) Міжмолекулярна дегідратація
При надлишку етанолу і слабкому нагріванні реакція дегідратації може протікати за участі двох молекул — міжмолекулярна дегідратація. При цьому утворюються етери:
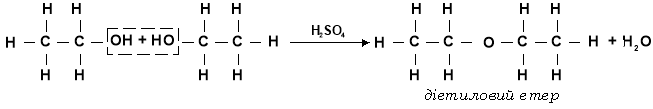
Завдання. Скласти рівняння реакцій, що відбуватимуться при молекулярній дегідратації суміші метилового й етилового спиртів.
При величезній кількості молекул спиртів у реакційній посудині будуть зіштовхуватися і реагуватимуть не тільки молекули різних спиртів, але й однакові молекули. Тому поряд з метилетиловим етером в цьому випадку утворюються диметиловий і діетиловий етери.
4. Реакція горіння (повного окиснення)
Дослід. «Горіння носовичка». Носовичок, попередньо намочений у воді, змочуємо спиртом, закріплюємо в тигельні щипці та підпалюємо. Після проведення досліду носовичок залишається сухим і непошкодженим.
C2H5-OH+3О2→ 2СО2↑+3Н2О
Загоряння спирту може відбуватися і під дією сильних окисників
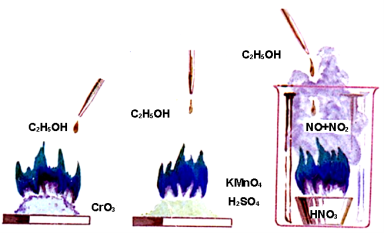
- Неповне окиснення спиртів.
Дослід. Взаємодія спирту з оксидом Купруму(ІІ). Мідний дріт прожарюємо в полум’ї спиртівки. Коли він покриється мідною окалиною, дріт опускаємо в пробірку з розчином етанолу. Відчувається запах (утворюється оцтовий альдегід). Мідний дріт знову блищить − оксид Купруму відновився до міді.
2Cu+O2→2CuO
CuO+C2H5OH→CH3CHO+Cu
В кінці робимо висновок про хімічну активність одноатомних насичених спиртів.
Добування спиртів
Колективна робота. Викладач пояснює учням загальні методи одержання спиртів, записуючи основні принципи у вигляді схеми
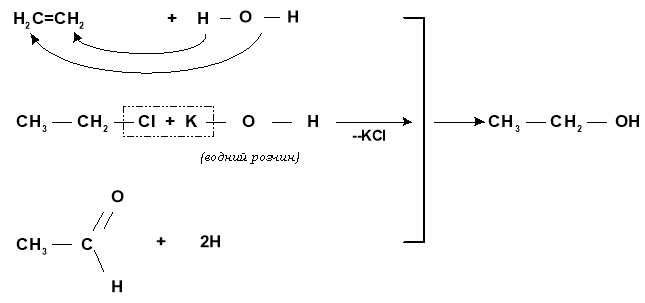
Специфічні методи добування етанолу і метанолу:
добування метанолу:
а) із синтез-газу
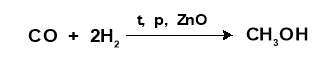
б) суха перегонка деревини (деревний спирт)
добування етанолу:
бродіння цукристих речовин
Застосування спиртів(опорна схема)
Учням пропонується на основі схеми самостійно розповісти про застосування спиртів (Вчитель контролює і доповнює).
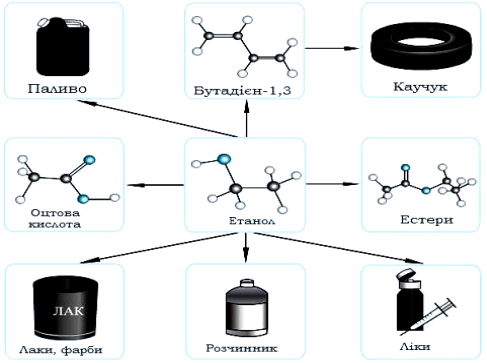
Зі спиртів R─OH одержують сполуки багатьох інших класів: алкілгалогеніди R─Hal, алкени R'─CH = CH2, етери ROR', естери R'COOR, альдегіди R'CHO, карбонові кислоти R'COOH та ін. Спирти використовують як розчинники в процесах синтезу нових сполук, виробництві лаків і фарб, фармацевтичних препаратів, запашних речовин, парфумерно-косметичної продукції. Етанол використовують як дезинфікуючий засіб, пальне у двигунах. Його використовують для виготовлення алкогольних напоїв.
Випереджальне завдання. «Вплив спиртів на організм людини»
Учням заздалегідь пропонується підготувати повідомлення про вплив спиртів на організм людини.
У результаті вживання алкоголю в організмі людини відбуваються значні порушення в обмінних процесах: змінюється окисно-відновний потенціал клітин, посилюється накопичення молочної кислоти, прискорюється перетворення глюкози на жир тощо. У крові алкоголь спричиняє розширення периферійних судин. Порушується терморегуляція, в печінці етанол окиснюється, утворюючи оцтовий альдегід, який у процесі окиснення утворює оцтову кислоту, що руйнує цей орган. У мозку сп'янілої людини відбувається закупорка судин, значна кількість дрібних крововиливів, у результаті чого клітини мозку не одержують кисню і гинуть.
Наприклад: при вживанні 100 г пива гине близько 3 тисяч клітин мозку, 100 г вина — 5 тисяч, 100 г горілки — 7,5 тисяч клітин. У людини, яка п'є роками, гинуть мільйони клітин, що не відновлюються.
Алкоголізм як захворювання формується поступово, цілком непомітно для людини. Необхідно знати, що підліток у разі вживання спиртних напоїв упродовж року стає алкоголіком. Алкоголізм спричиняє безліч захворювань організму, уражає нервову, серцево-судинну, травну системи. Зловживання алкоголем скорочує середню тривалість життя людини на 15-20 років. За концентрації алкоголю в крові ![]() 0,5 – 0,6 ‰ (проміле) у підлітка може настати смерть.
0,5 – 0,6 ‰ (проміле) у підлітка може настати смерть.
V. Підведення підсумків, закріплення матеріалу
Існує такий вислів: «Скажи мені – і я забуду, покажи мені – і я запам’ятаю, дай мені діяти самостійно – і я навчуся».
Тому давайте закріпимо вивчений матеріал, розв’язуючи електронні тестові завдання.
Тестові питання по темі «Одноатомні насичені одноатомні спирти»
1. Вкажіть функціональну групу спиртів: a. -СООН; b. -СНО; c. -ОН.
2. Насичені одноатомні спирти являються похідними:
a. насичених вуглеводнів; b. ненасичених вуглеводнів; c. ароматичних вуглеводнів.
3. Як змінюється розчинність спиртів у воді із збільшенням їх молекулярної маси? a. зменшується; b. Збільшується; c. не змінюється.
4. Визначте продукт внутрішньомолекулярної дегідратації спиртів
a. діетиловий етер; b. етилметиловий етер; c. етилен.
5. Вкажіть речовину, для добування якої використовується синтез-газ
a. фенол; b. Метанол; c. оцтова кислота.
6. Вкажіть причину того, що серед спиртів немає газів
a. утворення іонного зв'язку; b. наявність вуглеводневого радикалу;
c. утворення водневого зв'язку.
7. Визначте найрухливіший атом Гідрогену у молекулі спирту
a. після першого атома Карбону; b. після другого атома Карбону;
c. гідроксильної групи.
8. Вкажіть суфікс, яким за номенклатурою IUPAC позначається наявність спиртової групи:
a. ‒ол; b. ‒ін; c. ‒аль.
9. Гомологом пропанолу-2 являється:
a. Пропаном – 1; b. Бутанол – 2; c. Пентанол – 3.
10. Які властивості спиртів виявляються в реакції з металічним натрієм?
а. кислотні; b. основні; c. амфотерні.
Самостійна робота − тести із взаємоперевіркою виконаного завдання.
VІ. Рефлексія
- Що ми вивчили сьогодні на занятті?
- Сформували уявлення про оксигеновмісні органічні сполуки, функціональну групу.
- В чому значимість вивченої теми для вас?
VІІ. Домашнє завдання
1


про публікацію авторської розробки
Додати розробку