Науково-дослідницький проект МАН
1
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Департамент освіти і науки Дніпропетровської облдержадміністрації
Дніпропетровське відділення Малої академії наук України
Відділення: екології та аграрних наук
Секція: ветеринарія та зоотехнія
ДОСЛІДЖЕННЯ МУТАЦІЙНИХ ЯВИЩ В ОРГАНІЗМІ КУРЧА БІОХІМІЧНИМ ТА ЦИТОГЕНЕТИЧНИМ МЕТОДАМИ
|
|
Роботу виконала: Горіла Ольга Сергіївна, учениця 10 класу Професійно-технічного училища №2 м. Дніпро |
|
|
|
|
|
Науковий керівник: Сінкевич Валентина Вільгельмівна викладач фізики та екології |
|
|
|
|
|
Науковий консультант: Горова Алла Іванівна Доктор біологічних наук, Професор кафедри хімії НТУ «Дніпровська політехніка», дійсний член Української екологічної академії наук |
Дніпро - 2019
Відділення екології та аграрних наук
Секція ветеринарії та зоотехнії
ДОСЛІДЖЕННЯ МУТАЦІЙНИХ ЯВИЩ В ОРГАНІЗМІ КУРЧА БІОХІМІЧНИМ ТА ЦИТОГЕНЕТИЧНИМ МЕТОДАМИ
Горіла Ольга Сергіївна
Професійно-технічне училище №2 м.Дніпро, 10 клас (ІІ курс)
Науковий керівник: Сінкевич Валентина Вільгельмівна
викладач фізики та екології Професійно-технічного училища №2 м.Дніпро
Науковий консультант: Горова Алла Іванівна
доктор біологічних наук, професор кафедри хімії НТУ «Дніпровська політехніка», дійсний член Української екологічної академії наук
Тези
Здоров'я як майбутніх поколінь людей, так і тварин, птахів значною мірою залежить від того, яке генетичне навантаження було отримане в процесі їхнього життя та розвитку, яка кількість мутацій взагалі накопичена людством. Відомо, що мутагени навколишнього середовища значно впливають на величини рекомбінацій спадкових молекул, які є джерелом спадкових змін. Тому своєчасне виявлення в період життєздатності будь-якого організму розвитку мутаційних реакцій, внаслідок яких виникають серйозні функціональні порушення, виявляється безумовно актуальним.
Мета: провести дослідження клінічного та гемологічного стану організму курча виду «Крос Ломан Браун» та на їх основі проаналізувати причини мутагенних змін функціональних показників у порівнянні з референтною нормою.
В результаті досліджень було встановлено, що кількість формених елементів (еритроцити та лейкоцити), гемоглобін, лейкограма суттєво не відрізняються від референтної норми.
Комплексне біохімічне дослідження крові показало, що у дослідного курча має місце хронічне ураження печінки, захворювання нирок, сечового міхура, інфекційну хронічну патологію, руйнування функціональних клітин внаслідок онкологічного або запального процесу. Вочевидь, такі порушення призвели до виникнення у курчати мутації кінцівок.
Результати оцінки цитогенетичного стану курча з мутацією вказують на рівень ушкодженості клітин слизової оболонки ротової порожнин «вище за середній» та критичний цитогенетичний стан всього організму.
Отже, за допомогою цитогенетичного методу біотестування можна швидко оцінити сумарну дію всієї сукупності забруднювачів біосфери, спрогнозувати очікувані зміни в екосистемах та своєчасно прийняти управлінські рішення щодо покращення стану довкілля. Ці методи сприяють вирішенню проблеми екологічного нормування за цитогенетичними показниками біоіндикаторів, а також дозволяють оцінити екологічний і генетичний ризики для біоти.
ЗМІСТ
|
|
|
|
Стор. |
||
|
ВСТУП |
4 |
||||
|
|
РОЗДІЛ 1. ТЕОРЕТИЧНА ЧАСТИНА |
5 |
|||
|
|
|
1.1. Історія вивчення мутацій |
5 |
||
|
|
|
1.2. Класифікація мутацій |
6 |
||
|
|
|
1.2.1. Генні мутації |
7 |
||
|
|
|
1.2.2. Хромосомні мутації |
7 |
||
|
|
|
1.2.3. Геномні мутації |
8 |
||
|
|
|
1.2.4. Соматичні мутації |
9 |
||
|
|
|
1.3. Різновиди мутагенів та їх характеристика |
9 |
||
|
|
|
|
1.3.1. Фізичні мутагени |
10 |
|
|
|
|
|
1.3.2. Хімічні мутагени |
11 |
|
|
|
|
|
1.3.3. Біологічні мутагени . |
11 |
|
|
|
|
|
1.3.4. Антимутагени |
12 |
|
|
|
1.4. Особливості мітозу як способу репродукції клітин |
12 |
|||
|
|
1.5. Характеристика виду птиці «Крос Ломан Браун» |
14 |
|||
|
|
1.6. Важливість клінічного методу дослідження стану клітин для живих організмів |
15
|
|||
|
|
|
1.6.1. Метод мікроядерного тесту |
17 |
||
|
|
РОЗДІЛ 2. ПРАКТИЧНА ЧАСТИНА |
19 |
|||
|
|
|
2.1. Об’єкт та місце дослідження |
19 |
||
|
|
|
2.1.1. Умови середовища проживання курча |
19 |
||
|
|
|
|
2.1.2. Раціон та продукти годування |
20 |
|
|
|
|
2.2. Лабораторні та клінічні дослідження стану птиці |
20 |
||
|
ВИСНОВКИ |
25 |
||||
|
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ |
27 |
||||
|
ДОДАТКИ |
30 |
||||
ВСТУП
Здоров'я майбутніх поколінь людей значною мірою залежить від того, який генетичний вантаж отриманий в спадок від попередніх, яка кількість мутацій накопичено людством. На даний момент відомо близько 2 тисяч генетичних дефектів[1], при цьому приблизно чверть загального обсягу мутацій обумовлена природним фоном радіації. Відомо, що мутагени навколишнього середовища значно впливають на величини рекомбінацій спадкових молекул, які є джерелом спадкових змін[1]. Тому своєчасне виявлення в період життєздатності будь-якого організму розвитку мутаційних реакцій, внаслідок яких виникають серйозні функціональні порушення, виявляється безумовно актуальним.
Мета: провести дослідження клінічного та гемологічного стану організму курча виду «Крос Ломан Браун» та на їх основі проаналізувати причини мутагенних змін функціональних показників у порівнянні з референтною нормою.
Об’єкт дослідження: мутагенні явища в організмі птиці та наслідки їх прояви.
Предмет дослідження: фактори зміни гемологічного та клінічного стану курча виду «Крос Ломан Браун», які призвели до мутації його кінцівок.
Основні задачі дослідження:
- провести аналіз наукових літературних джерел;
- розкрити суть проблеми та причини мутацій, їх негативний вплив на життєдіяльність живих організмів;
- виявити причини мутацій кінцівок курчати виду «Крос Ломан Браун» за допомогою біохімічних та клінічних методів досліджень;
- запропонувати практичні рекомендації, спрямовані на зниження впливу мутагенів на живі організми.
Практичне значення: отримати інформацію і сформувати рекомендації щодо зниження впливу мутагенів на живі організми.
Перспектива подальшого впровадження: матеріали проекту використовуватимуться під час вивчення теми «Мутації» з предмету «Біологія та екологія».
РОЗДІЛ 1
ТЕОРЕТИЧНА ЧАСТИНА
1.1. Історія вивчення мутацій
Теорія про мутації зародилася незабаром після відкриття законів Г. Менделя. Перші уявлення про стрибкоподібні зміни спадкових властивостей виявив російський ботанік С.І.Коржинський (1899р.), але набагато ґрунтовніше мутаційна теорія була викладена в працях Гуго Де Фріза (1901-1903р.р.), присвятивши більшу частину життя вивченню проблеми мутаційної мінливості рослин. Згідно з теорією, мутації що виникають спонтанно, успадковуються, трапляються рідко і можуть бути корисним, нейтральними або шкідливими; одні й ті ж самі мутації можуть виникати неодноразово[2].
В 1927 році Г.Меллер повідомив про дію рентгенівських променів на мутаційний процес у дрозофіли, до цього часу вважалось, що мутаційний процес не залежить від навколишнього середовища[2]. Майже одночасно Л.Стадлер (1928р.) описав вплив рентгенівських променів на мутаційний процес у ячменю. У тому ж році М.Н.Мейсель одержав мутації у дріжджів під дією хімічної сполуки (хлороформу). В 30-х роках спочатку В.В.Сахаров, а потім М.Є.Лобашов і Ф.А.Смирнов[2] відкрили хімічний мутагенез у дрозофіли (впливали йодом, оцтовою кислотою, аміаком). З тих часів в арсенал мутагенних факторів увійшли різноманітні хімічні сполуки.
Подальші дослідження показали, що здатність до мутацій є універсальною властивістю всіх живих істот. На сьогодні відомі мутації у всіх класів тварин, рослин і вірусів. Існує багато мутацій і у людини. Саме мутаціями зумовлений поліморфізм людських популяцій: різна пігментація шкіри, волосся, колір очей, форма носа, вух, підборіддя тощо[2]. У результаті мутацій з’являються і успадковуються аномалії у будові тіла, спадкові хвороби. З мутаційною мінливістю пов'язана еволюція – процес утворення нових видів, сортів і порід.
Сучасна точка зору щодо причин спонтанних мутацій сформувалася в 60-ті роки завдяки з'ясуванню механізмів відтворення, репарації та рекомбінації генів і відкриттю ферментних систем, відповідальних за ці процеси. Виникла тенденція пояснювати генні мутації як помилки в роботі ферментів матричного синтезу ДНК. Зараз ця гіпотеза є загальновизнаною[2].
1.2. Класифікація мутацій
Мутації можуть виникати в будь-яких клітинах організму і спричиняти різноманітні зміни генотипу і, відповідно, фенотипу.
Існують кілька класифікацій мутацій[2]:
- за характером клітин, в яких відбулися зміни:
- соматичні - виникають в соматичних клітинах (нестатевих);
- генетичні - виникають у генетичному апараті статевих клітин і передаються нащадкам при статевому розмноженні.
- за ступенем впливу на життєдіяльність:
- летальні мутації – спричиняють загибель організму ще до моменту народження або до настання здатності до розмноження (загибель 100% носіїв мутацій);
- напівлетальні (спричиняють загибель 50-90% носіїв);
- сублетальні (спричиняють загибель 10-50% носіїв);
- нейтральні мутації – не впливають на життєздатність організму;
- корисні мутації – підвищують життєздатність.
- за причиною виникнення мутації:
- спонтанні мутації - відбуваються раптово без видимих причин, але під дією певних чинників;
- індуктивні - відбуваються при спрямованій дії певних мутагенів.
- за характером прояву:
- домінантні;
- рецесивні.
- за характером змін у структурі спадкового матеріалу:
- генні мутації;
- хромосомні мутації;
- геномні мутації.
1.2.1. Генні мутації
Генні мутації являють собою молекулярні, невидимі в світловому мікроскопі зміни структури ДНК[2,3].
ДНК (дезоксирибонуклеїнова кислота) - один із двох типів природних нуклеїнових кислот, що забезпечує зберігання, передачу з покоління в покоління і реалізацію генетичної програми розвитку й функціонування живих організмів.
До мутацій генів відносяться будь-які зміни молекулярної структури ДНК. Деякі мутації не роблять ніякого впливу на структуру і функцію відповідного білка, інша (більша) частина генних мутацій призводить до синтезу дефектного білка, не здатного виконувати властиву йому функцію. Саме генні мутації обумовлюють розвиток більшості спадкових форм патології (наприклад: гемофілія, дальтонізм, альбінізм інші).
Основні види генних мутацій – заміни, вставки, випадання, подвоєння, втрати пар нуклеотидів, що призводить до змін послідовності нуклеотидів.
1.2.2. Хромосомні мутації
Хромосомні мутації – це зміни у структурі хромосом[2].
Хромосоми являють собою нуклеопротеїдні структури еукаріотичної клітини, в яких зберігається велика частина спадкової інформації. Завдяки своїй спроможності до самовідтворення, саме хромосоми забезпечують генетичний зв’язок поколінь. Хромосоми утворюються з довгої молекули ДНК, в якій міститься лінійна група безлічі генів, і вся генетична інформація чи то про людину, тварину, рослину чи будь-яку іншу живу істоту. У кожній хромосомі міститься лише одна молекула ДНК. Хромосоми є в ядрі кожної клітини живого організму[4,5].
Найяскравіша відмітна риса поведінки хромосом під час ділення клітини – це абсолютно точний їх розподіл між двома новонародженими дочірніми клітинами. Якщо цей розподіл порушити, то зміниться не тільки сама клітина, а й ознаки цілого організму.
Основні функції хромосом для всіх живих істот – передача спадкової, генетичної інформації від батьків до дітей[4,5].
Значення хромосом настільки велике, що їх кількість в клітинах, а також особливості кожної хромосоми визначають характерну ознаку того чи іншого біологічного виду. Так, наприклад, у мухи-дрозофіли в наявності 8 хромосом, а хромосомний набір людини становить 46 хромосом. Сукупність всіх пар хромосом називається каріотипом.
Типи хромосомних мутацій[2,3]:
- делеція – випадання ділянки у середній частині хромосоми;
- дуплікація – двократне або багатократне повторювання генів, що містяться на певній ділянці хромосоми;
- інверсія – повертання ділянки хромосоми на 180°, унаслідок чого послідовність генів змінюється на протилежну. Відбувається в результаті двох розривів в одній хромосомі;
- транслокація – зміна положення будь-якої ділянки хромосоми в хромосомному наборі.
Будь-яка, навіть невелика, зміна якої-небудь із хромосом, не залишається безслідною для тієї клітини, де вона відбулася.
1.2.3. Геномні мутації
Геномні мутації полягають у зміні числа хромосом у каріотипі.
Геномні мутації виникають за рахунок пошкоджень в процесі мейозу, що ведуть до того, що хромосоми або хроматиди не розходяться на дочірні клітини[2].
Геномні мутації пов’язані з кратним збільшенням або зменшенням кількості хромосомних наборів. До них належать:
- анеуплоїдія – яку поділяють на гіперплоїдію (збільшення числа хромосом) і гіпоплоїдію (втрату окремих хромосом хромосомного набору). Виникає внаслідок нерозходження хромосом у мейозі або хроматид у мітозі;
- поліплоїдія – кратне збільшення гаплоїдного набору хромосом; виникає внаслідок нерозходження хромосом до полюсів клітини в мітозі або в мейозі.
Синдром Дауна – один з прикладів геномної патології, за якої каріотип представлений 47 хромосомами, замість 46 хромосомами (норма).
1.2.4. Соматичні мутації
Соматичні мутації відбуваються в генетичному апараті соматичних клітин, тобто в клітинах, що складають весь організми. Дані мутації, на відміну від генеративних, виявляються тільки у даної особини. Вони не можуть передатися нащадкам, але можуть передаватися дочірнім клітинам, тобто клітинам, що утворились в наслідок мітозу[2]. Дана аномалія робить організм мозаїком (особиною зі змішаними популяціями клітин) та істотно впливає на розвиток певних ознак організму. У клітинах організму, що розвивається, можуть виникати соматичні мутації всіх тих типів, які спостерігаються в статевих клітках. Хоча соматичні мутації не передаються наступним поколінням, проте здатні знижувати репродуктивний потенціал організмів, в яких вони виникли.
1.3. Різновиди мутагенів та їх характеристика
Причини виникнення мутацій пов'язані з порушенням основних генетичних процесів, що відбуваються в клітині: реплікації та ділення[2,6].
Фактори, які викликали мутації, назвали мутагенними.
Мутагенами можуть бути різні фактори, що викликають зміни в структурі генів, кількості і структурі хромосом. Крім того, майже всі мутагени є одночасно й канцерогенами, тобто вони здатні стимулювати розвиток пухлин[7].
За своєю природою мутагени поділяють на: фізичні, хімічні та біологічні.
1.3.1. Фізичні мутагени
Основними фізичними мутагенними факторами являються іонізуюче випромінювання, ультрафіолетові промені і підвищена температура[6].
Іонізуюче випромінювання (рентгенівські та γ-промені, α- і β-частки, протони, нейтрони) викликає іонізацію молекул – втрату чи приєднання електронів, унаслідок чого утворюються позитивно чи негативно заряджені радикали компоненти нуклеїнових кислот. Хімічні реакції між цими радикалами викликають руйнування ковалентних зв’язків: фосфодіефірних, глікозидних, зв’язків у середині азотистих основ і цукрів[6].
Ультрафіолетові промені – це неіонізуюче випромінювання, яке має найбільшу мутагенну активність. В спектральній області короткохвильового діапазону (100-280 нм) знаходяться максимуми поглинання світла азотистими основами. Внаслідок фотохімічних реакцій між азотистими основами утворюються піримідинові димери, наприклад, між сусідніми (по одному ланцюгу) тимінами[6]. Світло з довжиною хвилі понад 280 нм практично не поглинається ДНК. Певна мутагенна активність пояснюється поглинанням енергії іншими хромофорами (наприклад, деякими коферментами) із подальшою передачею електронного збудження на ДНК. Крім того, поглинута енергія може також бути причиною утворення вільних радикалів деякими молекулами (наприклад, рибофлавіном)[6].
Ультрафіолетові промені, як і рентгенівські, в опромінених клітинах призводять до мутацій, як правило, генних, рідше – хромосомних.
Підвищена температура може збільшити частоту генних, а зростання її до верхньої межі витривалості організмів, і хромосомних мутацій. Меллер показав, що підвищення температури на ![]() С підвищує частоту мутацій у дрозофіл у 2-3 рази[2].
С підвищує частоту мутацій у дрозофіл у 2-3 рази[2].
1.3.2. Хімічні мутагени
Хімічні мутагени – це речовини хімічної природи, здатні індукувати генні та хромосомні мутації.
Встановлено, що до хімічних мутагенів належать декілька тисяч хімічних сполук[2]. Їх дія залежить від природи об'єкта і стадії розвитку клітини. При взаємодії хімічних мутагенів з компонентами спадкових структур (ДНК і білками) виникають первинні ушкодження останніх. Надалі ці первинні ушкодження ведуть до виникнення мутацій.
Хімічні мутагени – це окислювачі та відновники, пестициди, деякі харчові добавки, продукти переробки нафти, органічні розчинники, лікарські препарати.
Крім мутагенів існують комутагени – речовини, що не володіють мутагенною активністю, але підвищують її в декілька разів[2]. Наприклад, вітамін С підсилює цитогенетичний ефект циклофосфаміду, а кофеєн – індукцію метотрексатом хроматичних обмінів. Наявність у середовищі комутагенів підвищує негативний ефект різних мутагенів[2].
1.3.3. Біологічні мутагени
До біологічних мутагенних факторів відносяться віруси, бактерії, паразити, які можуть викликати хромосомні мутації у клітинах тварин.
Основною причиною мутагенної активності вірусів є інтеграція їхніх ДНК у геном клітини-господаря[2]. Причиною мутацій також можуть бути токсини, які виділяють бактерії та паразити, токсичні метаболіти й речовини, синтезовані організмом при реакціях імунної відповіді.
Наприклад, вірус грипу викликає до 10% мутацій. Це в основному делеції і кільцеві хромосоми. Токсин гемолітичного стрептокока зумовлює близько 24% мутацій. Генетично активні також збудники дизентирії[2].
1.3.4. Антимутагени
Антимутагени – це речовини, що знижують частоту мутацій або перешкоджають мутагенній дії різних чинників. Їх важлива особливість – стабілізація мутаційного процесу до природного рівня.
Антимутагени за механізмами дії умовно можна розбити на 3 групи[2]:
1) антимутагени, які нейтралізують мутаген до його взаємодії з ДНК;
2) активують ферментні системи детоксикації забруднювачів, що надходять з середовища;
3) запобігають помилкам в процесі реплікації ДНК.
Групи антимутагенів за хімічною будовою[2]:
1) вітаміни і провітаміни (вітамін Е знижує мутагенну дію іонізуючих випромінювань і хімічних сполук; вітамін С сприяє зменшенню частоти аберацій хромосом, викликаних іонізуючими випромінюваннями; вітамін А знижує природні і штучні мутації в клітинах тварин; вітамін В знижує дію алкілуючих сполук, ультрафіолетового опромінення шляхом посилення репарації);
2) фізіологічно активні форми гумінових сполук;
3) амінокислоти (аргінін, гістидин, метіонін, цистеїн);
4) ферменти (пероксидаза, каталаза);
5) фармакологічні засоби (інтерферон);
6) група речовин з антиокислювальними властивостями;
7) комплексні сполуки.
1.4. Особливості мітозу як способу репродукції клітин
Мітоз – найбільш поширений спосіб репродукції клітин тварин, рослин, найпростіших. Основна його роль полягає у точному відтворенні клітин, забезпеченні рівномірного розподілу хромосом материнської клітини між виникаючими з неї двома дочірніми клітинами і підтриманні сталості числа і форми хромосом у всіх клітинах рослин і тварин[2].
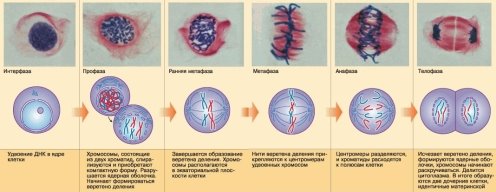
Мітоз настає після інтерфази і умовно поділяється на такі фази: профаза, метафаза, анафаза, телофаза (рис. 1.1).
|
|
|
Рисунок 1.1 – Фази мітозу |
Профаза – характеризується тим, що ядро збільшується в розмірах, і з хроматинової сітки, в результаті спіралізації і вкорочення, хромосоми з довгих, тонких, невидимих ниток наприкінці профази стають короткими, товстими і розміщуються у вигляді видимого клубка. Профаза завершується зникненням ядерця, центріолі розходяться до полюсів з утворенням фігури веретена.
Метафаза розпочинається рухом хромосом у напрямку до екватора. Поступово хромосоми розміщуються у площині екватора, утворюють так звану метафазну пластинку. Метафазну пластинку використовують у цитогенетичних дослідженнях для визначення числа і форми хромосом.
В анафазі сестринські хроматиди відходять одна від одної, розділяється з'єднуюча їх центромерна ділянка. Кожна хроматида з окремою центромерою стає дочірньою хромосомою і по нитках веретена починає рухатися до одного з полюсів.
Телофаза – заключна стадія мітозу. Хромосоми, які досягли полюсів, складаються з однієї нитки, стають тонкими, довгими і невидимими у світловий мікроскоп. Вони зазнають деспіралізації, утворюють сітку інтерфазного ядра. Формується ядерна оболонка, з'являється ядерце. У цей час зникає мітотичний апарат і відбувається цитокінез – розділення цитоплазми з утворенням двох дочірніх клітин.
Порушення, які виникають у мітозі, призводять до утворення клітин з різними каріотипами. Такий мітоз отримав назву патологічного[3].
З патологічними мітозами пов'язано виникнення багатьох захворювань (рак, променева хвороба, вірусних інфекціях). Внаслідок порушення процесу мітозу можуть виникати хромосомні мости, пошкодження центромер, порушення руху хромосом,утворення мікроядер, склеювання хромосом або їх розриви та інше[3,5].
1.5. Характеристика виду птиці «Крос Ломан Браун»
Птахівництво – галузь тваринництва, яка постачає населенню унікальні продукти харчування. Яйця сільськогосподарської птиці володіють високими харчовими властивостями, а яйця курей вважаються дієтичними продуктом. Куряче яйце задовольняє потреби організму у вітаміні А на 15%, В2 і D – на 10% і В12 – на 50%. Біологічна цінність м’яса птиці зумовлюється повноцінністю його білків. Воно містить значну кількість мінеральних речовин (особливо Са і Р) та вітамінів Е і В[8].
Головним завданням промислового птахівництва – є виведення нової високопродуктивної птиці. Для його досягнення використовується змішування декількох порід і створення гібридів. Такі гібриди називаються кросами[8]. Вони відрізняються підвищеною продуктивністю, здатності до виживання і швидко пристосовуються до нових умов навколишнього середовища.
До одного з таких кросів відноситься і м'ясо-яєчний крос Ломан Браун. Порода виведена німецькою фірмою Lohmann Tierzucht GmbH, шляхом багаторічної селекційної роботи зі схрещування чотирьох порід гібридів першого покоління, в основу якої закладалося отримання високопродуктивного кросу незалежно від умов їх утримання.
Колір оперення птиці коричневий і білий, різновид забарвлення характеризується наявністю двох генів: материнського і батьківського. Найчастіше півні білі, а кури мають червоно-коричневе оперення.
Крос відрізняються міцною статурою, широкими грудьми, щільним животом і добре розвиненими крилами. Птахи добре адаптуються до нових умов і зовсім невибагливі. Півні досягають ваги до 3кг, а несучки – 2кг. У віці 20 тижнів вони здатні відкладати перші яйця[8]. За рік здорова несучка відкладає близько 330 яєць.
В домашніх умовах вивести курчат цього гібрида неможливо. Яйця для інкубації постачають з Німеччини, звідки родом порода.
Цитологічна характеристика: каріотип у курей (рис. 1.2) складається з 78 хромосом (76А+ZZ або ZW) [4,5].
|
|
|
Рисунок 1.2 - Каріотип курки |
Спермії, які проникають у яйцепроводи самки, зберігаються там живими і здатними до запліднення тривалий строк – до трьох тижнів.
Ломан Браун володіють міцним імунітетом, але і вони схильні до поширених хвороб домашньої птиці (кокцидіоз, аскаридоз, туберкульоз).
1.6. Важливість клінічного методу дослідження стану клітин для живих організмів
Для обґрунтованого аналізу захворювання у птиці потрібне проведення комплексу досліджень: клінічне дослідження, патологоанатомічний розтин трупів, спеціальні дослідження на інфекційні і інвазійні захворювання та інші.
Схема клінічного дослідження птиці[9]:
1) збір анамнезу;
2) загальний огляд птиці;
3) вибіркове дослідження хворих птиць, виділених при загальному огляді;
4) спеціальні і лабораторні клінічні дослідження птиці.
Збір анамнезу включає наступні основні питання:
1) Порідний і віковий склад птиці; годування і водопій.
2) Система утримання птиці, щільність посадки на 1м2 пташника, система вентиляції, температурний і світловий режими.
3) Захворюваність і відхід від незаразних і заразних захворювань.
4) Ознаки захворювання птиці, що піддається дослідженню.
Загальний огляд проводиться безпосередньо в приміщеннях, де міститься птиця, або під час вигулу. Птиць, у яких під час загального огляду помічені ознаки захворювання, досліджують індивідуально.
Порядок дослідження:
1) фіксація птиці;
2) вимірювання температури;
3) дослідження носових отворів, очей і зовнішніх слухових проходів;
4) огляд ротової порожнини і гортані;
5) дослідження трахеї;
6) дослідження зобу;
7) дослідження грудної клітки;
8) дослідження органів черевної порожнини;
9) дослідження клоаки;
10) дослідження кінцівок.
Для уточнення діагнозу, проводяться додаткові дослідження, що вимагають особливих умов і пристосувань: дослідження крові, посліду, вмісту зобу, ексудату і трансудату порожнин, рентгеноскопія і рентгенографія, ендоскопія гортані і трахеї та інше[9].
Для точної діагностики хромосомної хвороби необхідно визначити: тип мутації; залучену в процес хромосому; форму (повна або мозаїчна); вид хвороби (спорадичний випадок або успадкована форма). Така діагностика можлива тільки при цитогенетичному дослідженні.
Аналіз крові на гемолітичні та морфологічного показники[10,11,12]:
Кров для дослідження беруть з підкрилової вени, а також з потовщених видимих ділянок шкіри (гребінь, борідка). Узяту кров досліджують за загальноприйнятими методиками. На відміну від інших тварин у птиць еритроцити і тромбоцити крові містять ядра, тому роздільний спосіб підрахунку еритроцитів, лейкоцитів і тромбоцитів непридатний. У птиць спочатку визначають загальне число формених елементів в 1мм3 крові (їх суму), потім в забарвленому мазку підраховують 1000 клітин і обчислюють процентне співвідношення еритроцитів, лейкоцитів і тромбоцитів в крові. Знаючи процентне співвідношення формених елементів крові, обчислюють їх абсолютний вміст в 1 мм3.
1.6.1 Метод мікроядерного тесту
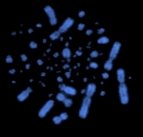
Мікроядерний тест – метод визначення мутагенної активності факторів зовнішнього середовища, полягає у визначенні частоти інтерфазних клітин з мікроядрами[13,14].
Мікроядра – це вторинні ядра, що утворюються під час телофази з хроматину, що затримався в анафазі внаслідок хромосомних ушкоджень або дисфункції веретена поділу. Є патологічною структурою і може спостерігатися в клітинах будь-яких тканин.
Чисельність мікроядер свідчить про ступінь забруднення навколишнього середовища мутагенами[13]. Частота виникнення мікроядер збігається з частотою аберацій хромосом, оскільки перші є наслідком останніх, але технологія аналізу мікроядер значно простіша. Їх можна спостерігати в клітинах, що перебувають в інтерфазі (рис. 1.3).
|
|
|
Рисунок 1.3 - Мікроядра |
Для аналізу частоти появи клітин з мікроядрами відбирають мазки епітеліоцитів зі слизової оболонки ротової порожнини та проводять первинну фіксацію у 96%-му етанолі. У лабораторних умовах досліджувані мазки фіксують в ацетоалкоголі за Карнуа протягом години та фарбують реактивом Шифа за Фельгеном[13,14].
Мазки аналізують за допомогою біологічного мікроскопу при збільшенні в 7×60; 15×90. При визначенні частоти появи клітин з мікроядрами враховують їхню кількість і відносять до загальної кількості переглянутих клітин. У кожному варіанті аналізують не менше 1000 клітин.
Мікроядерний індекс (МЯ) розраховують за частотою появи клітин з мікроядрами, тобто
МЯ = mn , (1.1)
де n – кількість клітин з мікроядрами;
m – загальна кількість проаналізованих клітин.
Потім обчислюють показник абсолютного розкиду даних, виходячи з величини відносної помилки, яку визначають так:
А = 1.385![]() (1.2)
(1.2)
де А – відносна помилка;
1,385 – коефіцієнт при кількості вимірів більше 100.
Абсолютний розкид даних α визначають за формулою: α = А·МЯ.
Кінцевий результат мікроядерного тестування має такий вигляд: (МЯ ± α).
РОЗДІЛ 2
ПРАКТИЧНА ЧАСТИНА
2.1. Об’єкт та місце дослідження
Польові дослідження проводились в приватному господарстві керівника проекту В.В.Сінкевич.
Молодняк добового віку, у кількості 25 курчат, придбали 1 квітня 2019 року в Солонянській інкубаційній станції міста Дніпро, яка спеціалізується на інкубації молодняку сільськогосподарської птиці та знаходиться на пташиному ринку з 1946 року. Курчата пройшли вакцинацію і ветеринарний контроль. Також придбали стартовий комбікорм для їх годування та «Аптечку» з інструкцією по застосуванню препаратів.
В одного курчати, при зовнішньому огляді, була виявлена додаткова кінцівка, яка росла з під лівого крильця і на кінці мала один кіготь. Через декілька днів кіготь відпав, і кінцівка почала густо вкриватися пір’ям.
2.1.1. Умови середовища проживання курча
Температура: перші 5 днів температуру в зоні розміщення курчат підтримували на рівні 30-32°С, з 6-го дня її знизили до 28-30°С і кожного наступного тижня – на 3°С, до кінця місяця доводячи до 18°С.
Вологість повітря: 60-70%.
Тривалість світлового дня: 17 годин, поступово зменшуючи до 12 годин.
Підстилка: перші два тижні утримували на змінюваній підстилці, а потім на глибокій підстилці (суміш торфу, деревної стружки і солом’яної січки), яка сприяє виділенню великої кількості тепла, оберігає ноги курчат від впливу низьких температур, впливає на їх загальний стан і здоров’я і, природно, належить до істотних факторів середовища. По мірі забруднення підстилки, на попередній її шар насипали свіжу нову підстилку. Таким чином вона постійно є сухою, добре зберігає тепло у приміщенні.
Вентиляція: природня, без протягів.
2.1.2. Раціон та продукти годування
Перші два тижні курчат годували стартовим комбікормом, який придбали на Солонянській інкубаційній станції, потім дрібно подрібненою якісною зерновою сумішшю, додаючи дрібно порубане круто зварене яйце, добре віджатий некислий сир. До основного раціону додавали подрібнену свіжу зелень – люцерну, конюшину, кропиву [Додаток А].
Сухої суміші курчатам до двомісячного віку давали досхочу: годівниця з сухою сумішшю постійно перебувала у курчат. Потім поступово, перевели на чотириразове годування.
Воду, кімнатної температури, у кількості 1 л, міняли кілька разів на день.
2.2. Лабораторні та клінічні дослідження стану птиці
Загальний огляд, проводився у віці 24 тижні під час вигулу: поведінка курча, реакція на оточуюче, характер прийому корму і води, положення птиці під час руху - активне.
Забарвлення видимих шкірних покривів: гребінь і борідка рожевого кольору, набряклі, теплі на дотик, дзьоб і плесно забарвлені в жовтуватий колір, шкіра ніжна, еластична, синюшності та блідості шкірних покривів не виявлено, травматичних пошкоджень не має.
Оперення гладеньке, пір'я розташоване правильними симетричними рядами по довжині тіла. Під лівим крильцем виявлена додаткова кінцівка.
Ноги широко розставлені, міцні, з гарною пігментацією.
Клоачне кільце набрякле, напіврозкрите, вологе.
Вага на 350г (що становить 24%) менша за норму [Додаток А]. Щоб збільшити вагу курча, до його раціону почали додавати м'ясокістне борошно.
Під час виконання клінічних досліджень дотримано всіх біотичних вимог по відношенню до курча, що відповідають Закону України «Про захист тварин від жорстокого поводження» від 28.03.2006 року[15] та Наказу Міністерства освіти України №249 від 01.03.2012 року про «Порядок проведення науковими установами дослідів, експериментів на тваринах»[16].
Результати обстеження:
Температура: ![]() . Носові отвори чисті, без виділень.
. Носові отвори чисті, без виділень.
Обстеження очей: рогівка ціла, прозора; крововиливів, запалення та набряклості не спостерігається.
Зовнішні слухові проходи чисті.
Дихальні рухи підраховувалися оглядом екскурсій нижньої частини живота нижче за клоаку (у птиць відсутня діафрагма, у акті дихання значна роль належить мускулатурі черевного преса) за 1 хвилину 40 дихальних рухів (норма для дорослої курки в 1 хвилину 10-30 дихальних рухів, для курчат до 60).
Характер дихання – нормальне, без шумів і свистів.
Лабораторні дослідження проводилось в ветеринарному центрі «Біосвіт», сумісно з головним лікарем, кандидатом ветеринарних наук, доцентом кафедри нормальної і патологічної анатомії ДГАЕУ Олександром Олексійовичем Шулешко.
Під час обстеження був зроблений рентген у дослідного курча, а морфологічне та комплексне біохімічне дослідження крові, для порівняння, проводилось також для здорового представника.
Рентгенологічне досліджування проводилося у боковій та вентродорсальній проекціях. На знімках чітко видно, що під лівим крильцем розташована недорозвинена кінцівка. [Додаток Б]
Результати лабораторного аналізу крові [Додаток В]:
Кількість формених елементів (еритроцити та лейкоцити), гемоглобін, лейкограма у дослідного курча суттєво не відрізняються від референтної норми, у здорового курча – в межах норми[12].
Комплексне біохімічне дослідження крові у дослідного курча показало, збільшення білкового коефіцієнту на 25%, що спостерігається при хронічних дифузних ураженнях печінки, інфекційних захворюваннях[11].
Підвищений рівень сечовини (в 3 рази) може свідчити про сечокам'яну хворобу, новоутворення у сечовому міхурі, або сечовивідних шляхах; ниркову недостатність, інфекційну хронічну патологію. Збільшення креатиніну майже в 3 рази також вказують на захворювання нирок[11].
Збільшення холестерину на 16% вказує на захворювання печінки та підшлункової залози, хронічні хвороби нирок, порушення обміну речовин[11].
Підвищення вмісту глюкози у крові майже в 17 разів (гіперглікемія) виникає після прийому великої кількості цукрів з кормами, при стресових станах, гіперфункції надниркових залоз[11].
Кількість загального біруліну – в межах норми, але є збільшення на 100% вмісту прямого (кон’югованого) біруліну, що спостерігається у тварин при паренхіматозній жовтяниці, зумовленій запаленням печінки або її дистрофією[11].
Зниження в крові АЛТ (в 15 раз) і АСТ (в 1,2 рази) говорить про руйнування функціональних клітин внаслідок ракового або запального процесу[11].
Зменшення вмісту неорганічного фосфору (в 2,2 рази) спостерігається при нестачі його у раціоні тварин, порушенні кишкового всмоктування та гіперфункції прищитоподібних залоз (збільшується виділення фосфору із сечею внаслідок зменшення його реабсорбції у ниркових канальцях), при рахіті та аліментарній остеодистрофії[11].
Зниження рівня лужної фосфатази (в 4 рази) в крові може бути викликано дефіцитом цинку і магнію в організмі, рідкісним генетичним захворюванням кісток – гіпофосфатазією, при недостатньому харчуванні та дефіциті білка в організмі[11].
Комплексне біохімічне дослідження крові у здорового курча суттєво не відрізняються від референтної норми.
Результати оцінки цитогенетичного стану організму з мутацією в порівнянні зі здоровим організмом приведені в таблиці 1.1:
Таблиця 1.1
Мікроядерний індекс в клітинах слизової оболонки ротової порожнини курча кросу Ломан Браун з мутацією кінцівки в порівнянні із здоровим представником
|
№з/п |
МЯ-індекс на одну клітину (х±а) |
|
|
Здорове курча |
Курча з мутацією |
|
|
1 |
0,030±0,002 |
0,092±0,005 |
|
2 |
0,058±0,003 |
0,100±0,006 |
|
3 |
0,060±0,004 |
0,083±0,004 |
|
4 |
0,047±0,003 |
0,097±0,005 |
|
5 |
0,065±0,004 |
0,100±0,006 |
|
середнє |
0,052±0,003 |
0,094±0,005 |
|
|
|
|
Цитогенетичне дослідження показало зростання мікроядерного індекса у представника з мутацією від 0,083 до 0,100, в той час, як коливання цих значень у здорового представника лежать в межах від 0,030 до 0,065. Наші результати співпадають з даними інших авторів [17], які спостерігали зростання значення мікроядерного індексу в різних органах лабораторних тварин, культурі лейкоцитів периферичної крові людини, букального епітелію ротової порожнини під впливом мутагенів, фізичного та хімічного походження, навколишнього середовища.
Згідно мікроядерного тесту, була проведена оцінка цитогенетичного статусу організму курча з мутацією в порівнянні зі здоровим організмом (таблиця 1.2).
Таблиця 1.2
Оцінка цитогенетичного статусу курча з мутацією
|
Варіанти |
МЯ-індекс на одну клітину |
Умовний показник ушкодженості (УПУ) |
Рівень ушкодженості [Додаток Г] |
Цитогенетичний стан організму [Додаток Г] |
|
Здорове курча |
0,052±0,003 |
0,289 |
середній |
конфліктний |
|
Курча з мутацією |
0,094±0,005 |
0,522 |
вище за середній |
критичний |
Примітка. УПП = ![]() , де Пкомф. = 0; Пкрит. = 0,180
, де Пкомф. = 0; Пкрит. = 0,180
Результати обчислень вказують на середній рівень ушкодженості клітин слизової оболонки ротової порожнини та конфліктний цитогенетичний стан всього організму у здорового курча і на рівень ушкодженості клітин слизової оболонки ротової порожнини «вище за середній» у курча з мутацією. Його цитогенетичний стан - «критичний»[13].
ВИСНОВОК
Внаслідок антропогенного фактору у довкілля потрапляє тисячі забруднюючих речовин, які є екологічно небезпечними – мають мутагенну, канцерогенну активність. Вони, звичайно, накопичуються у ґрунтах, водоймах, повітрі, вступають до біологічного колообігу речовин і за ланцюгами живлення мігрують по планеті, в тому числі потрапляють до організму людини[1].
Проведеним аналізом наукових літературних джерел, була розкрита суть проблеми та причини мутацій, негативний вплив мутагенів на життєдіяльність живих організмів, тому об’єктом дослідження було обрано курча кросу Ломан Браун, з мутацією кінцівок. Визначилися з методами дослідження та провели клінічне дослідження курча а саме: збір анамнезу; загальний огляд птиці; лабораторні дослідження (рентген, морфологічне та комплексне біохімічне дослідження крові); цитогенетичне обстеження за мікроядерним індексом.
Дослідженням встановлено, що кількість формених елементів (еритроцити та лейкоцити), гемоглобін, лейкограма суттєво не відрізняються від референтної норми.
Комплексне біохімічне дослідження крові показало, що курча з мутацією має хронічне ураження печінки, захворювання нирок, сечового міхура, інфекційну хронічну патологію, руйнування функціональних клітин внаслідок онкологічного або запального процесу.
Результати мікроядерного дослідження в клітинах слизової оболонки ротової порожнини курча кросу Ломан Браун з мутацією кінцівки показали, що рівень ушкодженості клітин «вище за середній» та «критичний» цитогенетичний стан всього організму.
В роботі відпрацьовано гіпотезу, що мутація у курча спровокована мутагенами навколишнього середовища. Аналіз, проведеного іншими дослідниками [18] стану навколишнього середовища Солонянського району цитогенетичними методами, свідчить про сприятливий екологічний стан цієї території. Маємо думку, що феномен мутагенності курча в популяції, які вирощуються індустріальним методом, в більшій мірі, залежить від якості корму[19,20], що можна дослідити в майбутньому.
Виділяють основні підходи до розв'язання проблеми зниження рівня впливу мутагенів[1,6]:
- переведення промисловості на роботу в замкнених (екологічно безпечних) циклах;
- вилучення або нейтралізація мутагенних чинників у навколишньому середовищі;
- використання антимутагенів для зниження темпів мутацій у клітинах;
- перевірка всіх нових хімічних речовин, лікарських засобів на мутагенність.
В законодавчих актах України [21,22] наголошується на створення державної служби генетичного моніторингу. Мета якого – аналіз мутагенного стану довкілля та спостереження за мутагенними змінами в популяціях людей.
Отже, за допомогою цитогенетичного методу біотестування можна швидко оцінити сумарну дію всієї сукупності забруднювачів біосфери, спрогнозувати очікувані зміни в екосистемах та своєчасно прийняти управлінські рішення щодо покращення стану довкілля. Окрім того, є можливість встановити не тільки наслідки техногенезу, але й визначити ефективність заходів з екологізації технологій [19,20,23]. Використання таких методів у державній системі моніторингу довкілля України дозволяє формувати банк даних, необхідних для розроблення екологічних карт за показниками, що характеризують загальну токсичність та мутагенність об’єктів навколишнього середовища. Ці методи сприяють вирішенню проблеми екологічного нормування за цитогенетичними показниками біоіндикаторів, а також дозволяють оцінити екологічний і генетичний ризики для біоти.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Моніторинг довкілля: підручник /[Боголюбов В.М., Клименко М.О.,
Мокін В.Б.та ін.];заред.проф. В.М.Боголюбова. Вид. 2-ге,переробл. і доповн. – Київ: НУБіПУ, 2018. – 435 с.
2. Медична біологія. /За редак. В.П.Пішака, Ю.І.Бажори. Підручник.- Вінниця: НОВА КНИГА, 2004.-656с.
3.Цитологія в питаннях і відповідях : навч. посіб. /Л.В.Васько, Л.І.Кіптенко, О.М.Гортинська, Н.Б.Гринцова.– Суми:Сумський державний університет, 2016.–95с.
4. ЦИТОГЕНЕТИКА: Методичні рекомендації для виконання лабораторно-практичних робіт студентами денної форми навчання спеціальності 8.09010203 – «Розведення та селекція тварин» / О.Ю. Сметана, О.І. Каратєєва- МИКОЛАЇВ 2013.-65с.
5. ЦИТОЛОГІЧНІ ТА МОЛЕКУЛЯРНІ ОСНОВИ СПАДКОВОСТІ: Методичні вказівки до виконання лабораторних та самостійних робіт студентам освітньо-кваліфікаційного рівня «Бакалавр» спеціальність –6.110.100 «Ветеринарна медицина»/ І.О. Супрун, Л.М. Хмельничий- Київ, 2010.-57с.
6. І.М. Гудков. Радіобіологія: Підручник для вищ. навчальних закладів. – К.:
НУБіП України, 2016. – 485 с
7. Дубинин Н.П., Пашин Ю.В. Мутагенез и окружающая середа. – М.: «Наука»,1975.-128с.
8. Селекція сільськогосподарських тварин / Б.М. Гопка, В.П. Коваленко, Ю.Ф. Мельникта та ін. / За заг. ред. Ю.Ф. Мельника, В.П. Коваленка та А.М. Угнівенка. – К.: , 2007. – 554с.
9. Судаков М. О. Внутрішні незаразні хвороби тварин: Підручник. — 2-ге вид., доп. / М. О. Судаков, М. І. Цвіліховський, В. І. Береза та ін.; За ред. М. О. Судакова. — К.: Мета, 2002. — 352 с.
10. Біохімічні методи дослідження крові тварин: Методичні рекомендації для лікарів хіміко-токсикологічних відділів державних лабораторій ветеринарної медицини України, слухачів факультетів підвищення кваліфікації та студентів факультету ветеринарної медицини / В.І. Левченко, Ю.М. Новожицька, В.В. Сахнюк та ін.– Київ, 2004.– 104 с.
11. Дослідження крові тварин та клінічна інтерпретація отриманих
результатів: Методичні рекомендації для студентів факультету ветеринарної медицини керівників та слухачів Інституту післядипломного навчання керівників і спеціалістів ветеринарної медицини / В.І. Левченко, В.М. Соколюк, В.М. Безух та ін. – Біла Церква, 2002.– 56 с.
12. Общие и специальные методы исследования крови птиц промышленных кроссов / [Садовников Н. В., Придыбайло Н. Д., Верещак Н. А.,Заслонов А. С.]. – Санкт-Петербург : Уральская ГСХА, НПП «АВИАК», 2009. – 85 с.
13. Обстеження та районування територій за ступенем впливу антропогенних чинників на стан об’єктів довкілля з використанням цитогенетичних методів. Методичні рекомендації МР 22.12-141-2007. Видання офіційне. Київ-2007-25с.
14. Клімкіна, І.І. Методичні рекомендації до виконання лабораторних робіт з
дисциплін «Загальна біологія» та «Біологія» для студентів спеціальностей 091
«Біологія», 101 «Екологія» та 183 «Технології захисту навколишнього середовища» / І. І. Клімкіна, В. В. Федотов; НТУ«Дніпровська політехніка». — Дніпро: НТУ «ДП», 2019. - 76 с.
15. Закон України «Про захист тварин від жорстокого поводження» від 28.03.2006 року із змінами від 04.08.2017
16. Наказ Міністерства освіти України №249 від 01.03.2012 року про «Порядок проведення науковими установами дослідів, експериментів на тваринах».
17. Осташ О.М. Дисертація на здобуття наукового ступеня кандидата біологічних наук УДК 614.7: 612.014.46: 615.277: 612.017 Експериментальне обґрунтування методичних підходів до оцінки та прискореного нормування генотоксичних канцерогенів. 14.02.01-Гігієна та професійна патологія /біологічні науки/
18. Скворцова Т.В. Еколого-генетична оцінка грунтів Дніпропетровської області на зменшення генетичних наслідків сумарного забруднення грунтів за допомогою гумінових препаратів» Автореферат дисертації на здобуття наукового ступеня кандидата біологічних наук. За спеціальністю 03.00.15-генетик. Київ-2006
19. Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду. Руководство Р2.1.10.1920-04 Human Health Risk Assessment fromEnviromental Chemicals, 2004г.
20. Баглей Е.А. Современные методические подходы к оценке онкогенной опасности пестицидов и агрохимикатов/Е.А.Баглей, Г.Н.Бахиш//Современные проблемы токсикологии – 2000-№4-с.3-6
21. Указ Президента України від 4 лютого 1999 року №118/99 Про Цільову комплексну програму генетичного моніторингу в Україні на 1999 - 2003 роки
22. Міністерство охорони здоров’я України. Наказ від 13 березня 2007 року №116 Про затвердження методичних рекомендацій "Обстеження та районування території за ступенем впливу антропогенних чинників на стан об'єктів довкілля з використанням цитогенетичних методів"
23. Новый подход к диагностике мутагенних и канцерогенних свойств окружающей среды/Л.П.Сычева, В.С.Журков, Ю.А.Рахманин и др..//Гиг и Сан.-2003-№6-с.87-91
ДОДАТКИ
Додаток А
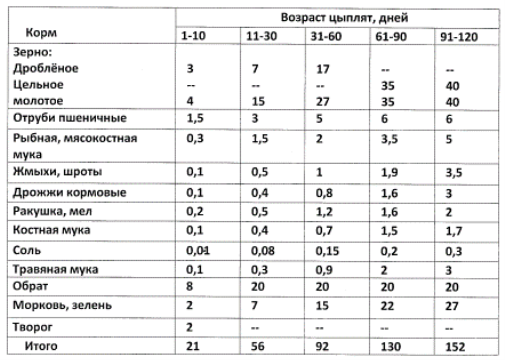
Таблиця1
Раціони для курчат яєчних порід, грам на голову в добу[8]
Таблиця 2.
Динаміка маси тіла курчат[12]
|
Вік, тиж. |
Маса тіла (норма),г |
Маса тіла (дослідне курча),г |
Добова потреба корму (г на 1 голову) |
Тип корму |
|
1 |
70 |
70 |
11 |
для курчат |
|
2 |
130 |
130 |
25 |
для курчат |
|
3 |
190 |
180 |
29 |
для курчат |
|
4 |
260 |
250 |
31 |
для курчат |
|
8 |
610 |
580 |
43 |
для курчат/для молодняка птиці |
|
12 |
900 |
800 |
55 |
для молодняка птиці |
|
16 |
1150 |
900 |
68 |
для молодняка птиці |
|
20 |
1300 |
1000 |
92 |
для несучок |
|
24 |
1450 |
1100 |
120 |
для несучок |
|
48 |
1700 |
- |
120 |
для несучок |
Додаток Б
Рентгенівський знімок у боковій та вентродорсальній проекціях
|
|
|
|
Додаток В
Таблиця 3.
Гематологічні показники курча з мутацією та здорового представника в порівнянні з нормою від 03.11.2019 р.
|
№/п |
Показники |
Курча з мутацією |
Здорове курча |
Референтні норми |
|
1 |
Гемоглобін, г/л |
94 |
90 |
80-120 |
|
2 |
Еритроцити, млн/мкл (Т/л) |
2.8 |
3.1 |
3-4 |
|
3 |
Лейкоцити, тис./мкл (Г/л) |
41 |
39 |
20-40 |
|
Лейкограма |
||||
|
4 |
Лімфоцити, % |
54 |
58 |
52-60 |
|
5 |
Моноцити, % |
9 |
6 |
4-10 |
|
6 |
Еозинофіли, % |
10 |
9 |
6-10 |
|
7 |
Базофіли, % |
1.9 |
1,6 |
1-3 |
|
8 |
Псевдоеозинофіли, % |
24.4 |
26.2 |
24-30 |
Таблиця 4.
Комплексне біохімічне дослідження крові курча з мутацією та здорового представника в порівнянні з нормою від 03.11.2019 р.
|
№/п |
Показники |
Курча з мутацією |
Здорове курча |
Референтні норми |
|
|
1 |
Загальний білок, г/л |
45 |
49 |
43-60 |
|
|
2 |
Альбумін, г/л |
17 |
15.6 |
14.3- 19.7 |
|
|
3 |
Глобулін, г/л |
28 |
29.1 |
28.7 -39.3 |
|
|
4 |
Білковий коефіцієнт, од. |
0.6 |
0.5 |
0.33-0.48 |
|
|
5 |
Сечовина, ммоль/л |
1.0 |
0.35 |
0,15-0,3 |
|
|
6 |
Азот сечовини, мг% |
1.9 |
1.7 |
|
|
|
7 |
Креатинін, мкмоль/л |
36 |
15.0 |
12.5 |
|
|
8 |
АСТ, Од/л |
172 |
191 |
192.55-208.75 |
|
|
9 |
АЛТ, Од/л |
2 |
29 |
31.25 |
|
|
10 |
Індекс де Рітіса(АСТ/АЛТ) , од. |
86.0 |
6.6 |
|
|
|
11 |
Лужна фосфотаза, Од/л |
85.2 |
335.4 |
341.5 |
|
|
12 |
Α-аміліза, г/ч˟л |
178 |
|
|
|
|
13 |
Бірулін загальний, мкмоль/л |
5.1 |
4.8 |
1,71–6,0 |
|
|
14 |
Бірулін прямий, мкмоль/л |
3.6 |
- |
- |
|
|
15 |
Бірулін непрямий, мкмоль/л |
1.5 |
- |
|
|
|
16 |
Глюкоза, ммоль/л |
132.0 |
11.22 |
4,44–7,77 |
|
|
17 |
Кальцій, ммоль/л |
2.1 |
4.0 |
4.5-5.0 |
|
|
18 |
Неорганічний фосфор, ммоль/л |
1.1 |
1.5 |
1,7-2, 2 |
|
|
19 |
Са/Р, од. |
1.9 |
1.4 |
1,12-1,3 |
|
|
20 |
Холестерин, ммоль/л |
2.9 |
2.6 |
2.5 |
|
Додаток Г
Уніфікована оціночна шкала, що характеризує стан об’єктів довкілля за токсико-мутагенним фоном, для прийняття управлінських рішень[13 ]
|
Категорія екологічної безпеки території за токсико-мутагенним фоном |
Діапазон оцінок УПУ |
Ознаки прийняття управлінських рішень |
||
|
Рівень ушкодженості біостстем |
Стан біосистеми |
Види управлінських рішень |
||
|
Безпечна |
0,000-0,250 |
Низький і нижче за середній |
Еталонний і сприятливий |
Інформаційний періодичний регламентний контроль. Визначення еталонних територій з УПУ≤0,150, які вимагають особливої охорони і можуть бути використані для контролю |
|
Помірно небезпечна |
0,251-0,500 |
Середній |
Конфліктний і загрозливий |
Нормуючий, періодичний регламентний контроль. Визначення територій з нормативним рівнем ушкодженості біосистем з УПУ≤0,300, встановлення причин і ступеня відхилення від нормативних показників та засоби для досягнення нормативних показників |
|
Небезпечна |
0.501-0,750 |
Вище за середній |
Критичний |
Тактично-стратегічні дії і постійний регламентний контроль. Визначення джерел і компонентного складу забруднювачів, розроблення реабілітаційних заходів щодо поліпшення стану довкілля і біологічних систем |
|
Надзвичайно небезпечна |
0,751-1.000 |
Високий |
Катострофіч-ний
|
Радикальна зміна тактики і стратегії. Особливий регламентний контроль. Визначення меж територій з катастрофічним еталоном. Розроблення цілеспрямованих заходів щодо відновлення екологічного стану ушкоджених територій та біосистем |
Додаток Д
Фотозвіт
|
Курча з додатковою кінцівкою |
|
|
Життєдіяльність курча з мутацією |
|
|
Розроблення плану роботи Горілою Ольгою та науковим керівником Горовою А.І. по виконанню практичної частини проекту |
Обговорення результатів лабораторного дослідження керівниками проекту Горовою А.І, Сінкевич В.В. та Горілою Ольгою |
|
Приготування фарбника |
|
|
Відбір мазків зі слизової оболонки ротової порожнини |
|
|
Дослідження мазків |
Лабораторні дослідження в ветеринарному центрі «Біосвіт». |

про публікацію авторської розробки
Додати розробку