Науково-практична робота по STEM-освіті "Від кристалічної гратки до монокристалу".
- Мета роботи: прослідкувати залежність властивостей монокристалу мідного купоросу від будови кристалічної гратки. Шляхом інтеграції знань з хімії, математики, фізики, з використанням елементів інженерних технологій усвідомити цілісність та взаємозалежність компонентів навколишнього світу.
- Ідея : вирощені в шкільній хімічній лабораторії монокристали мідного купоросу геометричними формами повторюють будову кристалічної гратки . Демонстрації кристалічної гратки та зразків кристалів мідного купоросу оформлені світлодіодами.
- Презентація роботи: композиція – модель кристалічної гратки з підсвічуванням, натуральні зразки кристалів з підсвічуванням.
1
Міністерство освіти і науки України
Департамент освіти і науки Миколаївської облдержадміністрації
Миколаївська І-ІІІ ст.. ЗОШ № 40
|
|
ВІД КРИСТАЛІЧНОЇ ГРАТКИ ДО МОНОКРИСТАЛУ
|
Роботу виконали: Ляшенко Неля
Гавриленко Андрій,
Науковий керівник:
Біденко Ніна Дмитрівна, |
|
|
Миколаїв-2018
ТЕЗИ
науково дослідної роботи «Від кристалічної гратки до монокристалу»
Роботу виконали: Ляшенко Неля, Гавриленко Андрій учасники першого фестивалю шкільних творчих та наукових роботі зі STEM-освіти учні 9-Г класу, учні 7-Г та 7-А класів Миколаївської І-ІІІ ст. ЗОШ № 40, м. Миколаїв.
Керівник: учитель хімії, спеціаліст вищої категорії, «учитель-методист» Миколаївської І-ІІІ ст. .ЗОШ № 40,
м. Миколаїв. .
Мета дослідження: довести на прикладі утворення кристалів в природі взаємозв’язок між будовою кристалічних граток речовин та їх основними фізичними і хімічними властивостями.
Об'єкт дослідження: зразки кристалів мідного купоросу, вирощені в умовах хімічної лабораторії, та модель кристалічної гратки.
Гіпотеза дослідження: будова речовини визначається не тільки взаємним розташуванням атомів у хімічних частинках, але і розташуванням цих хімічних частинок у просторі. Найбільш впорядкованим є розміщення атомів, молекул і іонів в кристалах , де хімічні частинки розташовані в певному порядку, утворюючи в просторі кристалічну решітку. При певних умовах утворення вони можуть мати природну форму правильних симетричних багатогранників.
Практична значимість: за нашими теоретичними дослідженнями та на основі хімічних дослідів і експериментів можна зробити висновок, що кристали повторюють геометричну форму кристалічної гратки. Цю властивість монокристалу використовують в машинобудуванні, медицині, електроніці, для виконання наукових досліджень.
|
|
ВСТУП………………………………………………………………… |
4 |
|
1. |
ТЕОРЕТИЧНА ЧАСТИНА ………………………………………… |
6 |
|
1.1. |
Типи кристалічних граток … ..……………………………………… |
6 |
|
1.1.1. |
Атомна кристалічна гратка …………………………………………... |
6 |
|
1.1.2. |
Молекулярна кристалічна гратка …………………………………… |
7 |
|
1.1.3. |
Йонна кристалічна гратка …………………………………………… |
8 |
|
1.2. |
Механізми росту кристалів………… …………………………… |
10 |
|
2. |
ПРАКТИЧНА ЧАСТИНА……………………………………………. |
10 |
|
2.1. |
Вирощування кристалів в умовах шкільної лабораторії ………. |
10 |
|
2.1.1 |
Вирощування монокристалів …………………………………… |
11 |
|
2.1.2 |
Форми росту кристалів |
13 |
|
2.1.3. |
Оформлення композиції за STEM-технологією.………………… |
13 |
|
|
ВИСНОВКИ ………………………………………………………… |
15 |
|
|
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ …………………………. |
16 |
|
|
Додатки ……………………………………………………………… |
17 |
ВСТУП
У твердих речовинах частинки розташовані у просторі суворо закономірно для кожної речовини. Щоб якось уявити цю закономірність, у тривимірному просторі об'єднаймо центри молекул прямими лініями, які перетинаються. При цьому утвориться просторовий каркас, який називають кристалічними ґратками. Місця, в яких лінії перетинаються, називають вузлами кристалічних ґраток. Залежно від природи частинок, що містяться у вузлах кристалічних ґраток, розрізняють йонні, атомні, молекулярні кристалічні гратки.
Атомні кристалічні ґратки характерні для сполук із ковалентним типом хімічного зв’язку. У вузлах таких ґраток знаходяться окремі атоми, між якими існує ковалентний зв’язок. Усі зв’язки є рівноцінними та міцними, тому речовини з таким типом кристалічної ґратки характеризуються великою твердістю, високими температурами плавлення, хімічною інертністю. Такий тип кристалічної ґратки характерний для алмазу, силіцій(IV) оксиду, бору. Молекулярні кристалічні ґратки характерні для сполук із ковалентним типом хімічного зв’язку. У вузлах таких ґраток знаходяться неполярні або полярні молекули. Унаслідок слабких сил взаємодії речовини з таким типом кристалічної ґратки мають незначну твердість, низькі температури плавлення та кипіння, характеризуються леткістю. Такий тип кристалічної ґратки характерний для кисню, йоду, води, глюкози, спиртів, нафталіну.
Таким чином, існує певний зв’язок між типом кристалічної ґратки та фізичними властивостями речовини. Тому, якщо відома будова речовини, то можна прогнозувати її властивості та, навпаки, якщо відомі властивості речовини, то можна визначити її будову. .
Щоб виростити кристал, корисно знати, які процеси управляють його ростом; чому різні речовини утворюють кристали різної форми, а деякі речовини їх зовсім не утворюють; що треба зробити, щоб вони вийшли великими і красивими.
Якщо кристалізація йде дуже повільно, виходить один великий кристал, якщо швидко - то безліч дрібних. Речовини, що складаються з одного кристалу, називають монокристалічними (приклад - алмаз), а з безлічі дрібних - полікристалічними ( метали та багато інших речовин).
Кристал - це твердий стан речовини. Він має певну форму і певну кількість граней внаслідок розташування своїх атомів. Всі кристали однієї речовини мають однакову форму, хоч і можуть відрізнятися розмірами.
Кожній хімічній речовині, що знаходиться за даних термодинамічних умов в кристалічному стані, відповідає певна кристалічна структура.
У твердих речовинах частинки розташовані у просторі суворо закономірно для кожної речовини. Якщо об'єднати центри молекул прямими лініями, які перетинаються, то утвориться просторовий каркас, який називають кристалічними ґратками. Місця, в яких лінії перетинаються, називають вузлами кристалічних ґраток.
Залежно від природи частинок, що містяться у вузлах кристалічних ґраток, розрізняють йонні, атомні, молекулярні кристалічні ґратки.
(Додатки 1)
Мінеральні кристали утворюються в ході певних геологічних процесів. Величезні кількості гарячих і розплавлених гірських порід глибоко під землею в дійсності являють собою розчини мінералів. Коли маси цих рідких або розплавлених гірських порід виштовхуються до поверхні землі, вони починають остигати.
Вони охолоджуються дуже повільно. Мінерали перетворюються на кристали, коли переходять зі стану гарячої рідини в холодну тверду форму.
Таким чином, існує певний зв’язок між типом кристалічної гратки та фізичними властивостями речовини. Тому, якщо відома будова речовини, то можна прогнозувати її властивості та, навпаки, якщо відомі властивості речовини, то можна визначити її будову.
1.ТЕОРЕТИЧНА ЧАСТИНА
1.1.Типи кристалічних граток
1.1.1. Атомна кристалічна гратка.
Кристалічна ґратка — модель для опису внутрішньої будови речовини, що являє собою геометрично правильне розміщення частинок, властиве речовині в кристалічному стані. У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені між собою ковалентними зв'язками. Ковалентні зв’язки є рівноцінними та дуже міцними.
Такі кристалічні ґратки мають лише деякі речовини у твердому стані алмаз (С), силіцій (Si) , бор (В), пісок (SiO2), кремнезем (SiC), червоний фосфор, графіт (С) та ін. (мал.. 1) 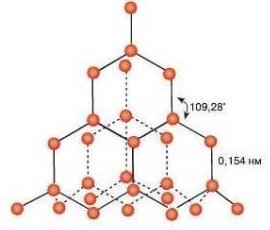

модель кристалічної гратки алмазу діамант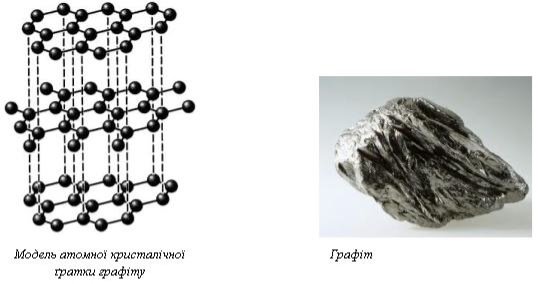
малюнок 1. Алмаз і графіт.
Наприклад, схематична ґратка алмазу (найтвердіша природна речовина з температурою плавлення 3500 °С).
Зв’язок між типом кристалічної ґратки та фізичними властивостями речовини:
• якщо відома будова речовини, то можна прогнозувати її властивості (наприклад, чим міцніший хімічний зв'язок, що утримує частинки у вузлах кристалічних ґраток, тим міцніші кристали, тим твердіша речовина, тим вищі її температури плавлення і кипіння).
• навпаки, якщо відомі властивості речовини, то можна визначити її будову.
Фізичні властивості речовин з атомною кристалічною ґраткою:
• властива велика твердість (усі зв’язки решітки є рівноцінними та міцними);
• мають дуже високі температури плавлення і кипіння;
• нелеткі, тому не мають запаху;
• не проводять електричний струм, або бувають напівпровідниками (бо нема вільних електронів);
• практично не розчиняються в жодних розчинниках.
1.1.2. Молекулярна кристалічна гратка
Кристалічна ґратка — модель для опису внутрішньої будови речовини, що являє собою геометрично правильне розміщення частинок, властиве речовині в кристалічному стані.
У вузлах молекулярних кристалічних ґраток містяться молекули як неполярні, так і полярні. Частинки сполучені між собою дуже слабкими силами міжмолекулярного тяжіння.(мал..2) 
Мал. 2. Кристалічні гратки йоду та вуглекислого газу.
Речовини з молекулярними кристалічними ґратками дуже поширені: йод (I2), нафтален, бром (Br2), вода (H2O), цукор, лід (H2O), спирт, хлор (Cl2), амоніак (NH4ОН), метан (СН4) та ін. (мал.3) 



Мал.3 Йод, бром, лід, цукор – речовини з молекулярною граткою.
Фізичні властивості речовин з молекулярною кристалічною ґраткою:
• невелика твердість (слабкі сили міжмолекулярного тяжіння);
• легкоплавкі речовини;
• леткі (здатність швидко випаровуватись), тому майже всі мають запах;
• не проводять електричний струм;
• мають різну розчинність у воді.
Наприклад, схематична ґратка йоду (кристали не дуже тверді, плавляться при температурі 30 °С):
1.1.3. Йонна кристалічна гратка
Кристалічна ґратка — модель для опису внутрішньої будови речовини, що являє собою геометрично правильне розміщення частинок, властиве речовині в кристалічному стані.
У вузлах йонних кристалічних ґраток містяться йони, причому навколо позитивного йона розташовані негативні, а навколо негативного – позитивні. Частинки сполучені між собою досить сильним йонним зв'язком, бо протилежні частинки притягуються.
Речовини з йонними кристалічними ґратками дуже поширені: кухонна сіль (NaCl), інші солі, луги, оксиди металів, гідроксиди та ін.( мал..4)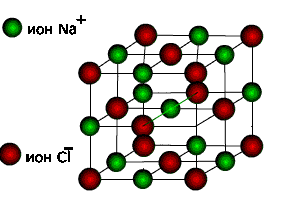


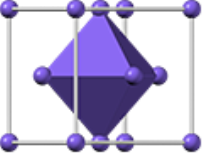

Мал 4. Кристалічні гратки та зовнішній вигляд йонних сполук:
натрій хлориду, купрум сульфату та ферум сульфіду.
В природі кристали утворюються під час різних геологічних процесів з розчинів, розплавів, газової або твердої фази.
Значна частина мінеральних видів утворилась шляхом кристалізації з водних розчинів. Приклади випадання кристалів з розчину – випадання кристалів солей в закритих водоймах; зростання кристалів на стінках порожнин при гідротермальних процесах, на великих глибинах в умовах великого тиску та температури; утворення окремих кристалів вторинних мінералів в зонах окиснення рудних родовищ.
1.1.2. Механізми росту кристалів
У процесі росту виникають або атомно-гладкі, або атомно-шорсткі грані. Атомно-гладкі грані ростуть шляхом пошарового відкладення речовини, тобто тангенціального переміщення ступенів, і залишаються в процесі росту максимально плоскими. Таке зростання називається тангенціальним або пошаровим. При цьому швидкість росту різних граней буде різна. У результаті кристали будуть рости у вигляді багатогранника.
Кристали з атомно-шорсткими гранями можуть приєднувати частинки з макроскопічної точки зору практично в будь-якій точці поверхні. Тому поверхня грані в процесі росту переміщається по нормалі до самої себе в кожній своїй точці. Таке зростання називається нормальним. При цьому швидкості росту граней кристала в різних напрямках будуть приблизно однакові і кристали набувають округлої форми ізотерм кристалізації. Дослідження морфології кристалів дає інформацію про атомні процеси, що відбуваються на поверхні зростаючого кристалу.
2. ПРАКТИЧНА ЧАСТИНА.
2.1.Вирощування кристалів в умовах шкільної лабораторії.
Вирощування кристалів в умовах шкільної хімічної лабораторії – дуже захоплююче заняття. Експерименти з вирощуванням кристалів прості, доступні, недорогі і відносно безпечні, завдяки чому зайнятися цією цікавою справою може кожен учень.
Творча група 7-Г класу вирішила вирощували монокристали з мідного купоросу, якого CuSO4*5H2O.
До початку експерименту провели необхідні розрахунки. За довідковою інформацією ми виявили, що розчинність мідного купоросу становить: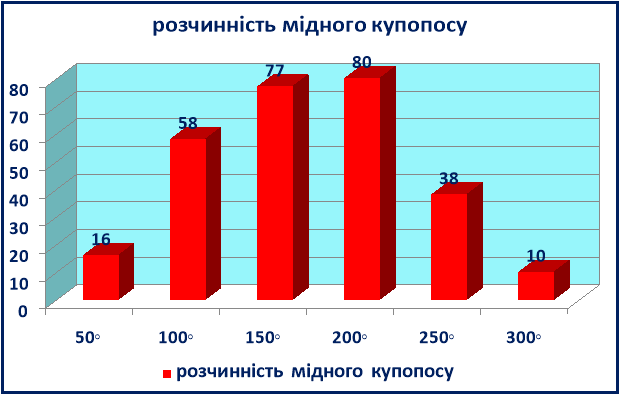
при 20° - 16 г на100г H2O;
при 60° різко зростає - 60г на100 H2O. При 200◦ відбувається утворення насиченого розчину, з якого починається при охолодженні кристалізація. Але в умовах лабораторії витримується температура приготування розчину максимум 70◦. Для досліду ми приготували ємкість (скляну банку об’ємом 700 мл), відміряли 300 мл води , зважили 60г * 3 = 180 г мідного купоросу.
2.1.1. Вирощування монокристалів.
Дуже важливими умовами для чистоти нашого експерименту стали етапи приготування пересиченого розчину та отримання чистого фільтрату.
На наступний день ми з великим подивом виявили на дня на дні колби з розчином велику кількість кристалів красивої форми розміром від 0,5 до 0,9 см. Ці новоутворені маленькі прямокутники інтенсивно блакитного кольору ми відібрали як зародки для майбутніх велетнів-монокристалів. Міцно прив’язали декілька кристалів на нитки, занурили в пересичений розчин мідного купоросу (окремо, по одному в ємкість з розчином), накрили листком паперу для захисту від пилу. Тепер залишилось чекати та додавати до основного розчину мідний купорос, щоб насиченість розчину була постійною. Кристалізацію (ріст кристалу) ми спостерігали впродовж чотирьох тижнів.(мал.. 5)






Мал 5. Учні 7-Г та 7-А класів вирощують монокристали мідного купоросу.
2.1.2. Форми росту кристалів
Через місяць наші кристали перетворилися в синіх красивих монокристалів з правильною ромбічною будовою кристалічної гратки.
Головне – вчасно фільтрувати робочий розчин, додавати сіль, щоб розчин був насиченим та слідкувати за температурою розчину. Результат нашої роботи вартий зусиль та часу, витрачених на вирощування кристалу.
(Мал.6)
Мал. 6. Кристали вирощені.
2.1.3. Оформлення композиції за STEM-технологією.
Наступне завдання стояло перед учнями 9-Г класу Ляшенко Нелею та Гавриленко Андрієм – прослідкувати залежність форми кристалу мідного купоросу від будови кристалічної гратки та шляхом інтеграції знань з хімії, математики, фізики, з використанням елементів інженерних технологій усвідомити цілісність та взаємозалежність компонентів навколишнього світу.
Учні вирішили демонстрацію кристалічної гратки та зразків кристалів мідного купоросу оформити світлодіодами. Таким чином просліджується чітка форма кристалічної гратки йонної сполуки та спостерігається повторення її в зразках кристалів.
Для оформлення композиції учні вибрали 9 найкращих кристалів, мережу світло діодів на бігучих та статичних вогнях. До гратки приєднали низку статичних світло діодів, щоб було видно форму гратки та розташування по геометричним лініям молекул мідного купоросу та молекул води. Зібравши до єдиного цілого фрагменти гратки, ми побачили підтвердження формули мідного купоросу - CuSO4 * 5H2O. (мал.. 7).





Мал. 7. Учні 9- Г класу оформлюють композицію за STEM-технологією.
ВИСНОВКИ:
Вивчивши літературу, журнальні статті, Інтернет-ресурси ми прийшли до висновку, що майже весь світ кристалічний. будова речовини визначається не тільки взаємним розташуванням атомів у хімічних частинках, але і розташуванням цих хімічних частинок у просторі. Найбільш впорядковано розміщені атоми, молекули і іони в кристалах, утворюючи в просторі кристалічну гратку.
Після проведеного дослідження по вирощуванню кристалів мідного купоросу ( CuSO4*5H2O), ми підтвердили залежність форми кристалу від будови кристалічної гратки мікрочастинок речовини – атомів, молекул, йонів та прослідкували, що фізичні та хімічні властивості речовини відповідають певному виду кристалічної гратки речовини.
Кристали за своїми властивостями є незамінними в галузях медицини, електроніки, машино добування і навіть для створення ювелірних виробів. Технологія вирощування штучних кристалів надає можливості для їх широкого використання.
П’ятого квітня 2018 року в приміщенні науково-педагогічної бібліотеки ім.Кропивницького м.Миколаєва, відбувся перший фестиваль шкільних творчих та наукових роботі зі STEM-освіти.
Учні 9-Г класу, Ляшенко Неля та Гавриленко Андрій, представили на фестиваль роботу з хімії під назвою «Від кристалічної гратки до монокристалу».
Кристали мідного купоросу виростили учні 7-Г класу. Вирощені в шкільній хімічній лабораторії монокристали мідного купоросу геометричними формами повторюють будову кристалічної гратки.
Метою дослідницької роботи було прослідкувати залежність властивостей монокристалу мідного купоросу від будови кристалічної гратки з використанням елементів інженерних технологій.
Демонстрації кристалічної гратки та зразків кристалів мідного купоросу оформлені світлодіодами на бігучих та статичних вогнях.
Захист роботи можна переглянути за посиланнями:
https://www.youtube.com/watch?v=45PLjUbIRVQ&feature=youtu.be
Досвід вирощування кристалів в лабораторних умовах був узагальнений в нашому закладі, а учні нашої школи Ляшенко Неля та Гавриленко Андрій представляли композицію «Від кристалічної гратки до монокристалу» на першому міському фестивалі учнівських творчих робіт по STEM-освіті , який відбувся в місті Миколаєві в приміщенні наукової бібліотеки ім. Кропівницького. (додаток 1).

СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ:
- https://uk.wikipedia.org/wiki/Кристал
- http://cikavo.net/cikavi-fakti-pro-kristali/
- http://bukvar.su/fizika/63943-Kristally-i-ih-svoiystva.html
- https://uk.wikipedia.org/wiki/Рідки́й криста́л
- http://www.niic.nsc.ru/science/razrabotki/619-materials/bgo/1734-bgo/
- Універсальний довідник школяра. Тернопіль: Навчальна книга «Богдан», 2005
- Хімія 8 клас. Буринська Н.М., Київ: Перун, 2008
- Хімія 8 клас. Дячук Л.С., Гладюк М.М., Тернопіль: Навчальна книга «Богдан», 2016
ДОДАТКИ
Додаток 1.




про публікацію авторської розробки
Додати розробку
