Нова тема по хімії: "властивості хімії"
Про матеріал
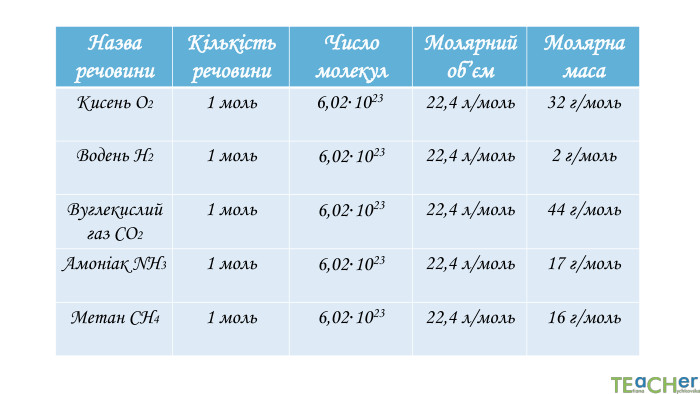
Сьогодні розглянемо нову інформацію про хімічні властивості, дуже цікава тема.............. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку