Окисно-відновні реакції. Процеси окиснення, відновлення, окисники, відновники.
Про матеріал
Відео за презентацією: https://youtu.be/crPrJuTMgR4
Що ви дізнаєтесь:
Що таке окиснення і відновлення? Розберемося в цих процесах на простих прикладах і зрозуміємо, як вони пов'язані між собою.
Хто такі окисники і відновники? Ознайомимося з ролями цих "хімічних героїв" та їхньою участю в реакціях.
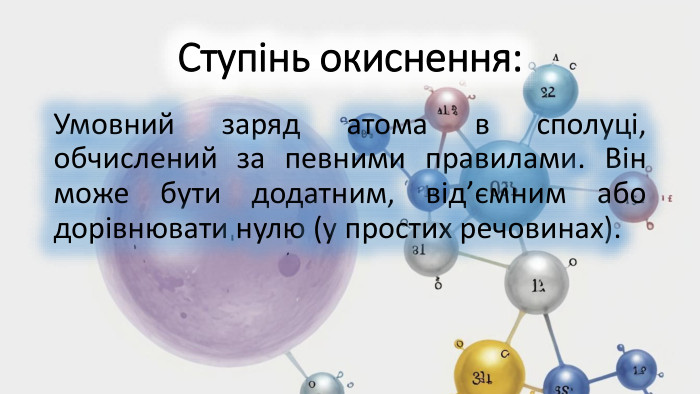
Як визначити ступінь окиснення? Навчимося легко визначати "заряд" атомів у сполуках.
Де ми зустрічаємо окисно-відновні реакції? Дізнаємося про важливість цих реакцій у природі та промисловості. Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку