Оксиген, поширеність в природі. Кисень, склад його молекули, фізичні властивості. Добування кисню в лабораторії. Реакція розкладу. Каталізатор.
Оксиген. Кисень. Добування та фізичні властивості кисню
|
Мета: |
повторити класифікацію речовин; поглибити знання учнів про хімічний елемент Оксиген та його просту речовину кисень, з’ясувати способи добування і збирання кисню, його фізичні властивості; сформувати поняття «реакція розкладу», «каталізатор»; розвивати вміння учнів працювати з текстом підручника, логічно мислити, спостерігати, робити висновки та узагальнення. |
|
Обладнання: |
мультимедійний проектор, ноутбук, презентація Power Point; опорні конспекти, картки «Лабіринт»; Н2О2, МnО2, пробірки, штатив, корок з газовідвідною трубкою, кристалізатор з водою, скіпка, сірники. |
|
Тип уроку: |
урок засвоєння нових знань. |
|
Форми роботи: |
робота в групах, самостійна робота, еврістична бесіда, елементи гри, «Мозковий штурм», «Гронування», демонстраційний експеримент. |
Хід уроку
І. Організація класу до роботи
Сіли зручно за парти, приготувались до роботи. Посміхнулись.
У нас сьогодні на уроці гості. А в Україні існує традиція доброзичливого, шанобливого ставлення до них. Тож нехай на сьогоднішньому уроці проявом гостинності будуть бадьорий настрій, кмітливий розум, творче мислення і натхненна праця протягом всього уроку. А щоб їх пробудити пропоную вправу «Шукуйте загальне»:
![]()
![]() Навч
Навч
![]()
![]() Прох ???
Прох ???
![]() Зітх
Зітх
Баж
ІІ. Актуалізація опорних знань
А тепер давайте пригадаємо ті знання, які потрібні будуть на сьогоднішньому уроці.
- Що вивчає хімія?
- З яких частинок може складатися речовина?
- Як називається певний тип атомів?
- Що таке властивості речовини?
- Які бувають властивості?
- На які групи поділяють всі речовини за складом?
- Які речовини називаються простими?
- Що таке хімічна формула?
ІІІ. Мотивація навчальної діяльності
Щоб з'ясувати тему сьогоднішнього уроку я пропоную відгадати загадку:
Я живу і не тужу,
З ким зустрінуся – дружу,
Ми удвох з моїм сусідом
Називаємось оксидом.
Друзями моїми стали
І метали, й неметали.
Феєрверк влаштую вмить,
Бо у мене все горить.
Я внизу у тропосфері,
Залечу в іоносферу.
Мною дихать – всяк мастак
Називають мене як?
(Речовина кисень та елемент, що його утворює – Оксисен)
Отже, тема уроку «Оксиген. Кисень. Добування та фізичні властивості кисню».
Завдання:
- скласти «досьє» на хімічний елемент Оксиген;
- вивчити його поширення в природі;
- з'ясувати фізичні властивості кисню;
- ознайомитись із способами добування та збирання кисню;
- встановити хто вперше добув кисень;
- засвоїти нові для вас поняття «каталізатор», «реакція розкладу».
Девізом нашого уроку будуть слова Я. А. Коменського: «Вважай нещасним той день або той час, в який ти не засвоїв нічого нового і нічого не додав до своєї освіти».
ІV. Засвоєння нових знань
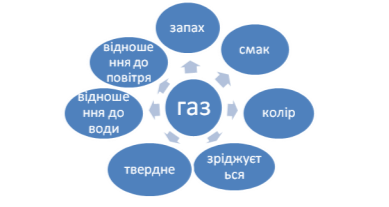
- Що ви знаєте про кисень?
На дошці заповнюється схема.
![]()
![]()
![]()
![]()
![]()
![]()
- Характеристика Оксигену.
- Самостійна робота учнів з періодичною системою і опорним конспектом.
- Обговорення результатів роботи.
- Для подальшої роботи клас розбивається на три групи.
Робота в групах з підручником Попель П.П., Крикля Л.С. Хімія, 7 клас –К.: Академія, 2007.
- І група вивчає Поширення Оксигену в природі (с.99 та п.Кисень)
- ІІ група – Відкриття кисню (с.102)
- ІІІ група – Добування кисню в промисловості (с.103).
- Обговорення роботи в групах, заповнення опорного конспекту
- Поширення Оксигену в природі.(слайди 6,7)
- Що ви можете сказати про поширення Оксигену в живій та неживій природі?
- У вигляді яких речовин зустрічається Оксиген?
- Відкриття кисню
- Хто першим добув кисень?
- Чому відкриття кисню належить двом вченим?
- Як Д. Прістлі добув кисень? (демонстрація відеофрагмента слайд 9- гіперпосилання)
- Яка заслуга А.Лавуазьє?
- Добування кисню в промисловості
- Чому в промисловості кисень добувають з повітря?
- Як проводять добування?
- Як зберігають добутий кисень?
Обережно! Трагедія в Луганську – в реанімаційному відділенні зірвалися балони з киснем.
- Добування кисню в лабораторії
- Демонстрація добування кисню розкладом калій перманганату (перегляд відеофрагменту video_01)
- Яку речовину використали для добування кисню?
- Що потрібно зробити з речовиною?
- Для чого потрібен був жмут вати?
- Як можна виявити кисень?
- Як його зібрати?
- Як потрібно розмістити посудину?
Запис рівняння
2KMnO4 = K2MnO4 + MnO2 + O2
перманганат манганат манган кисень
калію калію (IV)оксид
Ми також добудемо кисень з речовини, що є практично в кожній оселі – з гідроген пероксиду.
- Чому зберігається в темній посудині?
- Як ви гадаєте, про що свідчить термін придатності 24 місяці?
З часом гідроген пероксид перетворюється на воду, виділяючи при цьому кисень.
2Н2О2 = 2Н2О + О2
гідроген
пероксид
Але чекати так довго ми не можемо, тому скористаємось чарівним порошком.
Демонстрація добування кисню з гідроген пероксиду за участю манган(IV) оксиду.
Заповнення п.4 опорного конспекту.
- Каталізатори
- Що ж це за чарівний порошок?
Східна притча
Перед смертю запросив старий араб своїх синів, щоб розділити між ними свій спадок – 17 верблюдів. Першому сину він заповів половину спадку, другому – третину, третьому – дев'яту частину. Довго мудрували сини та нічого не змогли вдіяти. Аж поки не зустріли мудреця, що вів старого верблюда, нав'юченого книгами. Він допоміг братам, додавши свого верблюда до спадку. Розділивши спадок відповідно заповіту старого араба (перший син отримав 9 верблюдів, другий – 6, третій – 2), мудрець забрав свого верблюда і рушив далі.
Так і наш чарівний порошок – добути кисень допоміг, а сам не витратився.
Запис правила в конспект.
- Як нам перевірити, що ми добули саме кисень?
- Реакції розкладу.
- Що спільного в записаних нами рівняннях?
Висновок: Що таке реакція розкладу?
- Фізичні властивості кисню.
Робота в парах.
Завдання: Використовуючи власний досвід та фактичні дані на с.101 підручника заповнити схему.
- Способи збирання кисню
Робота за стратегією «Два-чотири-всі разом»
Заповнення п.7 Опорного конспекту.
V. Закріплення знань
- Символ Оксигену?
Його валентність?
Які утворює прості речовини?
Охарактеризуйте положення Оксигену в періодичній системі.
- Вправа 124, с.101 підручника.
- «Спіймай помилку»
- Молекула складної речовини кисень утворена двома атомами Оксигену.
- Кисень – газ без кольору, запаху, смаку, легший за повітря.
- Кисень вперше добув А.Лавуазьє.
- До складу води входить 89% кисню.
- Відносна атомна маса кисню – 8.
- Розчинений у воді Оксисен потрібний для життєдіяльності водних рослин і тварин.
- Кисень добре розчиняється у воді.
- Каталізатори – це речовини, які входять до складу продуктів реакцій.
- Чому для добування в промисловості не використовують КМnО4 і Н2О2?
- Ільф і Петров “Золоте теля”
«В маленькому номері, відведеному дирегенту симфонічного оркестру, спав Остап Бендер. Він лежав на плюшевому простирадлі, одягнутий, притискаючи до грудей валізу з мільйоном. За ніч великий комбінатор вдихнув в себе кисень, що містився в кімнаті, і хімічні елементи, що залишилися в ній, можна було назвати повітрям лише через ввічливість».
Використовуючи стратегію «Займи позицію» дайте відповідь на запитання «Чи може одна людина за ніч суттєво змінити вміст повітря в кімнаті?»
(Ні. Буде використано приблизно 72л кисню. Це менше 0,5% об’єму повітря кімнати).
- Хімічний лабіринт.
Робота в парах.
Відповідь: 1-2-5-6-10-9-13-14-11-7-3-4-8-12-15-16.
VI. Підсумки уроку
Оцінювання роботи учнів.
VII. Домашнє завдання
Вивчити § 16,17 (до с.104),виконати вправу 121 (для 7 балів), вправу 126 (для 7-12 балів); творче завдання: скласти кроссворд або загадку з теми «Оксиген. Кисень».
Додаток1
Опорний конспект
Оксиген. Кисень.
Добування та фізичні властивості
- Характеристика Оксигену
Хімічний символ –
Порядковий номер –
Період –
Номер групи, підгрупа –
Відносна атомна маса –
Валентність –
- Поширення в природі

![]()
![]() Оксиген
Оксиген
 _________________
_________________
__________________
_________________ __________________
__________________
- Відкриття кисню
1772 р. - ____________________
1774 р. - ____________________
- Добування кисню
в промисловості в лабораторії



_______________________________
_______________________________
- Речовини, що змінюють швидкість реакції, але не входять до складу її продуктів називаються ____________________
- Фізичні властивості кисню
- Способи збирання кисню
|
Спосіб |
На яких властивостях базується |
|
1.
|
|
|
2.
|
|
Додаток 2
Лабіринт (окремий додаток)
Лабіринт «Добування кисню»
|
Кисень відкрили в другій половині ХVІІІ ст. учені К.В.Шеєле і Дж.Прістлі 1 |
Так |
Дослідив кисень і назвав його oxygen А.-Л.Лавуазьє
2 |
Ні |
Реакції розкладу – реакції, під час яких із однієї речовини утворюються кілька інших 3 |
Так |
Кисень у лабораторії можна добути з речовин, формули яких: КMnO4, H2O2 4 |
|
Ні |
Так |
Ні |
Ні |
Так |
|
Так |
|
У чистому кисні скіпка горить яскравіше, ніж у повітрі 5 |
|
У промисловості кисень добувають із повітря 6 |
|
Випари ртуті дуже отруйні
7 |
Ні |
Усі реакції добування кисню в лабораторії відбуваються без каталізаторів 8 |
|
Ні |
Так |
Так |
Так |
Ні |
|
Ні |
|
Температура кипіння кисню нижча температури кипіння азоту 9 |
Ні |
Кисень одержують внаслідок сильного нагрівання повітря
10 |
|
При нагріванні меркурій (ІІ) оксиду Дж.Прістлі використовував спиртівку 11 |
Так |
Внаслідок нагрівання вода розкладається на водень і кисень
12 |
|
Так |
|
|
|
Ні |
|
Так |
|
Промислове добування кисню з повітря – явище хімічне 13 |
Ні |
Дж.Прістлі одержав кисень при термічному розкладанні меркурій (ІІ) оксиду 14 |
Ні |
Усі реакції добування кисню в лабораторії відбуваються внаслі- док нагрівання оксиге- новмісних речовин 15 |
Так |
У природі кисень утворюється внаслідок фотосинтезу в зелених листках 16 |
Література
- Програма для загальноосвітніх навчальних закладів. Хімія 7-11 класи. (Величко Л.П., Ярошенко О.Г.) – К.: Перун, 2004.
- Попель П.П., Крикля Л.С. Хімія, 7 кл.: Підручник для серед. загальноосвіт. шк. – К. Академія, 2007.
- Старовойтова І.Ю., Люсай О.В. Усі уроки хімії. 7 клас. – Харків: ВГ «Основа», 2007.


про публікацію авторської розробки
Додати розробку








