Опорні конспекти по темі "Хімічний склад клітини"
Тема уроку: Методи біологічних досліджень
Етапи наукових досліджень
- Визначення теми досліджень
- Формулювання гіпотези (припущення)
- Збір нових фактів (за допомогою методів біолог. досліджень)
- Формулювання теорії (науково-доведених тверджень)
Методи біологічних досліджень
(методи - це шляхи отримання знань)
- Емпіричні (безпосереднє вивчення живих об єктів)
- наукове спостереження: споглядання або вимірювання біолог. об єкту без втручання в нього → для вивчення його властивостей;
- порівняльно-описовий: складання опису організму чи процесу і порівняння його з іншими;
- експериментальний (дослідницький): дослідник змінює умови існування організму і спостерігає за організмом у змінених умовах;
- моніторинг - спостереження протягом тривалого часу з можливим складанням прогнозу перебігу процесу на майбутнє (приклад, прогноз погоди)
- Статистичні (знання здобуваються шляхом обробки результатів або обчислень)
- моделювання: вивчення процесу або об єкту за допомогою збільшених чи зменшених моделей (будови клітини - по 3Д-моделях; прісноводної водойми - по акваріуму);
- статистичний метод - математична обробка зібраних у природі результатів (обчислення за формулами, побудова графіків, діаграм)
Тема уроку: Білки
- полімери - молекули скл. із однакових ланок, що повторюються (мономерів);
- мономерами є амінокислоти (21 різновид), з єднуються в стрічку;
⇒ замінні - утворюються в організмі;
⇒ незамінні - не утв. в організмі, надходять з їжею;
- значна Мr (молекулярна маса)
- сполуки, що складаються із амінокислот - це пептиди, якщо пептид має Мr більше 5 000 - це білок;
- дуже різноманітні, в організмі людини - 60 000 видів білків;
- при розкладі 1г білків утв. 17,2 кДж енергії.
Класифікація білків
- За зовнішнім виглядом:
- фібрилярні (нитчасті, нерозчинні, утворюють скелет клітини і опору у міжкліт. середовищі - фібрин)
- глобулярні (кулясті, розчинні; це транспортні, регуляторні, сигнальні білки - гемоглобін)
- За будовою:
- протеїни (прості, є лише амінокислоти);
- протеїди (складні, амінокислоти + вуглеводи чи ліпіди).
Просторова структура білків
(конформація)
|
Структура |
Вигляд |
Хімічні зв язки у молекулі |
Клас за зовн.виглядом |
Представники |
|
Первинна |
амінокислоти з єднані у ланцюг (лінійна) |
пептидні |
Неробоча |
|
|
Вторинна |
ланцюг, скручений у спіраль чи “гармошкою” |
п+ водневі |
Фібрилярні, робоча |
Фібрин |
|
Третинна |
спіраль скручена у клубок (глобулу) |
п, в + дисульфідні; |
Глобулярні, робоча |
Альбумін Пепсин Каталаза |
|
Четвертинна |
кілька з єднаних глобул |
п, в, д + елекростатичні між глобулами |
Гемоглобін |
Процеси, до яких здатні білки
- Денатурація - втрата “робочої “ структури, розкручування до первинної.
- Ренатурація - повернення до “робочої” структури, скручування до нормальної структури.
- Деструкція - втрата первинної структури, розпад на амінокислоти.
Тема уроку: Ферменти, їхня роль у клітині
Загальна характеристика
- є каталізаторами – прискорювачами біохімічних процесів у клітині;
- дуже активні: значно збільшують швидкість хім.реакцій;
- мають високу специфічність (один фермент каталізує один процес);
- наука про ферменти – ензимологія;
- є активні центри (ділянки з декількох амінокислот, до яких приєднуються молекули реагентів);
- залежність активності від певних умов (рН, температури, тиску, концентрації субстрату та ферментів);
- невитратність – прискорюють реакції, але самі при цьому не витрачаються;
- їх дію регулюють інші сполуки (регуляторні білки, йони металів і кислот).
Види ферментів
- За природою (походженням):
- Ензими (білкової природи);
- Рибозими – РНК-ферменти ;
- За хім. складом:
- Прості (лише білкова частина – апофермент) – це амілаза, ліпаза, мальтоза;
- Складні (апофермент + кофактор, тобто білкова частина + небілкова) – це каталаза, ДНК-полімераза.
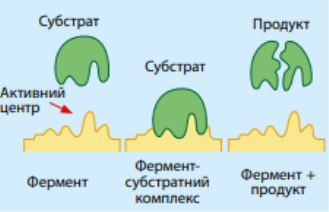
Механізм дії
Тема уроку: Вуглеводи
- найпоширеніші у природі сполуки;
- загальна формула Сn(H2O)m (тобто вуглець + вода);
- можуть бути мономерами (моносахариди) і полімерами (оліго- і дисахариди);
- за будовою бувають:
- прості - мають формулу Сn(H2O)m;
- складні - Сn(H2O)m з єднані з молекулами ліпідів, білків, неорг. речовин (глікопротеїди).
Основні класи вуглеводів (за здатністю до гідролізу):
- Моносахариди: мають 3-10 атомів С, не здатні до гідролізу, розчинні у воді, солодкі на смак (глюкоза, фруктоза (6 атомів С); рибоза, дезоксирибоза (5 атомів С)).
- Олігосахариди: мають від 2 до 10 моносахаридів, з єднаних ковалентним зв язком.
Найпоширеніші - дисахариди (скл. з двох моносахаридів, С12Н22О11), розчинні, солодкі; це сахароза, лактоза, мальтоза.
- Полісахариди - мають більше 10-ти моносахаридів, нерозчинні, несолодкі, Mr - до кількох мільйонів. Представники: агар, хітин, пектин, гуалуронова кислота, муреїн, ламінарин і ін.
За будовою ланцюга є:
- лінійні (мономери з єднані, як намисто, в одну лінію) - целюлоза, гуалуронова к-та;
- розгалуджені - глікоген, крохмаль.
Функції:
- Енергетична - при розкладі 1г виділяється 17,6 кДж енергії; розщеплюються швидко і легко.
- Структурна - покриви членистоногих (хітин);
- клітинна стінка у:
- рослин (целюлоза);
- грибів (хітин);
- бактерій (муреїн);
- Резервна - є запасними поживними речовинами у рослин (крохмаль), бурих водоростей (ламінарин); тварин і грибів (глікоген).
- Захисна - загоювання ран у рослин (камедь), у слині тварин є “склеювач” (муцин).
- Рецепторна - гліколіпіди й глікопротеїди є у складі клітинних мембран → сприймають клітинні подразнення;
- Регуляторна - моносахариди збільшують осмотичний тиск у клітині, полісахариди - зменшують.
Тема уроку: Ліпіди
Загальна характеристика
- Гідрофобні сполуки (нерозчинні у воді, розчинні у неполярних розчинниках)
- Відносяться:
- Воски (простий спирт + 1жирна кислота)
- Жири (гліцерол, тобто трьохатомний спирт + три жирних кислоти)
- Стероіди (містить кільця із атомів Карбону).
- Властивості жирів – від властивостей жирних кислот:
- чим більше атомів Карбону в ланцюзі – тим твердіший жир більша t плавлення;
- чим більше подвійних зв'язків, тим рідший жир.
- Жирні кислоти – амфіфільні;
- Тверді жири – тваринного походження, усі тверді, крім риб'ячого;
- Рідкі – рослинного, крім пальмової.
Ліпіди різних мембран
- скл.із фосфоліпідів (гліцерол + 2 жирних кислоти + сполука Фосфору);
- утворюють:
- міцели – мікроскоп. кульки; заряджені гідрофільні голівки у них ззовні, а незаряджені гідрофобні хвости із жирних кислот – у середині;
- клітинні мембрани: скл. із двох шарів фосфоліпідів (обернуті хвостами в середину)
Стероїди
- жовчні кислоти: утв. в печінці, емульгують жири в тонкому кишечнику
- стероїдні гормони (кори надниркових залоз – адреналін, норадреналін; статеві гормони – андрогени, естрогени).
Значення ліпідів:
- Структурна (у складі мембран)
- Енергетична: з 1г утв. 38,9кДж енергіі
- Запасаюча: з 1г жиру – 1,1г води (верблюди)
- Теплоізоляційна (жир кита)
- Зовнішній каркас (для нирок), амартизація.
- Захист від висихання, намокання (воски)
- Регуляторна (гормони)
Гідрофільні сполуки (гідро- вода; філіо - любов) - сполуки, розчинні у воді.
Гідрофобні сполуки (фобос - страх) - сполуки, нерозчинні у воді.
Амфіфільні - сполуки, одна частина молекули яких гідрофільна, а інша - гідрофобна.
Тема уроку: Нуклеїнові кислоти
- носії спадкової інформації;
- Мr – кілька мільйонів, тому – вони високомолекулярні;
- Лінійні нерозгалужені молекули;
- Полімери, що скл. із мономерів – нуклеотидів.
- Будова нуклеотиду:
- Один залишок ортофосфатної кислоти;
- Моносахарид (рибоза або дезоксирибоза)
- Азотиста (нітратна) основа
Види нуклеїнових кислот:
- ДНК (дизоксирибонуклеїнова кислота); містить дезоксирибозу і азотисті основи – А (аденін), Т (тимін), Г (гуанін), Ц (цитозин).
- Подвійна право закручена спіраль;
- з'єднання ланцюгів подвійної спіралі – за принципом «комплементарності»: А – Т; Г – Ц.
- між А і Т – два водневих зв'язки, між Г і Ц – три зв'язки.
- РНК (рибонуклеїнова кислота); містить рибозу і азотисті основи – А (аденін), У (урацил), Г (гуанін), Ц (цитозин)
- Одноланцюгова копія ділянки ДНК (гена)→ менша Мr ;
- Види РНК:
- іРНК або мРНК(інформаційна або матрична): копія ДНК;
- тРНК( транспортна) – переносить амінокислоти до рибосом;
- рРНК (рибосомна) – у складі рибосом.
«Робота» гена:
Ген (це ділянка ДНК) → утворюється копія (іРНК) → у рибосоми (на основі іРНК синтезують певний білок)
Основні величини молекулярної біології:
Мr (амінокислоти) = 100а.о.м.
Мr (нуклеотиду) = 345 а.о.м.
l (відстань між нуклеотидами) = 0,34нм
N(кількість нуклеотидів в одному витку ДНК) = 10шт. тому
l (довжина одного нуклеотиду) = 0,34 .![]() = 3,4нм
= 3,4нм
d (діаметр спіралі ДНК) = 2нм
V (швидкість приєднання однієї амінокислоти) = 0,2с або 5амінокислот за 1с.
Тема уроку: АТФ
(аденозинтрифосфорна кислота)
- Це універсальний спосіб зберігання енергії в клітинах;
- особливий нуклеотид, що скл. з:
- аденіну (азотиста основа);
- рибози;
- трьох залишків Н3РО4.
- утв. у мітохондріях, використовується енергія окислення речовин (їжі);
- при розкладі виділяється 80кДж енергії (стільки ж іде на утворення):
(40кДж) (40кДж)
АТФ → АДФ → АМФ
(аденозинтрифосфорна к-та) (аденозиндифосфорна к-та) (аденозинмонофосфорна к-та)
- енергія АТФ необхідна для:
- реакцій біосинтезу;
- перенесення речовин через мембрану;
- роботи скоротливих (міозин) і транспортних білків.
- види організмів за джерелом енергії:
- хемотрофи: використовують енергію хім.зв’язків їжі;
- автотрофи: викор. енергію світла.


про публікацію авторської розробки
Додати розробку