Опорний конспект з теми: "Газові закони"
Опорний конспект з теми: «Газові закони для ізопроцесів (ізос – рівний, гр. мова)»
Загальна формула: pV = ![]() RT,
RT,
де p – тиск газу у Па (паскалях); V – об’єм газу у м3; m – маса газу у кг; μ – молярна маса газу у ![]() ;
;
R – універсальна газова стала, R = 8,31 ![]() ; T – абсолютна температура газу у К (кельвін).
; T – абсолютна температура газу у К (кельвін).
|
№ |
Назва ізопроцесу |
Формула |
Фізичний зміст |
Графік |
|
1 |
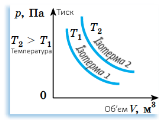
Ізотермічний Закон Бойля-Маріотта |
pV = const при T= const і m= const:
p =
V = |
Для даної маси газу m при сталій температурі T добуток pV тиску газу на його об’єм є сталою величиною.
Між тиском і об’ємом газу V при сталій температурі T існує обернено пропорційна залежність. |
Гіперболи
y = |
|
2 |
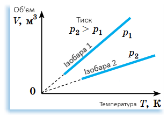
Ізобарний (гр. барос - вага) Закон Гей-Люссака |
При p= const і m = const:
V = T ∙ const
T = |
При сталому тиску p для даної маси газу m відношення об’єму V до температури T стале. Між об’ємом V і температурою газу T при сталому тиску p існує прямо пропорційна залежність. |
y = kx. На проміжку, де пунктирні лінії, газ пере- творюється на рідину. |
|
3 |
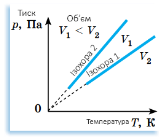
Ізохорний (гр. хора - місткість)
Закон Шарля |
При V= const і m =const:
p = T ∙ const
T = |
При сталому об’ємі V для даної маси газу m відношення тиску p до температури T стале.
Між тиском p і температурою газу T при сталому об’ємі V існує прямо пропорційна залежність. |
Прямі лінії y = kx. На проміжку, де пунктирні лінії, газ пере- творюється на рідину.
|
1


про публікацію авторської розробки
Додати розробку