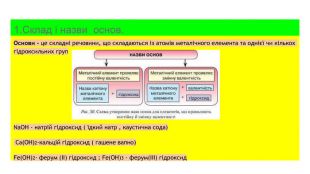
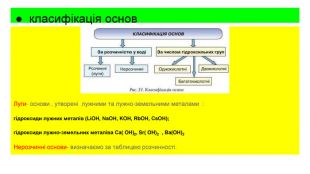
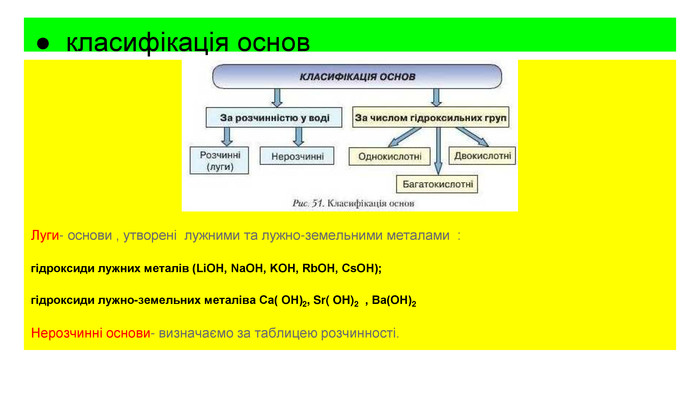
Основи, склад , назви , властивості , добування та застосування.
Про матеріал
Презентація дозволяє підготуватися учням до контрольного тесту по темі основи , їх складу . назв , властивостей , добування та застосування. ( Матеріал може бути використаний при підготовці до ЗНО з даного питання ) Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






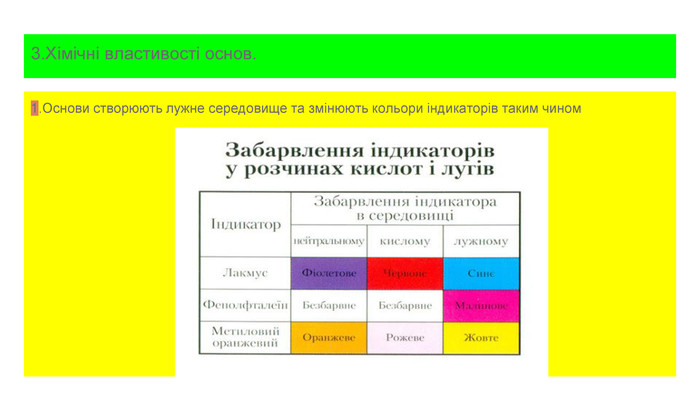




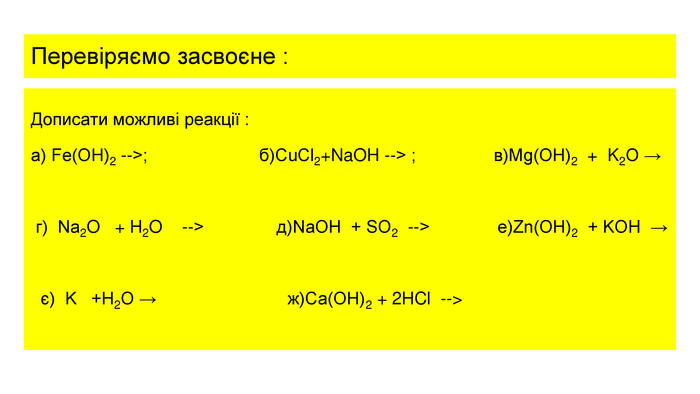
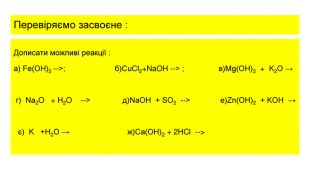
![відповідь 1. Реакція в) не відбувається , тому що основи не взаємодіють з основними оксидами.2. Реакції , що відбувавються : а) Fe(OH)2 = Fe. O + H2 O б)Cu. Cl2+2 Na. OH = Cu(OH)2+ 2 Na. Cl г)Na2 O + H2 O = 2 Na. OH д) 2 Na. OH + SO2 = Na2 SO3 + H2 O е)Zn(OH)2 + 2 KOH ( розчин) = K2[Zn(OH)4] є)2 K +2 H2 O= 2 КOH +H2 ж)Cа(OH)2 + 2 HCl = Cа. Cl2 +2 H2 O відповідь 1. Реакція в) не відбувається , тому що основи не взаємодіють з основними оксидами.2. Реакції , що відбувавються : а) Fe(OH)2 = Fe. O + H2 O б)Cu. Cl2+2 Na. OH = Cu(OH)2+ 2 Na. Cl г)Na2 O + H2 O = 2 Na. OH д) 2 Na. OH + SO2 = Na2 SO3 + H2 O е)Zn(OH)2 + 2 KOH ( розчин) = K2[Zn(OH)4] є)2 K +2 H2 O= 2 КOH +H2 ж)Cа(OH)2 + 2 HCl = Cа. Cl2 +2 H2 O](/uploads/files/1117589/174883/187522_images/13.jpg)