Патогенна дія біологічних факторів (Самостійна робота)
1
Структурний підрозділ
Медичний фаховий коледж Львівського національного медичного університету імені Данила галицького
САМОСТІЙНА РОБОТА
На тему
«Патогенна дія біологічних факторів»
Виконала
студентка 2 курсу, групи 2Г
__________________________
Львів 2022
- Класифікація інфекційних агентів: різновиди і властивості
Проникнення мікроорганізмів у внутрішнє середовище організму людини призводить до порушення гомеостазу, що проявляється комплексом фізіологічних (адаптаційних) і патологічних реакцій, відомих як інфекційний процес, або інфекція.
Спектр цих реакцій досить широкий, від безсимптомного носійства до клінічно виражених уражень. Термін «інфекція» (від лат. infectio - зараження) може визначати і безпосередньо інфекційний агент, і факт його потрапляння в організм, тому точніше застосовувати цей термін для визначення всієї сукупності реакцій між збудником і хазяїном.
За висловлюванням Мечникова, «...інфекція є боротьба між двома організмами». Відомі інфекціоністи А. Ф. Білібін і Г. П. Руднєв визначали інфекцію як складний комплекс «фізіологічних захисних і патологічних реакцій, що виникають у певних умовах зовнішнього середовища у відповідь на дію патогенних мікробів».
Сучасне наукове визначення інфекційного процесу надано В. І. Покровським: «Інфекційний процес – це комплекс пристосувальних реакцій у відповідь на потрапляння і розмноження патогенного мікроорганізму у макроорганізмі, спрямованих на відновлення порушеного гомеостазу і біологічної рівноваги із зовнішнім середовищем». Таким чином, учасники інфекційного процесу – мікроорганізм-збудник захворювання, організм хазяїна (людини) і певні, у тому числі соціальні, умови зовнішнього середовища.
Мікроорганізм представляє безпосередню причину інфекційного захворювання, визначає специфічність його клінічних проявів, впливає на перебіг та завершення хвороби. Його основні і специфічні властивості:
1. Патогенність – здатність збудника потрапляти в організм людини, жити і розмножуватися у ньому, викликати морфологічні і функціональні порушення в органах і тканинах макроорганізму, що проявляється як інфекційне захворювання. Наявність чи відсутність цієї ознаки дозволяє розділити всі мікроорганізми на патогенні, умовно-патогенні і непатогенні (сапрофітні). Патогенність визначає комплекс різноманітних властивостей мікроорганізму, що включає токсигенність збудника, адгезивність і інвазивність, наявність чи відсутність капсули, здатність до внутрішньоклітинного паразитування, антигенній мімікрії та ін.
2 Токсигенність – здатність збудника синтезувати і виділяти екзо- і ендотоксини. Екзотоксини - білки, що виділяються мікроорганізмами у процесі життєдіяльності. Вони проявляють специфічну дію, яка призводить до вибіркових патоморфологічних і патофізіологічних порушень в органах і тканинах (збудники дифтерії, правця, ботулізму, холери і ін.). Ендотоксини виділяються після загибелі і руйнування мікробної клітини. Бактеріальні ендотоксини – структурні компоненти зовнішньої мембрани практично усіх грам-негативних мікроорганізмів, які за біохімічною структурою являються ліпополісахаридними (ЛПС) комплексами. Структурно-функціональний аналіз молекули ЛПС-комплексу показав, що біологічно активним сайтом, що визначає всі основні властивості нативного препарату ЛПС-комплексу, є ліпід А. Йому притаманна значна гетерогенність, що дозволяє захисним силам організму його розпізнати. Дія ендотоксинів малоспецифічна, що визначається подібними клінічними ознаками хвороби.
3. Вірулентність – це якісне проявлення патогенності. Ознака не є стабільною, в одному штамі збудника вона здатна змінюватися у ході інфекційного процесу, у тому числі під впливом антимікробного лікування. За певних станів макроорганізму (імунодефіцитний стан - ІДС, порушення бар’єрних захисних механізмів) і умов зовнішнього середовища, причинами розвитку інфекційного захворювання можуть стати умовно-патогенні мікроорганізми і навіть сапрофіти.
4. Адгезивність і інвазивність мікроорганізмів – це здатність фіксуватися на клітинних мембранах і проникати у клітини і тканини. Цим процесам сприяє ліганд-рецепторні структури і капсули збудників, які перешкоджають поглинанню фагоцитами, а також джгутики і ферменти, які пошкоджують клітинні мембрани.
5. Здатність до внутрішньоклітинного паразитування – властивість багатьох патогенних мікроорганізмів, що реалізується шляхом пригнічення літичних ферментів клітини і розмноження у неї. У цих випадках патогенні збудники уникають дії антитіл і неспецифічних факторів захисту (комплементу, лізоциму та ін.), що суттєво впливає на форму, важкість, тривалість і завершення інфекційного захворювання.
6. Здатність до антигенної мімікрії – властивість деяких мікроорганізмів, яка забезпечується структурною подібністю мікробних антигенів із різними тканинними антигенами організму людини. За подібну схожість мікроорганізм маскується в організмі людини, що сприяє його більш тривалому паразитуванню. При цьому імунні реакції, що розвиваються, спрямовані не тільки проти мікробних антигенів, але й проти східних з ними тканинних АГ. У результаті розвиваються аутоімунні процеси, що ускладнюють перебіг інфекційного захворювання.
7. Мікробна персистенція – один з важливіших механізмів збереження збудника в організмі хазяїна, яка полягає в утворенні атипічних безстіночних форм мікроорганізму - L-форми, або фільтрівні форми. При цьому спостерігається перебудова обмінних процесів, яка виражається в уповільненні чи повній втраті ферментативних функцій,здатності зростати на елективних середовищах, втраті чутливості до антибіотиків.
Класифікація інфекційних агентів
Інфекційні агенти можна класифікувати на основі складності їхньої будови: пріони, віруси, рикетсії, хламідії, мікоплазми, бактерії, гриби, найпростіші, гельмінти.
Пріони – це живі білкові молекули, які проникають у клітини організму і здатні відтворювати собі подібних.
Віруси поділяються на ДНК-віруси і РНК-віруси. Являються найдрібнішими мікробами, у багато разів менше бактерій і рикетсій, є внутрішньоклітинними паразитами, відносяться до найбільш простих форм життя, не мають клітинної будови. Тіло вірусу складається з нуклеїнової кислоти та білкової оболонки. Після проникнення у клітину вірус звільняється від оболонки і розмножується, використовуючи в якості будівельного матеріалу речовини клітини та пригнічуючи властивий їй обмін речовин. До вірусних захворювань відносяться грип, кір, натуральна віспа, поліомієліт, енцефаліт, сказ, СНІД та ін.
Бактерії поділяють за деякими особливостями:
на основі їхньої форми - коки, палички (бацили), спірохети і вібріони;
на основі забарвлення за Грамом – грам-позтивні та грам-негативні;
на основі потреби у кисні для росту – аеробні і анаеробні.
Рикетсії і хламідії – це невеликі бактерії, які являються облігатними внутрішньоклітинними паразитами. За розмірами вони займають проміжне положення між бактеріями і вірусами.
Грибки - багатоклітинні організми рослинної природи. Більшість з них - сапрофіти, менша частина є паразитами. Вони більш стійкі у зовнішньому середовищі, ніж бактерії, добре переносять висушування і вплив сонячних променів.
Найпростіші - одноклітинні організми тваринного походження (амеби, лямблії, трихомонади, плазмодії малярії та ін.).
Інфекційні хвороби можуть бути гострими і хронічними.
У разі гострої форми хвороби збудник перебуває в організмі нетривалий час. При цьому формується різної напруженості імунітет і несприйнятливість до повторного зараження тим самим мікроорганізмом.
Якщо розвивається хронічна форма інфекційної хвороби, збудник перебуває в організмі тривалий час, а перебіг хвороби характеризується ремісіями, рецидивами, загостреннями патологічного процесу. Як правило, у разі своєчасного лікування прогноз сприятливий, хвороба закінчується видужанням.
Своєрідною формою взаємовідношень мікроорганізмів (вірусів) і макроорганізму є повільні інфекції, яким притаманні три основні ознаки:
1) дуже тривалий інкубаційний період – від кількох місяців до кількох років;
2) після появи перших клінічних симптомів – затяжний, ациклічний, прогресуючий перебіг хвороби, який закінчується надзвичайно тяжкими розладами і часто смертю;
3) патологічні зміни переважно в одному органі або в одній системі органів.
До таких, інфекцій належать СНІД, підгострий склерозуючий паненцефаліт (коровий), куру, скрепі, вроджена краснуха, сказ у тварин, гарячка Ласса, розсіяний склероз, бічний аміотрофічний склероз та ін.
Можливе повторне захворювання внаслідок нового зараження тим самим збудником. Якщо воно спостерігається безпосередньо після перенесення інфекційної хвороби, – це реінфекція, а якщо до закінчення первинної хвороби, – суперінфекція.
За ступенем патогенності мікроорганізми поділяються на:
- високопатогенні (високовірулентні);
- низькопатогені (низьковірулентні).
Високовірулентні мікроорганізми викликають захворювання у нормальному організмі, низьковірулентні — тільки в іммуносупрессованому організмі (опортуністичні інфекції).
Від місця розмноження збудника значною мірою залежить реакція організму на нього. За локалізацією розмноження розрізняють облігатні і факультативні внутрішньоклітинні і позаклітинні мікроорганізми.
Облігатні внутрішньоклітинні мікроорганізми можуть зростати і розмножуватися тільки у клітинах організму людини і використовують метаболічний апарат клітини для свого росту. Здебільшого уражуються паренхіматозні клітини.
Факультативні внутрішньоклітинні мікроорганізми можуть зростати і розмножуватися як усередині, так і поза клітинами організму людини. Внутрішньоклітинне розмноження зазвичай відбувається у макрофагах.
Позаклітинні мікроорганізми, виходячи із назви, розвиваються поза клітинами.
Відмінні ознаки інфекційних хвороб:
1) наявність специфічного збудника;
2) заразливість, коли хворий організм сам стає джерелом інфекції;
3) імунні процеси, внаслідок яких організм стає несприйнятливим до повторного зараження;
4) циклічність перебігу з чіткими періодами;
Існування мікро - і макроорганізму може бути 3 видів:
- симбіоз – існування мікроорганізму і макроорганізму на користь кожного (кишкова паличка у кишечнику);
- коменсалізм – (від франц. сommensal - співтрапезник), коли мікроорганізм і макроорганізм взаємно не впливають один на одного
- паразитизм – життя мікроорганізму за рахунок макроорганізму, що викликає розвиток хвороби.
За дії різних екзогенних та ендогенних факторів взаємовідносини між мікро - і макроорганізмом можуть бути порушені на користь мікроорганізму, який набуває патогенних властивостей. За таких умов індиферентний коменсал або нешкідливий симбіонт, стає паразитом и викликає захворювання. Такі ситуації можливі при лікуванні багатьма препаратами, перш за все, антибіотиками, які порушують встановлену рівновагу мікробної флори. Інфекційна хвороба може бути і результатом зниження активності фагоцитарної і імунної систем організму, наприклад, при лікуванні іммунодепресантами і цитостатичними засобами. Бактеріофаги, плазмодії являються носіями активних генетичних елементів, які кодують бактеріальні фактори вірулентності (наприклад, фактор адгезії, токсини або ферменти, які чинять опір антибіотикам). Вони здатні інфікувати бактерії і включатиме себе у їхній геном, у такий спосіб перетворюють попередньо безпечну бактерію у вірулентний, а чутливий до антибіотику мікроорганізм – у стійкий до нього. Обмін цими елементами між бактеріальними колоніями забезпечує одержувачів таких генів перевагами ом виживання, чи здатністю викликати захворювання.
Загальні методи діагностики інфекційних хвороб
Діагностика інфекційних хвороб є важливим підґрунтям для:
- проведення раціонального та ефективного лікування;
- прогнозування можливих варіантів подальшого перебігу захворювання та його наслідків;
- своєчасних та адекватних протиепідемічних та профілактичних заходів.
В клініці важливе значення має збір епідеміологічного анамнезу, скарг хворого та анамнезу хвороби. При клінічному обстеженні слід звернути особливу увагу на характер висипки на шкірі або слизових оболонках, характер температурної кривої – бо ці ознаки є строго специфічними для окремих інфекційних хвороб.
Лабораторні методи діагностики
Мікроскопічний метод дає змогу виявити збудника безпосередньо в матеріалі від хворого. На підставі аналізу морфологічних особливостей мікроба часом можна досить точно визначити його вид. Матеріалом для дослідження можуть бути кров, кістковий мозок, мазки чи змиви зі слизових оболонок порожнини рота і носа, сеча, виділення з уретри, випорожнення, спинномозкова рідина, слина, харкотиння, гній з карбункулів чи фурункулів тощо.
Мікробіологічне (бактеріологічне чи вірусологічне) дослідження є найбільш і достовірним методом діагностики інфекційних хвороб. Залежно від клінічних проявів хвороби, досліджують випорожнення хворого, блювотиння, промивні води шлунка, жовч, сечу, кров, спинномозкову рідину, виділення з ран, мазки зі слизових оболонок, а також матеріал, отриманий під час операції чи секції (шматочки печінки, селезінки, кишки, мезентеріального лімфовузла, червоподібного відростка, вміст кишок), залишки продуктів харчування, що були ймовірними факторами передачі збудника. Бактеріологічне дослідження проводять також для контролю ефективності лікування хворого, виявлення реконвалесцентного бактеріоносійства, джерела збудника хвороби в епідемічному осередку, обстеження осіб, які належать до декретованих груп (працівники підприємств харчової промисловості, громадського харчування, дитячих дошкільних закладів тощо).
Біологічний метод полягає у відтворенні інфекційної хвороби на тваринах. Для цього матеріалом від хворого найчастіше заражають білих мишей, гвінейських (морських) свинок. Оскільки хвороби людини повністю дуже рідко відтворюються на експериментальних тваринах, вивчають специфічні зміни в певних органах, що спричинені дією мікроба, вірусу чи токсину. Застосовують цей метод здебільшого для підтвердження діагнозу ботулізму, лептоспірозу, сказу тощо.
Імунологічний (серологічний) метод дослідження. Завдяки досягненням імунології значно розширились можливості діагностики інфекційних хвороб за допомогою методів, заснованих на специфічній взаємодії антигену з антитілом. Окрім традиційних серологічних реакцій, які застосовують для встановлення класифікаційної належності мікроба і виявлення антитіл до його антигенів у сироватці крові, широко впроваджуються методи виявлення антигенів збудника в різних біологічних субстратах хворого. Виявлення в організмі хворих специфічних антигенів рівноцінне виділенню самого збудника. Сучасні методи індикації антигенів збудника дають можливість встановити етіологію захворювання протягом кількох годин чи навіть хвилин.
Молекулярно-біологічний метод є високо специфічним. Полягає у виявленні в досліджуваному матеріалі генетичного матеріалу збудника – нуклеїнових кислот: ДНК чи РНК. Найчастіше застосовують полімеразну ланцюгову реакцію (ПЛР), яка дає змогу не лише констатувати присутність збудника в мізерній кількості (декілька клітин), але й встановити його концентрацію.
До загальноклінічних лабораторних методів діагностики відносяться загальний аналіз крові, аналіз сечі, копрограма, біохімічний аналіз (вміст білірубіну, активність амінотрансфераз у сироватці крові та ін.), коагулограма (протромбіновий індекс, фібриноген та ін.).
В оцінці загального аналізу крові має значення загальна кількість лейкоцитів, які є індикатором присутності інфекційного процесу та запалення. При бактеріальних інфекціях загальна кількість лейкоцитів частіше за все підвищена, а при вірусних інфекціях може спостерігатися лейкопенія. Деякі збудники інфекційних хвороб можуть визивати відхилення показників лейкоцитарної формули від нормальних, появу в крові атипових клітин (атипові мононуклеари при мононуклеозі). Збільшена кількість нейтрофілів, як правило, є ознакою гострої інфекції, а лімфоцитом і моноцитоз асоціюються з хронічним інфекційним процесом.
- Механізми захисту від інфекцій (специфічні та неспецифічні)
Діапазон проявів інфекційних хвороб може варіювати в дуже широких межах. На прикладі одного спалаху інфекційної хвороби можна спостерігати:
розвиток бактеріоносійства;
типову або атипову клінічну картину хвороби;
розвиток ускладнень;
загибель деяких пацієнтів.
Настільки широкий спектр клінічних проявів захворювання багато у чому пояснюється, з одного боку, різним ступенем ефективності захисних систем макроорганізму, а з іншого - патогенності збудника.
Розвиток інфекційної хвороби, як правило, супроводжується закономірною активацією захисних реакцій організму, спрямованих на виявлення, знищення або видалення збудника, а також на відновлення структурно-функціональних порушень, що розвилися у ході інфекційної хвороби.
Механізми і чинники макроорганізму, що перешкоджають проникненню і життєдіяльності у ньому збудника, і, як наслідок - виникнення і розвитку інфекційного процесу, підрозділяють на дві групи:
неспецифічні (грають роль при контакті з усіма або багатьма збудниками);
специфічні (спрямовані проти конкретного мікроорганізму).
Між різними адаптивними механізмами існує своєрідний синергізм, який посилює ефективність захисту (мал. 1).
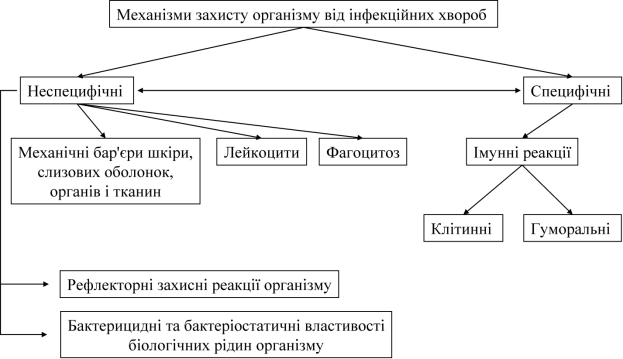
Мал. 1. Основні механізми захисту організму від збудників інфекційних хвороб.
Неспецифічні форми захисту
Неспецифічний захист організму від збудників виступає в якості першого бар'єру на шляху потрапляння збудників. До найважливіших форм неспецифічного захисту організму відносять бар'єрну функцію і бактерицидні чинники шкіри, слизових оболонок та інших структур, лейкоцити, фагоцитоз мікроорганізмів, гуморальні бактерицидні і бактеріостатичні механізми, рефлекторні захисні реакції.
Бар'єри та бактерицидні чинники
Бар'єрна функція і бактерицидні чинники шкіри, слизових оболонок та інших структур – це перша лінія неспецифічного захисту організму.
Значна частина збудників (наприклад, контактних інфекцій) проникає в організм людини через шкіру і слизові оболонки тільки за умови їх пошкодження. Шкіра має захисний роговий шар, при десквамації якого видаляється значна кількість бактерій. Бар'єрну функцію виконує також миготливий епітелій бронхів, щіткова облямівка епітелію слизової оболонки кишечника. Певна захисна роль належить гістогематичному і гематоенцефалічному бар'єру, мембранам клітин.
Протективну функцію виконує і нормальна за кількістю і співвідношенню між собою мікрофлора шкіри і слизових оболонок. Навпаки, дисбактеріоз сприяє проникненню в організм мікробів паразитів і полегшує розвиток інфекційного процесу.
Бактерицидні властивості шкіри і слизових обумовлені наявністю на їх поверхні секретів, що містять лізоцим, секреторні IgА і IgМ, глікопротеїни. Найважливіше значення серед них має IgA. Він блокує зв'язуючи ділянки на поверхні бактерій і тим самим створює перешкоду для прикріплення бактерій до специфічних рецепторів на поверхні епітеліальних клітин.
Наявність жирних кислот на поверхні шкіри створює низьке значення рН. Крім того, потові залози виробляють молочну кислоту, яка перешкоджає життєдіяльності багатьох мікроорганізмів.
Низьке значення рН шлункового соку має бактерицидну дію. У результаті шлунок є єдиною частиною шлунково – кишкового тракту, який майже повністю вільний від живих бактерій.
Лейкоцити - потужний бар'єр для більшості мікробів. Мононуклеари і гранулоцити (перш за все - нейтрофіли) надають ефективну неспецифічну бактерицидну дію на багатьох збудників інфекційного процесу як безпосередньо, так і за допомогою лейкокінів.
Фагоцитоз
Захоплення і, як правило, внутрішньоклітинне руйнування мікробів фагоцитами (нейтрофільними лейкоцитами, а також клітинами фон Купффера, Лангерханса, альвеолярними і іншими макрофагами) - один з головних механізмів протиінфекційного захисту макроорганизмів.
У процесі адгезії збудників і у найбільшій мірі після поглинання їх фагоцитами в останніх активізується комплекс механізмів інактивації і деструкції мікробів. Цей комплекс отримав назву «мікробіоцидної системи фагоцитів». Ця система представлена кисневозалежною і кісневонезалежною підсистемами.
Кисневозалежна система МСФ
Головними компонентами цієї підсистеми є: мієлопероксидаза, каталаза і активні форми кисню.
Мієлопероксидаза знаходиться в азурофільних гранулах нейтрофілів і лізосомах моноцитів / макрофагів.
Активність мієлопероксидази зростає у багато разів у присутності H2O2, що виділяється при участі бактерій, нейтрофілів, галоїдних кофакторів (у тканинах, головним чином, йоду).
Взаємодія мієлопероксидази з H2O2 супроводжується утворенням сильних окислювачів, окисленням галоідів, йодуванням і хлоруванням бактеріальних металів. Ці та інші реакції викликають деструкцію зовнішніх дисахаридів оболонок бактерій, що містять глутамін і мурамінову кислоту. Остання руйнується мурамідазою, що призводить до загибелі мікроорганізмів.
Каталаза реагує (як і мієлопероксидаза) з H2O2 і галоїдами з утворенням бактерицидних активних форм кисню, сильних окислювачів. Мієлопероксидазна і каталазна МСФ надають у процесі фагоцитозу високоефективну деструктивну дію на бактерії, віруси, гриби і мікоплазми.
Активні форми кисню. У фагоцитах при реакціях дихального вибуху утворюються синглетний кисень (1O2), радикал супероксиду (O2-), перекис водню (H2O2), гідроксильний радикал (OH-). Ці форми кисню позначають як активні (реактивні). Є докази високої бактерицидної ефективності активних форм кисню у відношенні до більшості мікробів.
Кисневонезалежна МСФ
Основні компоненти цієї підсистеми представлені лізоцимом, лактоферрином, катіонними білками, гідролазами лізосом, лізінами, факторами системи комплементу та іншими.
Лізоцим (мурамідаза) розщеплює спільно з гідролазами лізосом мурамінову кислоту пентідогліканів оболонок мікробів. Найбільш чутливі до лізоциму грампозитивні мікроби: стафілококи, стрептококи. Корінебактерії і інші грамнегативні організми піддаються меншому бактеріолітичному впливу мурамідази.
Лактоферрін у ненасиченої іонами заліза формі надає на мікроорганізми, укладені у фагосомах, бактеріостатичну дію. Останнє досягається за рахунок хелатуючого зв'язування заліза мікробів, що грає для них роль важливого ростового фактору.
Катіонні білки мають бактерицидну дію в основному на грампозитивні мікроби, укладені у фаголізосомах.
Ацидоз
У діапазоні рН 4,0-6,5 ацидоз має бактерицидну і бактеріостатичну дію.
При рН 4,0-4,5 пригнічується формування поверхневого заряду бактерій. Це супроводжується гальмуванням мембранних процесів, що і призводить до загибелі бактерій.
Накопичення H+ супроводжується утворенням у фагоцитах нітритів, хлорамінів, альдегідів, синглетного кисню (1O2) і інших факторів із вираженим бактерицидним ефектом.
В умовах ацидозу підвищується проникність мембран лізосом і їх гідролітичні властивості.
Гідролази знаходяться у первинних лізосомах у неактивному стані. Вони значно підвищують активність в умовах ацидозу, що розвивається у процесі фагоцитозу. Лізосомальні ферменти здійснюють деструкцію компонентів поглинених фагоцитами мікробів до пептидів, амінокислот, жирних кислот, нуклеотидів та інших елементарних з'єднань.
Бактерицидні і бактеріостатичні гуморальні механізми
До гуморальних бактерицидних і бактеріостатичних механізмів організму відносяться лізоцим, лакторферрин, -лізіни, трансферрин, фактори системи комплементу система та інші.
Лізоцим. Ефективно руйнує мураміновую кислоту пептідогліканів із зовнішнього боку клітинної стінки грампозитивних бактерій. Це призводить до їх осмотичного лізісу.
Лактоферрин і трансферрин - змінюють метаболізм заліза у бактеріях. Це порушує їх життєвий цикл і обумовлює загибель.
-лізіни є бактерицидними для більшості грампозитивних бактерій.
Фактори системи комплементу надають опсонізуючої дії, сприяючи фагоцитозу мікроорганізмів.
Рефлекторні захисні реакції
За допомогою рефлекторних захисних реакцій типу кашлю і блювоти з дихальних шляхів і шлунка видаляються багато збудники інфекції.
Специфічні захисні механізми
Найбільш ефективним механізмом захисту організму при інфекційному процесі є активація імунних реакцій. Мікроорганізми містять безліч різноманітних антигенних детермінант. Імунна система організму розпізнає їх як чужорідні, розвиваються гуморальні і клітинних механізми імунної відповіді.
Вхідні ворота інфекції та особливості збудника багато у чому визначають, якою переважно виявиться форма імунної відповіді - клітинною або гуморальною.
Потрапляння мікроорганізмів, які розмножуються позаклітинно, як правило, викликає переважно гуморальну імунну відповідь.
Потрапляння в організм мікробів, здатних розмножуватися внутрішньоклітинно, супроводжується активацією в основному реакцій клітинного імунітету.
Екзотоксини, що мають вирішальне значення у патогенезі ряду інфекцій (правець, дифтерія, газова гангрена), нейтралізуються антитоксинами. Якщо у крові присутні токсин, то специфічні антитіла (антитоксини) нейтралізують його, запобігаючи патогенної дії. Утворення антитоксинів при первинній інфекції зазвичай відбувається повільно, і вони не можуть ефективно захистити організм хворої людини.
Віруси, що поширюються гематогенно (наприклад, поліомієліту, кору, епідемічного паротиту), нейтралізуються переважно факторами гуморального імунітету.
Віруси, що розмножуються на місці впровадження (наприклад, грипу), при первинному інфікуванні включають у першу чергу механізми місцевого імунітету (IgA). При внутрішньоклітинному розмноженні вірусів особливого значення у противірусному захисті набуває клітинний імунітет.
При грибкових захворюваннях формується переважно клітинний імунітет.
Для збудників протозойних інфекцій характерна різноманітність антигенного складу. Глистові інвазії супроводжуються переважно стимуляцією синтезу IgE. На місці потрапляння паразиту часто знаходять інфільтрат, що складається з фагоцитів, лімфоцитів, еозинофілів, базофілів, тканинних базофілів.
За формування та підтримку довгострокового імунітету відповідальні клони довгоживучих лімфоцитів, що утворюються у результаті контакту з антигенами збудника (клітини імунологічної пам'яті). При цьому в одних випадках формується довічний імунітет, а в інших – імунітет на короткий термін.
- Умови виникнення інфекційного процесу. Розповсюдження і дисемінація інфекційних агентів в організмі.
Вони визначаються вхідними воротами інфекції, шляхами її поширення в організмі, механізмами протиінфекційної резистентності.
Вхідні ворота інфекції – це місце проникнення мікробів в макроорганізм. Такими воротами можуть бути:
• шкірні покриви (наприклад, для збудників малярії, висипного тифу, шкірного лейшманіозу);
• слизові оболонки дихальних шляхів (для збудників грипу, кору, скарлатини та ін.);
• слизові оболонки шлунково-кишкового тракту (наприклад, для збудників дизентерії, черевного тифу);
• слизова оболонка сечостатевих органів (для збудників гонореї, сифілісу та ін.);
• стінки кровоносних і / або лімфатичних судин, через які збудник надходить у кров або лімфу (наприклад, при укусах членистоногих, тварин, ін'єкціях і хірургічних втручаннях).
Вхідні ворота можуть визначати нозологічну форму захворювання. Так, потрапляння стрептокока в області мигдалин викликає ангіну, через шкіру - бешиху або піодермію, в області матки - ендометрит.
Шляхи поширення бактерій
Відомі наступні шляхи поширення бактерій в організмі:
• по міжклітинному простору (завдяки бактеріальній гіалуронідазі або дефектів епітелію);
• по лімфатичних капілярах – лімфогенно;
• по кровоносних судинах – гематогенно;
• по рідини серозних порожнин і спинномозкового каналу.
Більшість збудників має тропність до певних тканин макроорганізму. Це визначається наявністю молекул адгезії у мікробів і специфічних рецепторів у клітин макроорганізму, що веде до приєднання бактерій до рецепторів клітин мішеней.
Механізми протиінфекційної резистентності
Існують ефективні захисні системи, що перешкоджають проникненню збудників в організм, їх розмноженню і реалізації їхніх патогенних ефектів. Особливо велика роль факторів, що гальмують проникнення патогенних або умовно патогенних бактерій. Як приклад у таблиці 1 представлені основні захисні фактори шлунково-уишкового тракту.
Таблиця 1
Основні захисні фактори шлунково-кишкового тракту
|
Відділ шлунково-кишкового тракту |
Фактори захисту |
|
Ротоглотка |
Лізоцим, протеолітичні ферменти слини, секреторні Ig, ендогенна мікрофлора |
|
Шлунок |
Кисле середовище, протеолітичні ферменти, перистальтика |
|
Тонкий кишечник |
Жовчні кислоти, протеолітичні ферменти, секреторні Ig, кишкова мікрофлора, муцин, злущення епітеліоцитів, лімфоїдні утворення, перистальтика |
|
Товстий кишечник |
Кишкова мікрофлора, секреторні Ig, муцин, злущення епітеліоцитів, перистальтика |
Враховуючи наявність захисних факторів макроорганізму, потрапляння у нього інфекційного агенту не означає обов’язкового і, тим більше, негайного розвитку інфекційної хвороби. У залежності від умов інфікування і стану захисних систем, інфекційний процес може зовсім не розвиватися або перебігати у формі бактеріоносійства. В останньому випадку будь-які системні відповідні реакції організму (включаючи імунні) не виявляються.
Загальний патогенез
Взаємодія мікроорганізмів і фагоцитів
У механізмі розвитку інфекційного процесу ключову роль грає взаємодія збудників хвороб і фагоцитів. Результат цієї взаємодії визначає особливості перебігу інфекційного процесу. У класичному варіанті захисна роль фагоцитів є поглинання і знищення мікроорганізмів. Проте збудники деяких інфекційних хвороб мають резистентність до ефекторних механізмів фагоцитів і навіть здатні розмножуватися в них (наприклад, герпесвіруси, поксвіруси; ріккетсії Провацека; мікобактерія туберкульозу, мікобактерія лепри, бруцели; легіонели; найпростіші - трипаносоми, токсоплазми.
Ланки патогенезу
Інфекційний процес - типовий патологічний процес, основними загальними ланками розвитку якого являються гарячка, запалення, гіпоксія, порушення обміну речовин, а також порушення функцій органів, тканин і їх систем.
Гарячка
Гарячка являється найбільш частим компонентом інфекційних хвороб. Збудники інфекцій за допомогою первинних пірогенів стимулюють синтез і вивільнення лейкоцитами вторинних пірогенів - лейкоцитарних цитокинів. Це запускає гарячкову реакцію.
Запалення
Запалення розвивається у відповідь на потрапляння в організм чи активації у ньому інфекційного флогогеного агенту. При цьому вогнище запалення грає двобічну роль - як захисну, так і патогенну. Захисна роль полягає в обмеженні розповсюдження збудника інфекції і його токсинів, а патогенна - у викиді медіаторів запалення і пошкодженні тканин у вогнищі запалення. Це може погіршити порушення обміну речовин, функції багатьох органів, гемодинаміки, трофіки і т. д.
Гіпоксія
Порушення біологічного окислення – важливий компонент інфекційного процесу. Тип гіпоксії, яка розвивається при інфекційному процесі багато у чому залежить від особливостей інфекційної хвороби. Так, респіраторна гіпоксія може виникати у результаті пригнічуючої дії ряду токсинів на дихальний центр; циркуляторна - внаслідок порушення мікроциркуляції. Гемічного типу гіпоксія може розвиватися за рахунок зменшення числа еритроцитів (наприклад, при малярії). Тканинна гіпоксія формується внаслідок роз'єднання окислення і фосфорилювання під дією ендотоксинів (наприклад, сальмонел, шигел).
Порушення метаболізму
На початкових етапах інфекційного процесу, як правило, переважають процеси катаболічного характеру: протеоліз, ліполіз, розпад глікогену (і як наслідок - гіперглікемія). На етапі одужання катаболічні реакції змінюються стимуляцією анаболічних процесів.
Залежно від нозологічної форми, можуть переважати порушення певних видів обміну. Так, при кишкових інфекціях переважно спостерігаються розлади водно-електролітного обміну і кислотно-лужного балансу, при гепатитах - білкового, при сепсисі порушуються у більшій чи меншій мірі всі види метаболізму.
Зазначені вище ланки механізму розвитку інфекційного процесу, як правило, призводять до розладів функцій органів, тканин і їх систем.
Розлади функцій
Якщо захисні механізми виявляються недостатніми для локалізації інфекції, то відбувається її генералізація, розвиваються виражені загальні реакції різних систем організму хворого. .
Нервова система
Мікробна інвазія, особливо масивна, є причиною неспецифічних відповідей:
• розвитку стрес реакції;
• активації механізмів резистентності.
При значній інтоксикації активація центральної нервової системи змінюється її пригніченням.
При ряді інфекцій (наприклад, ботулізм) порушується і трофічна функція нервової системи.
Зміни функціонального стану центральної нервової системи призводять до перебудови діяльності органів і систем організму, спрямованої на локалізацію та знищення збудника інфекційного процесу, а також нормалізацію життєдіяльності самого організму. При цьому зміни можуть полягати як у посиленні, так і у пригніченні функції того чи іншого органу або фізіологічної системи.
При розвитку інфекційного процесу виникають також специфічні для кожної інфекції структурно-функціональні зміни у нервовій системі, що відображають особливості збудника і стан реактивності макроорганізму.
- Взаємодія мікроорганізмів і імунної системи людини
Активація імунної системи спрямована, у першу чергу, на формування імунітету. Однак, в ході інфекційного процесу можуть розвиватися імунопатологічні реакції: алергічні, імунної аутоагресії, імунодефіцити.
Алергічні реакції
Найбільш часто спостерігаються реакції гіперчутливості ІІІ типу (за Джеллом і Кумбсом). Імунокомплексні реакції виникають при масованому вивільненні антигенів у результаті загибелі мікроорганізмів у вже сенсибілізованому організмі хворого. Так, викликаний імунними комплексами гломерулонефрит часто ускладнює стрептококову інфекцію. Імунокомплексні реакції нерідко розвиваються при хронічних інфекційних хворобах бактеріальної, вірусної та грибкової етіології, при глистових інвазіях.
Реакції імунної аутоагресії
Реакції імунної аутоагресії часто супроводжують інфекційні хвороби. Причинами цього є:
модифікація під впливом мікробних факторів антигенів організму;
схожість антигенів хворого із антигенами мікроорганізму;
інтеграція вірусної ДНК з геномом хворого.
Імунодефіцити
При інфекційному процесі імунодефіцити, як правило, минущі. Виняток становлять захворювання, при яких вірус масовано вражає клітини імунної системи (наприклад, при СНІДі), блокуючи формування імунної відповіді. При хронічних інфекціях можливе зниження ефективності механізмів місцевого імунітету (наприклад, при кишкових інфекціях) або імунної системи організму у цілому (наприклад, при малярії).
Серцево-судинна система
При інфекційному процесі можуть розвиватися аритмії, коронарна недостатність, серцева недостатність, перерозподіл кровотоку, порушення мікроциркуляції. Основними причинами розвитку названих порушень є мікробні токсини, дисбаланс іонного і водного обміну, зміна фізико-хімічного стану крові.
Зовнішнє дихання
При інфекційному процесі можливе посилення функції дихальної системи змінюються її пригніченням. Основні причини цього змінення:
пригнічення токсинами (мікробними і тими, що утворюються в організмі при розвитку інфекційного процесу) активності нейронів дихального центру;
поразки збудниками (наприклад, пневмококами) органів системи дихання.
В ході інфекційного процесу можуть істотно змінюватися також функції нирок, печінки, шлунково-кишкового тракту. Як правило, ці порушення значною мірою визначаються характером збудника і розглядаються у спеціальних інструкціях.
Таблиця 2
Механізми уникнення інфекційними агентами дії захисних систем макроорганізму
|
Фактори захисту макроорганізму |
Пристосувальні механізми мікроорганизмів |
Приклад |
|
Хемотаксис |
Виділення речовин, які пригнічують хемотаксис |
Міграстатин Streptomyces, металопротеінази Legionella |
|
Фагоцитоз |
Пригнічення злиття лізосом з фагосомами |
Амонійні сполуки Mycobacterium, Leishmania |
|
Виділення токсичних для фагоцитів речовин |
Лейкоцидіни Staphylococcus, Clostridiu |
|
|
Інгібування протонного насосу у лізосомах, порушення ацидифікації лізосом |
Інгібітори Н+-АТФази Yersinia, Mycobacterium |
|
|
Інактивація перекиси водню, який виділяється фагоцитами |
Каталаза Staphylococcus, Enterococcus і інших мікроорганизмів |
|
|
Презентація антигенів у комплексі з МНС |
Порушення презентації антигенів інфікованою клітиною |
Токсины Mycobacterium, Escherichia coli |
|
Розщеплення фактора транскрипції, необхідного для експресії МНС |
Протеаза Chlamydia |
|
|
Імуноглобуліни |
Антигенна мінливість |
Campylobacter, Gonococcus, Mycoplasma і більшість мікроорганізмів |
|
Система комплементу |
Сіалізація клітинної поверхні запобігає активації компонентів комплементу (С3b) |
Залишки сіалових кислот Meningococcus і інших мікроорганізмів |
|
Адсорбція на поверхні інгібіторів С3b |
Еластаза Pseudomonas aeruginosa |
|
|
Експресія мембран-асоційованих ферментів, які гідролізують компоненти комплементу |
Протеази Borrelia, Yersinia, Pseudom |
|
|
Інактивація хемотактичних властивостей білків комплементу (С3, С5) |
Желатіназа (GelE) Enterococcus faecalis |
|
|
Цитокіни |
Блокіровка відповіді макрофагів |
Ліпоарабіноманнан Mycobacterium |
|
Індукція синтезу інтерлейкінів-10 і 12, які пригнічують апоптоз моноцитів |
Chlamydia |
Особливості імунної відповіді при інфекціях
Внесок факторів природного імунітету
Імунний захист проти інфекційних агентів може бути успішним за умов раннього початку дії захисних факторів (для обмеження інфекції), формування адекватних ефекторних механізмів (для видалення інфекційних агентів) і збереження імунологічної пам’яті після завершення процесу (для формування імунітету). Потому реалізація імунного захисту від інфекційних агентів представляє собою ланцюг взаємопов’язаних процесів, які починаються від екстрених неспецифічних механізмів природного імунітету і завершуються формуванням клітин імунологічної пам’яті.
Існує ряд факторів природного імунітету, які вступають у боротьбу практично негайно. Перш за все це фагоцити. Але їхня ефективність на даному етапі невелика: початкова кількість цих клітин у місті потрапляння інфекції недостатня для розвитку ефективної реакції, а їхні особисті можливості у відношенні розпізнавання і руйнування мікробів обмежені, оскільки ці клітини ще не активовані і перебувають у спокої. За наявності в організмі природних антитіл до мікроорганізмів, відбувається швидка опсонізація фагоцитів, що значно підвищує ефективність фагоцитозу.
Другим фактором швидкого реагування являється комплемент, активація якого альтернативним шляхом реалізується на поверхні мікробних клітин, чому сприяє відсутність на них регуляторних факторів системи комплементу. Пропердин стабілізує комплекси, які утворюються, що призводить до підвищення вмісту на поверхні мікробної клітини фіксованих фрагментів білків системи комплементу, а це, у свою чергу, сприяє розпізнаванню їх фагоцитами.
Екстрена мобілізація перелічених факторів природної резистентності відбувається у тісному зв’язку з індукцією запальної відповіді, у процесі якої зазначені механізми набувають масштабності. Найбільш ранньою подією при цьому являється активація фагоцитуючих клітин під впливом факторів інфекційних агентів, а пізніше – під впливом продуктів макрофагів і ендотеліальних клітин. Останнє призводить к підвищенню проникності судин і експресії молекул адгезії, а також синтезу цитокінів, що сприяє міграції у вогнище ураження великої кількості лейкоцитів – нейтрофілів, моноцитів, а потім і лімфоцитів. Клітини, що мігрували, виділяють запальні цитокіни (ІЛ-1, ІЛ-6, ФНПα, хемокіни) у достатньо великій кількості задля виникнення ознак запалення, включаючи загальні.
Серед загальних ознак запалення є ще одна форма антигеннеспецифічної відповіді – реакція гострої фази, в основі якої полягає посилення синтезу гепатоцитами білків гострої фази (С-реактивного білку, сироваткового амілоїду та ін.). Ці білки здатні опсонізувати мікробні клітини і активувати комплемент за класичним шляхом.
Фактори ранніх етапів захисту від патогенів спрямовані, перш за все, проти мікроорганізмів, які вільно розмножуються поза клітинним простором. Це виправдане тим, що на початкових етапах зараження внутрішньоклітинні патогени також проходять позаклітинний етап свого існування. Проте у цей період спрацьовують також деякі фактори захисту від внутрішньоклітинних агентів. У якості таких виступають інтерферони (α і β, які продукуються макрофагами і клітинами строми), а також NK-клітини, що активуються інтерферонами.
Всі події раннього захисту із залученням у цей процес факторів природної резистентності здійснюються упродовж перших 3 – 4 днів місцево, хоча за участю лейкоцитів, що мігрують у вогнище ураження. Наприкінці цього періоду підключаються антигенспецифічні фактори імунного захисту.
Адаптивний проти інфекційний імунітет
Ранні події антигенспецифічної відповіді на патогенні мікроорганізми також здійснюються локально. У найбільш звичайному місці потрапляння патогенів – слизових оболонках – раннім фактором специфічної відповіді являється реакція Т-клітин. Хоча варіабельність антигензв’язуючи центрів Т-клітин досить велика, вони розпізнають обмежене коло молекул, зокрема стресорні білки мікобактерій і ушкоджених клітин організму людини. Механізм їхньої дії полягає у цитолізі інфікованих клітин.
Аналогом Т-клітин у серозних порожнинах являються В1-клітини, які також розпізнають деякі основні антигенні маркери патогенів і, володіючи специфічністю, також являються факторами першої лінії захисту. Їхня дія реалізується у формі вироблення IgM, здатних підготовляти мікробні клітини до комплементзалежного цитолізу і нейтралізувати їхню активність.
Відхилення від класичного варіанту імунної відповіді при інфкуційних процесах
У деяких випадках особливості патогенів і їхніх антигенних субстанцій обумовлюють порушення нормального перебігу імунного процесу, що призводить до тривалого персистування збудника або до хронізації процесу.
Наслідком стійкості мікобактерій до імунних реакцій організму являється формування при туберкульозі і лепрі гранульоми. Вона представляє собою скупчення активованих макрофагів, які містять незруйновані мікобактерії, що розмножуються. Це скупчення оточене активованими Т-клітинами. У центральній зоні значна частина макрофагів гине; окрім того, деякі клітини зливаються, утворюючи симпласт, також невдовзі занепадаючий. Подібний симпласт формується і при вірусних інфекціях: віруси і деякі інші інфекційні агенти мають властивість пошкоджувати мембрани із наступною їхньою «неправильною» репарацією, у результаті чого відбувається злиття клітин. За несприятливого перебігу процесу у центрі гранульоми наростає розпад клітин, і накопичуються гнійні маси (казеозний розпад, формування каверн при туберкульозі). Розвиток гранульом, як правило, є показником неефективності імунного захисту організму.
Одним із варіантів відхилень від «правильного» ходу елімінації патогенну являється перехід вірусу у латентну фазу. Це проявляється у припиненні реплікації вірусу і формування нових вірусних часточок. Вірусний антиген припиняє експресію на поверхні клітин, і патоген стає недосяжним до імунних факторів. Імунний процес загасає до наступної фази активації вірусу. Найбільш відомі приклади такого роду – інфекції, викликані вірусами герпесу, цитомегаловірусу та ін.
Персистуванню патогену сприяє варіабельність маркерних антигенів, яка проявляється у процесі певного захворювання, наприклад, при сонній хворобі (трипаносомоз).
Крайнім проявом пристосування патогенів до умов реалізації імунної відповіді є інфекційні процеси при яких проліферація активованих лімфоцитів являється обов’язковою умовою реплікації вірусів. Наприклад, вірусний лімфоцитарний хоріоменінгіт у разі неонатального інфікування (к антигенам вірусу формується імунологічна толерантність) за умови збереження тимусзалежної ланки імунної системи, вірус розмножується у проліферуючих Т-клітинах.
Інший варіант пошкоджуючої дії патогенів, яка реалізується через імунну систему організму людини, пов'язаний із перехресною реактивністю антигенів мікро- і макроорганізму. Широко відомий приклад подібного роду – розвиток аутоімунного процесу (ревматичний аутоімунний процес, індукований стрептококовою інфекцією). При цьому з’являються антитіла, спрямовані проти епітопу, спільного для стрептококів типу А і клітин людини. Антитіла реагують із рядом тканин організму людини, які експресують перехресно реагуючий полісахарид серцевого м’язу, клапанів серця, синовіальній оболонки суглобів і, у той самий час, з епітеліальними клітинами, у тому числі із тими, що локалізуються у тимусі. Останнє зумовлене тим, що антитіла водночас специфічні до компонентів цитоскелету – кератину епітеліальних клітин.
- Стадії перебігу інфекційного процесу
Стадійність (періодичність) перебігу інфекційних хвороб є однією з патогномонічних їх особливостей. При розвитку інфекційної хвороби виділяють кілька періодів: інкубаційний, продромальний, основних проявів і завершення.
Інкубаційний період
Інкубаційний період - інтервал часу від інфікування макроорганізму до появи перших клінічних ознак хвороби - характеризується:
• розмноженням і вибірковим накопиченням мікроорганізмів у певних органах і тканинах, які у ході інфекційної хвороби найбільше і пошкоджуються;
• мобілізацією захисних механізмів організму.
Тривалість інкубаційного періоду - від декількох годин (при гострих кишкових інфекціях) до декількох років (при СНІДі, раневих інфекціях) - визначається в основному біологічними властивостями збудників, в силу чого тривалість цього періоду вважають їх видовою ознакою.
Продромальний період
Продромальний період - етап інфекційного процесу від появи перших клінічних неспецифічних проявів хвороби до повного розвитку її симптомів. Прояви:
• зниження ефективності реакцій захисту організму;
• наростання ступеню патогенності збудника (розмноження, вироблення і вивільнення ендо- та екзотоксинів);
• клінічні прояви на цьому етапі інфекційного процесу не мають характерних для даного інфекційного процесу рис. До них відносяться нездужання, дискомфорт, головний біль, лихоманка, м'язові і суглобові болі.
Продромальний період виявляється не при всіх інфекційних хворобах і зазвичай триває від декількох годин до декількох діб.
Період основних проявів
Період основних проявів (розпалу) хвороби характеризується розвитком типових для даної хвороби ознак. Вони залежать від:
• специфічних патогенних властивостей збудника;
• характеру відповідних реакцій організму, які формуються на тлі недостатності його адаптивних механізмів.
Тривалість цього періоду залежить від нозологічної форми та коливається у широких межах. Для багатьох інфекційних хвороб (кір, скарлатина, тифи) характерна відносно постійна тривалість цього періоду.
Період завершення
Період завершення інфекційних хвороб має кілька варіантів: одужання, організм гине, розвиток ускладнень, а також бацилоносійство.
Одужання
Одужання настає при сприятливому закінченні хвороби, відбувається поступове зниження вираженості і зникнення основних клінічних ознак інфекційного процесу. Одужання може бути повним і неповним.
Повне одужання хворих є найбільш частим результатом гострого інфекційного процесу і завершується видаленням з організму збудника (санацією). Для інфекційних хвороб характерно те, що клінічне одужання настає значно раніше, ніж ліквідуються структурно-функціональні порушення, що виникли при інфекційному процесі. Так, період повного відновлення функцій печінки після вірусних гепатитів становить від 6 місяців до одного року, тоді як захворювання (його клінічна маніфестація) триває 1-1,5 місяця.
Як правило, інфекційна хвороба закінчується формуванням імунітету, що забезпечує несприйнятливість організму до даної інфекції при його повторному інфікуванні.
Ефективність і тривалість набутого імунітету істотно розрізняються при різних інфекційних хворобах: від вираженого і стійкого, що практично виключає можливість повторного захворювання протягом усього життя (наприклад при натуральної віспи, кору), до слабкого і короткочасного, що допускає повторне виникнення хвороби через короткий час (наприклад, при дизентерії).
Неповне одужання характеризується збереженням залишкових явищ захворювання.
Ускладнення
У будь-якому періоді інфекційної хвороби можуть розвинутися специфічні і неспецифічні ускладнення.
До специфічних ускладнень відносять ті, розвиток яких безпосередньо пов'язаний з основними ланками патогенезу інфекційного процесу (наприклад, перфорація стінки кишечника і кишкова кровотеча при черевному тифі; гіповолемічний шок при холері і т.д.).
До неспецифічних ускладнень відносять стани, які викликані, наприклад, активацією вторинної інфекції або суперінфекцією.
Субклінічні форми
Крім клінічно виражених форм, інфекційні хвороби можуть протікати і субклінічно. При цьому у хворих після інфікування не реєструються клінічні прояви. Однак, при дослідженні імунного статусу і ряду показників життєдіяльності організму виявляються специфічні для даної інфекції зміни.
Бацилоносійство
У ряді випадків інфекційний процес супроводжується формуванням бацилоносительства - певного виду адаптації та взаємодії мікро -і макроорганізму. Для бацилоносійства характерна відсутність ефективних специфічних імунних реакцій. Воно формується у практично здорових людей, розвиток інфекційного процесу у яких обмежився первинної адгезію збудника.
- Сепсис: етіологія, патогенез, клінічні прояви, профілактика
Сепсис на сьогоднішній час є складною медичною, загально-біологічною проблемою, так як патогенетичні механізми його розвитку, підходи до лікування і профілактики мають важливе значення для розуміння загальних механізмів гомеостазу і запалення. Вивчення суті сепсису іде паралельно з намаганням дати чітке визначення цієї патології, тому що зараз підходи до його трактування є дискусійними.
Актуальність проблеми гнійно-септичних захворювань у людей різних вікових груп визначається тенденцією до їх зростання, важкістю перебігу, високою летальністю, складністю лікування, яке через безліч причин не завжди є ефективним. Гнійно-септичні захворювання є актуальною проблемою діагностики і лікування для педіатрів, хірургів, реаніматологів. За даними статистики ВООЗ у світі кожну хвилину від сепсису помирає до 14 хворих.
Сепсис трактується як генералізована форма гнійно-запальної інфекції, зумовленої умовно-патогенною бактеріальною флорою, основою патогенезу якої є бурхливий розвиток системної (генералізованої) запальної реакції організму у відповідь на первинно-септичне вогнище.
Синдром системної запальної реакції (ССЗР) – загальнобіологічна неспецифічна імуноцитологічна реакція організму людини у відповідь на дію ушкоджуючого ендогенного чи екзогенного фактора. Клінічно неможливо відрізнити патологічний стан, зумовлений системною інфекцією, від змін, викликаних продуктами розпаду тканин. Тому у 1991 році був запропонований термін синдром системної запальної відповіді (SIRS - Systemis Inflammatory Response Syndrom). Системна запальна реакція, викликана доказаною інфекцією, визначена як сепсис. Тоді ж визнано, що сепсис і його ускладнення представляють наростаючу за важкістю послідовних клінічних і патофізіологічних фаз: сепсис, тяжкий сепсис, артеріальна гіпотензія (зберігається реакція на відновлення об'єму крові), септичний шок (артеріальна гіпотензія і гіпоперфузія тканин - рефрактерність до адекватних об'ємних навантажень, необхідна інотропна підтримка міокарду), синдром поліорганної недостатності (ПОН).
ССЗВ характеризується наявністю проявів системного запалення: гарячка або гіпотермія, лейкоцитоз або лейкопенія, тахікардія, тахіпное, підвищений об'єм хвилинної вентиляції легень. Окрім того, доведено, що запуск запального каскаду при сепсисі може здійснюватись не тільки живою бактерією, але і її фрагментами (бактеріальні екзо-, ендотоксини, модуліни). Останні мають здатність активізувати викид цитокінів нейтрофілами, моноцитами, макрофагами. При цьому сепсис принципово відрізняється від інших інфекцій тим, що розвивається з участю умовно-патогенної мікрофлори, а тому вилікування можливе без повної їх елімінації з організму.
Згідно даних Ісакова Ю.Ф., для розвитку сепсису велике значення має масивність бактеріальної інфекції, яка діє на фагоцитуючі клітини макроорганізму. В зв'язку з цим автор трактує сепсис як генералізоване запалення, що розвивається у відповідь на надмірну кількість мікроорганізмів або їх фрагментів.
Однак для розвитку сепсису має значення не безпосередній вплив мікробів на організм людини, а суттєві порушення в імунній системі від стану надмірної активації («фаза гіперзапалення») до ІДС («фаза імунопаралічу»).
Концентрація в крові бактерій і /або їх фрагментів може бути неадекватною для роботи імунної системи, а може бути і надмірною, що приводить до її зриву. Надмірне мікробне навантаження у першу чергу приводить до функціональної недостатності факторів природного захисту (система фагоцитозу, комплемент). Останнє зумовлює порушення функції клітинної і гуморальної ланок імунітету, зниження резистентності організму до інфекції.
Протиінфекційні бар'єри
Надмірна концентрація мікробних агентів пригнічує систему протиінфекційного захисту організму, яка поєднує три рівні.
Перший рівень – конкурентна взаємодія з бактеріями нормальної мікрофлори людини (колонізаційна резистентність). Нераціональна антибіотикотерапія, порушення кишкового пасажу сприяють руйнуванню цього бар’єру.
Другий рівень – бар'єри на шляху інфекції: шкіра, слизові оболонки і їхній секрет з бактеріостатичними і бактерицидними властивостями, що сприяє механічному видаленню мікроорганізмів, пригніченню їх розмноження. У більшості випадків клінічними проявами сепсису передують механічні, фізичні і /або трофічні порушення цілості шкіри або слизових оболонок.
Третій рівень – фагоцитарна система організму, представлена циркулюючими в крові моноцитами і нейтрофілами, макрофагами і клітинами лімфоцитарної системи, а також імунної реакції, опосередковані антитілами. Ослаблення захисних бар'єрів сприяє проникненню мікроорганізмів у тканини і активізації фагоцитозу. При цьому відбувається лізис бактерій і презентація їх антигенів для подальших імунних реакцій. При цьому пусковим механізмом у розвитку сепсису є ліпополісахарид мембран бактерій (ендотоксин).
Етіологія сепсису
Сепсис представляє собою генералізоване інфекційне захворювання бактеріальної природи, зумовлений виключно умовно патогенною флорою. В окремих випадках, наприклад, при ІДС, сепсис може бути складовою генералізованої інфекції – бактеріально-вірусної, вірусно-бактеріально-грибкової. З часом відбувається повна еволюція етіологічної структури захворювання, пов'язана зі зміною об'єму і характеру медичної активності, преморбідного стану пацієнтів (зростання числа недоношених дітей, збільшення кількості пацієнтів з ІДС та ін). На протязі останніх 10 років роль грам-позитивних і грам-негативних умовно-патогенних мікроорганізмів в етіології сепсису стала практично рівнозначною. Це зумовлено ростом з початку 90-х років ХХ сторіччя, ростом ролі стрептококу, стафілококу, ентерококу.
Етіологічне значення мають мікроорганізми, виділені із стерильних у нормі біологічних середовищ і тканин (ліквор, кров, ексудат, біоптати) або із гнійно-запальних вогнищ. Потенційно патогенними є мікроорганізми, які колонізують ротову порожнину, слизові оболонки кишечнику, верхніх дихальних шляхів.
Серед збудників гнійної інфекції в останній час привертають увагу грам-негативні мікроорганізми сімейства ентеробактерій, які входять до складу нормальної кишкової мікрофлори, але під впливом антибактеріальної терапії все частіше спостерігаються випадки їхньої елімінації.
Р. aeruginosaе, Acinetobacter (грам-негативні бактерії) складають найскладнішу проблему нозокоміальних інфекцій завдяки високій полірезистентності до антибактеріальних препаратів. На впровадження нових груп протимікробних препаратів появляються бактерії з особливо високою резистентністю - P. maltophilia, P. cepacia, Flavobacterium meningosepticum.
У розвитку найважчих гнійно-запальних захворювань зростає роль анаеробів, які за останні роки складають до 155 усіх гемокультур. Вхідними воротами для бактероїдів і клостридій є шлунково-кишковий тракт і статеві шляхи, для анаеробних коків – дихальні шляхи. Часто при анаеробній септицемії висівається B. fragilis. Клінічними особливостями цієї інфекції є жовтяниця, септичний тромбофлебіт і метастатичні абсцеси. Серед анаеробів легеневі інфекції частіше викликають фузобактерії, пептострептококи і бактероїди, причому більшість з них продукує β-лактамазу. B. fragilis властива здатність самостійно викликати патологічний процес (формувати абсцес), а іншим необхідний синергізм бактерій - мікст інфекція.
Для розвитку сепсису важлива роль належить не стільки самим бактеріям, як ліпополісахаридам, зокрема грам-негативних бактерій. Сепсис частіше проявляється як реакція організму на надмірне мікробне навантаження, зумовлене циркуляцією у крові живих мікробів і утворенням метаболітів мікробного походження. В першу чергу це зводиться до інтерстиціального набряку, а по мірі прогресування – до клітинного енергетичного дефіциту. Нестача енергії визначає посилений розпад білку, порушення транспорту електролітів через клітинну мембрану. Клітина втрачає калій, затримує натрій і воду. У результаті розвивається внутрішньоклітинний набряк із загибеллю лізосом і збільшенням протеаз (патологічний «протеазний вибух»). Метаболічні порушення (в першу чергу, лактат-ацидоз), продукти розпаду фібрину, що утворився під час внутрішньосудинного згортання, біологічно активні аміни і протеази ще більше блокують лімфоцито-макрофагальну систему. Це ускладнює очищення організму від токсинів, сенсибілізує його до наступних токсичних впливів. Процес інтоксикації набирає лавиноподібного генералізованого характеру.
Патогенез сепсису
У патогенезі сепсису і його ускладнень провідну роль відіграють: ендогенні медіатори, порушення периферійної мікроциркуляції, пригнічення функції міокарду, зменшення транспорту і використання кисню тканинами. Доказано, що організм сам продукує речовини, які здатні викликати ССЗВ, септичний шок, ПОН. Масивне ушкодження тканин, особливо у поєднанні з грам-негативною інфекцією, супроводжується поширеною і неконтрольованою активністю мононуклеарних фагоцитів.
«Цитокінова буря». При адекватному мікробному навантаженні початковий період імунної відповіді нейтрофіли і моноцити виділяють простагландини, лейкотрієни, оксид азоту, кисневі радикали, про- і протизапальні цитокіни. Цей процес супроводжується викидом великої кількості медіаторів запалення (цитокінів) усіма клітинами організму людини, у тому числі і імунокомпетентними, що поступають в системний кровоток і викликають системну відповідь. Серед них найважливіше значення мають фактор некрозу пухлин (TNF), інтерлейкіни (IL), які утворюються у відповідь на вплив мікробних токсинів і сприяють адгезії лейкоцитів до клітин ендотелію, звільненню протеаз, арахідонових метаболітів, активізації системи згортання крові.
IL-1, IL-8 відіграє особливо важливу роль у підтриманні запалення тканин. IL-6, IL-10 посилюють дію реактантів гострої фази і імуноглобулінів, нейтралізують функції Т-лімфоцитів і макрофагів. Метаболіти арахідонової кислоти (тромбоксан А2, простагландин Е) приймають участь в розвитку гарячки, тахікардії, тахіпное, вентиляційно-перфузійних порушень, лактат-ацидозу. У розвитку запалення важливу роль відіграють лейкотрієни (LTB-4, LTC-4, LTE-4, GM-CSF, IFN-f, ліпідозв'язаний протеїн (LAP)). Останні стимулюють продукцію простагландинів, вільних радикалів, оксиду азоту, кожен з яких є сильним фактором впливу на клітинному рівні. Така направленість медіаторної відповіді на подразник трактується як ССЗВ з переважно протизапальним ефектом.
Встановлено, що надмірна запальна реакція з гіперпродукцією TNF, IL, простагландинів змінюється фазою імунопаралічу, яка характеризується зниженням активності моноцитів з підвищеним утворенням протизапальних цитокінів IL-10. Зменшення запальної реакції пояснюється компенсаторним викидом протизапальних медіаторів (IL-10, гістамін, трансформуючий ростовий фактор, серотонін, брадикінін, фактор Хагемана, фактор активації тромбоцитів, ендорфіни). Запуск компенсаторної протизапальної відповіді здійснює IL-10. Названі процеси характеризують ССЗВ з переважно протизапальною направленістю.
Однією з найважчих і найменш керованих ситуацій є змішана антагоністична реакція – дисрегуляція ССВЗ, «медіаторний хаос», «цитокінова буря».
Регуляцію антитілоутворення, стимуляцію, звільнення у системну циркуляцію білків гострої фази (CRP, α2-макроглобулін, фібриноген) з наступною активізацією комплементу класичним шляхом здійснює IL-6.
При системній відповіді на інфекційне запалення при сепсисі розвивається депресія специфічного антитілоутворення. Надмір протизапальних цитокінів (IL-10, TGF-β1) зменшує продукцію антитіл плазматичними клітинами і порушує запуск класичного шляху системи комплементу від комплексу антиген-антитіло. При цьому в передсептичному періоді спостерігається підвищення вмісту Ig і зниження вмісту IgА, IgМ, IgG на фоні різкого підвищення вмісту IgЕ. Останнє має пряме відношення до розвитку алергічних реакцій при сепсисі. Підвищення рівня IgЕ у сироватці крові при сепсисі має транзиторний характер.
Надмірна стимуляція протизапальними цитокінами Т- і В-лімфоцитів може привести до їх апоптозу – запрограмованої клітинної смерті і некрозу, що і визначає ушкоджуючий вплив ССЗВ на організм.
Ліпополісахариди (ЛПС) грам-негативних бактерій здатні викликати апоптоз альвеолярних макрофагів, що клінічно маніфестує деструктивними процесами у легеневій тканині. ЛПС-індукований апоптоз значно зростає при дії лейкотрієну-IFN і зменшується під впливом протизапальних цитокінів. Синдром ССЗВ, як неспецифічна загальнобіологічна реакція організму людини, лежить в основі усіх тяжких як інфекційних, так і неінфекційних станів (травма, ішемія, аутоімунний процес).
Оксид азоту (NO). Із стимуляцією імунної системи пов’язаний підвищений синтез ендогенного NO. Існує кореляція між його продукцією і рівновагою про- і протизапальних медіаторів. Збільшення рівня протизапальних цитокінів індукує синтез оксиду азоту ендотелієм, гепатоцитами, фагоцитуючими клітинами. Зростання концентрації протизапальних цитокінів пригнічує його продукцію. При сепсисі зростає продукція оксиду азоту слизовою оболонкою кишечнику, що веде до її ушкодження, підвищеної проникливості і сприяє транслокації бактерій.
Основним клінічним ефектом оксиду азоту є гемодинамічна нестабільність, яка розвивається за рахунок розслаблення гладких м'язів судин і приводить до гіпотензії, яка стає некорегованою навіть в умовах кардіотонічної підтримки.
У перебігу медіаторного каскаду необхідно виділити фазу впливу ендотоксину, фазу активації, медіаторну, імунопаралітичну і кінцеву фазу. Встановлено, що надмірна запальна реакція з гіперпродукцією ТNF, IL, простагландинів змінюється фазою імунопаралічу, яка характеризується зниженням активності моноцитів з підвищеним утворенням протизапальних цитокінів (IL-10, TGF-β, IL-1RA).
Зменшення запальної реакції пояснюється компенсаторним викидом протизапальних медіаторів (IL-10, гістамін, трансформуючий ростовий фактор (TGF-β, серотонін, брадикінін, фактор Хагемана, фактор активації тромбоцитів, ендорфіни). Запуск компенсаторної протизапальної відповіді здійснює IL-10.
Клінічна картина характеризується полісистемним ураженням. Основні зміни з боку органів і систем, які спостерігаються при сепсисі надані у таблиці 3.
Таблиця 3
Основні порушення з боку органів і систем, які спостерігаються при сепсисі
|
Органи, системи органів |
Порушення |
|
Система дихання |
Респіраторний алкалоз; гіпервентиляція; ослаблення роботи дихальної м'язів; задишка, ціаноз, респіраторний дистрес-синдром дорослого типу; дифузні інфільтрати в легенях; потреба у респіраторній підтримці. |
|
Серцево-судинна система |
Збільшення серцевого викиду на початку захворювання, надалі зниження; зниження периферійного опору, вазодилятація (прешок); ушкодження ендотелію, зниження судинного тонусу і АТ (ранній шок); тахікардія, тенденція до брадикардії; міокардіальна депресія, вазоконстрікція, гіпоперфузія органів; рефрактерна гіпотензія (пізній шок), необхідність гемодинамічної підтримки. |
|
Ментальний статус |
Гіпоперфузія мозку, підвищена продукція ендорфинів; дезорієнтація; затьмарена свідомість; збудження або загальмованість; ступор, кома; підвищення рівня білку в лікворі при нормальному цитозі. |
|
Сечовидільна система |
Гіпоперфузія нирок, ушкодження ниркових канальців (азотемія і олігурія); набряковий синдром. |
|
Печінка |
Збільшення розмірів печінки,жовтяниця; помірні порушення функції як ранній симптом; гіпопротеїнемія, підвищення рівня білірубіну та ферментів (АСТ, АЛТ, ЛДГ) як прогностично несприятлива ознака. |
|
Гематологічні показники |
Нейтрофільний лейкоцитоз в початковій стадії (не завжди); вакуолізація та токсична зернистість нейтрофілів (завжди); тромбоцитопенія, ДВЗ-синдром; еозинопенія; зниження сироваткового заліза (феномен перерозподілу і зв'язування з білками) як постійний симптом; кровотечі, некрози. |
|
Ендокринна система |
Недостатність надниркових залоз (зниження рівня кортизолу, гіпофункція щитоподібної залози (зниження Т3 і Т4 при нормальному ТТГ). |
Розлади дихання у ранній стадії сепсису проявляються гіпервентиляцією (тахіпное), яка приводить до розвитку дихального алкалозу і перевтоми дихальних м'язів, прогресуючої дихальної недостатності. Остання може бути усунена своєчасно інтубацією і переходом на ШВЛ. Наростання гіпоксемії, інтерстиціального набряку легень свідчить про розвиток респіраторного дистрес-синдрому (RDS), який є основною причиною смерті септичних хворих.
Кардіоваскулярна відповідь є також результатом субклітинної дисфункції і порушення метаболізму під дією комплексу цитокінів. Типовою кардіоваскулярною патологією при сепсисі є тахікардія, артеріальна гіпотензія, підвищений серцевий індекс, зниження ударного об'єму лівого шлуночка і зниження скоротливої функції міокарду. На пізніх стадіях сепсису приєднується ниркова недостатність з азотемією і олігоурією, дисфункція печінки з гіпербілірубінемією, порушенням активності амінотрансфераз, розвивається тромбоцитопенія, синдром дисемінованого внутрішньосудинного згортання крові. Можлива дисфункція ЦНС з порушенням свідомості (дезорієнтація, збудження, психоз).
Феномен бактеріальної транслокації з наступним виходом в портальну систему, надалі у системний кровоток у результаті підвищеної проникливості кишок також має велике значення в патогенезі ПОН.
Термінальний відділ клубової кишки і сліпа кишка є природним резервуаром грам-негативних бактерій. При певних патологічних станах чи захворюваннях (ішемія, ушкодження стінки кишки, геморагічний шок, кишкова непрохідність) мікроорганізми проходять через стінку кишки, досягають мезентеріальних лімфатичних вузлів, портальної циркуляції, інтра-і екстраперитонеальних органів. Якщо печінка не справляється з бар'єрною функцією, мікробні токсини попадають в загальне судинне русло.
Окрім цього, транслокація бактерій і токсинів зумовлює місцеву активацію клітин імунної системи, вироблення цитокінів та інших медіаторів. Ці процеси ще більше порушують бар'єрну функцію кишечнику і утворюється «хибне коло». Необхідно приймати до уваги те, що кишечник і асоційована з ним лімфоїдна тканина є найбільшим органом імунної системи в організмі людини.
Підвищеній проникливості кишкового бар'єру сприяють наступні фактори:
- ушкодження кишкового бар'єру (епітелію);
- порушення гемодинаміки з розвитком регіонарної гіпотензії;
- стреси;
- імунологічна недостатність;
- дисбіоз: порушення екологічного балансу нормальної кишкової флори і надмірне розмноження бактеріальної флори;
- підвищення концентрації токсинів та інших біологічно активних речовин у просвіті тонкої кишки;
- порушення процесів відновлення епітеліальних клітин слизової оболонки кишечника.
Отже, наявність мікробних маркерів в крові відображає склад мікробного пейзажу хворого, незалежно від місця існування мікробів або вогнища запалення. В умовах здорового організму маркери переважаючих в кишечнику бактеріоїдів, еубактерій і біфідобактерій або відсутні, або виявляються у невеликих кількостях у крові, що є непрямим доказом існуючої гіпотези про імунологічну толерантність до анаеробів-симбіонтів і відповідно низької ймовірності фагоцитозу цих мікробів. А тому бактерії, маркери яких визначаються в крові, необов'язково в ній є присутніми у вигляді бактеремії. Малі молекули можуть поступати у кров із місць природного розмноження (із біоценозів) і /або гнійно-запальних вогнищ іншої локалізації.
Фактори ризику розвитку сепсису:
- вік (новонароджені, немовлята, особи похилого віку);
- недоношеність (зменшення періоду гестації збільшує ризик розвитку інфекційних ускладнень);
- опіки, травми;
- тривале використання інвазивних методик діагностики і лікування;
- застосування хіміотерапії, використання імуносупресивних препаратів;
- недостатнє харчування;
- генетична схильність (неадекватність імунної відповіді, знижена імунологічна реактивність організму, схильність до тромбоутворення, недостатність системи комплементу та ін.).
Септичний шок - це надважкий клінічний синдром, який проявляється порушенням здатності організму до підтримки гемодинаміки та гомеостазу у результаті неадекватної оксигенації тканин та циркуляторних розладів, що виникають при системній запальній відповіді на інфекцію. Стійка гіпотензія та перфузійні порушення не піддаються корекції шляхом адекватної інфузійної, інотропної та вазопресорної терапії.
Для септичного шоку властивим є зменшення системного опору і артеріальна гіпотензія при збільшенні серцевого викиду. Одним із важливих моментів розвитку септичного шоку є пригнічення скоротливої здатності міокарду у результаті наростання лактат-ацидозу, підвищення протеолізу.
У розвитку септичного шоку виділяють дві стадії:
1. Гіпердинамічну – зниження периферичного опору, рефлекторно зростає робота серця (серцевий викид).
2. Гіподинамічну – порушення перфузії та оксигенації, вторинні у відношенні до регіональної вазоконстрикції і дисфункції міокарда.
Об'єктивні критерії септичного шоку:
- артеріальний тиск при двох вимірах залишається нижчим більше, як на 1/3 від вікової норми;
- зберігається артеріальна гіпотензія після проведення інфузійної терапії кристалоїдами або колоїдами, необхідність інотропної або вазопресорної підтримки;
- поєднання артеріальної гіпотензії з одним із критеріїв тяжкого сепсису (порушення свідомості, лактатемія або олігурія).
Адекватне дихання у хворих із септичним шоком звичайно зберігається до термінальної стадії, однак ШВЛ вимагає більшість з них (~ 80%). Ураження серцево-судинної системи проявляється перевагою або серцевої або судинної недостатності та їх поєднанням. В окремих випадках навіть при вазоактивній підтримці перфузія органів і артеріальний тиск не відновлюється, є ризик розвитку надниркової недостатності. Летальність при септичному шоку є високою (> 80%).
Поліорганна недостатність (ПОН)
Синдром ПОН поєднує: респіраторний дистрес-синдром дорослого типу, гостру надниркову недостатність, гостру недостатність печінки, гостру ниркову недостатність, ДВЗ-синдром, порушення функції ЦНС. При ПОН легені є першим органом, функція якого декомпенсується, що супроводжується високою летальністю. Висока вразливість легень пояснюється теорією «першого фільтру», згідно якої активовані клітини крові («нейтрофільний респіраторний викид»), цитокіни, токсини, тканинний детрит найшвидше потрапляють у легеневі капіляри.
Первинна ПОН – одночасне порушення функції двох органів на протязі перших семи днів після поступлення у відділення АІТ без подальшої дисфункції інших органів. Частіше вона не зумовлена сепсисом і розвивається наслідок безпосередніх тяжких ушкоджень органів (травма, операція, ін.).
Вторинна ПОН завжди виникає на фоні ССЗВ і пізніше, як через сім днів після поступлення у відділення або у випадку, коли інтервал часу між постановкою діагнозу ПОН і втягненням у процес одночасно максимальної кількості уражених органів складає більше 72 години.
Гострий сепсис: септикопіємія, септицемія
Сетикопіємічна форма сепсису: фебрильна температура тіла, гектична гарячка, різко виражена інтоксикація з одночасною появою гнійних вогнищ (остеомієліт, бактеріальна деструкція легень, отити, флегмони, флебіти), геморагічний синдром, анемія, втрата маси тіла, різні висипання на шкірі.
Септицемія – клінічна форма сепсису, коли різко виражені ознаки наростаючого бактеріального токсикозу при відсутності локальних гнійних процесів. При цьому суперінфекція, потрапивши у кров, обминаючи природні бар'єри, інтенсивно розмножується, осідає у тканинах, викликаючи утворення дрібних гнійників у тканинах. При цьому є характерна нейтропенія, агранулоцитоз. Появляються локальні гнійні вогнища.
Бактеріемія, тобто виділення мікроорганізмів з крові, є одним з можливих, проте не обов’язковим, проявом сепсису. Відсутність виділення збудника з крові хворого не повинно виключати можливість діагнозу при наявності вище зазначених критеріїв сепсису. Навіть при самому скрупульозному дотриманні техніки забору крові та використанні сучасних мікробіологічних технологій навіть у самих важких хворих частота виявлення бактеріемії, як правило, не переважає 45%. Клінічна значимість реєстрації бактеріемії полягає у наступному:
- підтвердження діагнозу та визначення етіології інфекційного процесу;
- доказ механізму розвитку сепсису;
- аргументація важкості перебігу патологічного процесу (септичний ендокардит та ін.);
- обґрунтування вибору або зміни режиму антибіотикотерапії;
- оцінка ефективності терапії.
Лікування сепсису
Комплексне лікування складається з консервативного і оперативного. Останнє полягає у радикальній ліквідації вогнища (некректомія).
Інтенсивна терапія включає:
• антібіотікотерапію;
• екстракорпоральну детоксикацію та гемокорекцію;
• інфузійну терапію;
• відновлення тканинної та органної перфузіі;
• імунокорекцію;
• десенсибілізацію з використанням глюкокортикоїдів та інгібіторів вільних радикалів.
Ускладнення сепсису
Головне і найнебезпечніше ускладнення - септичний шок. Сепсис може мати й інші наслідки у вигляді різної патології і захворювань: ендокардит, тромбози, пневмонія, пієліт, пролежні, емболії, гепаторенальний синдром, кровотечі.
Прогноз при сепсисі залежить від своєчасності та адекватності лікування, вірулентності мікрофлори і резистентності організму. При відносній сприятливості всіх складових у більшості випадків фахівці досягають вилікування. В інших випадках (у непрофільних стаціонарах, при не визначеному вчасно діагнозі, при серйозних супутніх захворюваннях, похилому віці пацієнтів) смертність перевищує 50%.
Профілактика сепсису полягає у дотриманні наступних рекомендації:
• зміцнення імунітету;
• мінімізація травматизму;
• своєчасне розпізнавання і лікування будь-яких вогнищ інфекції та гнійно-запальних захворювань;
• дотримання всіх правил асептики і антисептики при різних інвазивних маніпуляціях, оперативних втручаннях, інфузійній терапії і т. д.
- Туберкульоз: етіологія, патогенез, клінічні прояви, профілактика.
Туберкульоз - інфекційне захворювання, яке викликається мікобактеріями туберкульозу (МБТ) і характеризується розвитком клітинної алергії, поліморфною клінічною картиною і утворенням специфічних гранульом у різних тканинах і органах.
Туберкульоз належить до хронічних інфекційних хвороб, відомий з давніх часів. Назва хвороби походить від латинського слова tuberculum - горбик. Старі назви туберкульозу - бугорчатка і сухота, причому від останньої і пішла назва науки про туберкульоз - фтизіатрія (слово фтизіатрія від грецького слова phtisis - виснаження). На сьогодні ця хвороба залишається гострою соціальною і медичною проблемою. На туберкульоз хворіє третина населення всього світу.
Стрімко зростає захворюваність на туберкульоз і смертність від нього в Україні, що спостерігають в усіх вікових групах, але найбільше тривожить те, що й серед дітей також. В Україні інфікованість дітей МБТ, за офіційними даними, у середньому становить 18 %, та насправді - значно більше.
Основні причини підвищення захворюваності:
- глобальне зниження рівня життя населення, яке спричинило погіршення якості харчування;
- підвищена міграція населення з епідемічно несприятливих районів;
- поява стійких до специфічної терапії штамів МБТ;
- зменшення якості і масштабів проведення комплексу протитуберкульозних заходів.
Етіологія
Збудником туберкульозу є МБТ, яка відкрита у 1882 р. Робертом Кохом (тому інша назва - паличка, або бацила Коха). Є такі види мікобактерій: людський, бичачий, пташиний, мишачий. Вони відрізняються за ступенем вірулентності, патогенності, стійкості і впливом на характер перебігу хвороби. Найбільш патогенним для людини, таким, що призводить до хвороби на туберкульоз, є людський тип, менш патогенним - бичачий. МБТ стійкі у навколишньому середовищі, у воді можуть зберігатися понад 1 рік, на сторінках книг – 3 - 4 місяці, у молоці - до 10 днів. Під прямими сонячними променями гинуть за 1 - 1,5 години, під час кип'ятіння - за 5 - 10 хвилин, стійкі до впливу основ, кислот, спиртів. Основною видовою ознакою МБТ є патогенність, тобто спроможність жити і розмножуватись у тканинах живого організму.
Епідеміологія
Головним джерелом зараження є хвора на туберкульоз людина. Іноді джерелом стають хворі тварини (велика рогата худоба).
Шляхами проникнення мікобактерій туберкульозу в організм людини або тварини є: аерогенний (повітряно-крапельний і пиловий), аліментарний, контактно-побутовий, контактний (через ушкоджену шкіру) і гермінативний (внутрішньоутробний).
Аерогенний шлях є основним (90 - 95% випадків). Під час розмови і кашлю хворий на туберкульоз виділяє краплі слини і харкотиння, які поширюються на 1,5 - 2 м і перебувають у повітрі 1 - 1,5 години, а потім осідають. Такий шлях поширення мікобактерій і зараження називається повітряно-крапельним. Епідеміологічне значення цей спосіб зараження має при великому скупченні людей та за умов спілкування людей у родині. Зараження можливе при вдиханні пилу (пиловий шлях), що містить МБТ (краплі слини і харкотиння висихають і змішуються з пилом).
У приміщенні, де перебуває хворий на туберкульоз, МБТ виявляються у 30 % випадків, інколи навіть через 1,5 місяці. При дотриманні правил гігієни (знезаражування харкотиння, прибирання приміщення) повітря навіть туберкульозних закладів не містить МБТ. Інфікування чутливого організму людини відбувається при вдиханні декількох МБТ, що знаходяться у повітрі у завислому стані. Ступінь ймовірної інфікованості корелює з кількістю мікроорганізмів, що виділяються з харкотинням, і тривалістю контакту з хворим. Під час дихання більша частина крапель та пилу осідає на слизовій оболонці носа, мигдаликах, зіві. Неушкоджена слизова оболонка трахеї та бронхів є бар’єром на шляху проникнення МБТ. Це, насамперед, миготливий епітелій бронхів, слиз, що продукується залозистими клітинами, поверхнево-активні речовини (лізоцим, комплемент, пропердин, β-лізин). При невеликій кількості збудників туберкульозу й нормальному функціонуванні цих систем, МБТ елімінуються з дихальних шляхів, не завдаючи шкоди організмові. У разі травми або запалення слизової оболонки вони можуть проникнути у межі трахеї і бронхів. Однак у більшості випадків проникнення МБТ у внутрішнє середовище організму відбувається в альвеолах за умови порушення системи сурфактанту. Потім збудник потрапляє у лімфатичні судини і внутрішньогрудні лімфатичні вузли, лімфатичну грудну протоку і кров.
Аліментарний шлях проникнення інфекції спостерігається у випадках вживання харчових продуктів від хворих на туберкульоз тварин, а також забруднення МБТ їжі та посуду. Найчастіше аліментарним шляхом люди заражуються при вживанні молока від корів, хворих на туберкульоз. М’ясо і яйця тварин, хворих на туберкульоз, має менше епідеміологічне значення, бо його майже завжди перед вживанням піддають термічній обробці. При цьому збудник туберкульозу проникає у шлунок, а потім у кишки, звідки з плином лімфи заноситься у лімфовузли і кров.
Контактний шлях проникнення МБТ може спостерігатися серед хірургів та патологоанатомів, м’ясників, лаборантів, доярок, коли збудник туберкульозу потрапляє безпосередньо через ушкоджену шкіру або кон’юнктиву.
Описані рідкісні випадки внутрішньоутробного зараження плода. Як правило, жінки навіть з активними формами туберкульозу народжують доношених здорових дітей. Якщо відразу після пологів цих дітей ізолювати від матері, а потім вакцинувати і створити відповідні гігієнічно-дієтичні умови для їх розвитку, то діти виростають здоровими. Неушкоджена плацента є бар’єром на шляху проникнення МБТ з крові матері у кров плода. Внутрішньоутробна інфекція можлива лише при генералізованих формах процесу і появі туберкульозних горбиків на плаценті.
Чинниками, що спричинюють виникнення хвороби, є: зниження імунітету людини, часті хвороби верхніх дихальних шляхів, несприятливі умови життя, вологий клімат, переохолодження.
Патогенез
Після проникнення збудника в кров будь-яким із вищевказаних шляхів і первинної генералізації у багатьох органах виникають параспецифічні морфологічні зміни за типом лімфоїдної інфільтрації. У разі прогресування процесу в органах виникають вогнища туберкульозного запалення з поширенням процесу на реґіонарні лімфатичні вузли.
На відміну від ендотоксинів, екзотоксинів або ензимів, які визначаються у клітинах багатьох інших патогенних організмів, пошкоджуючі ефекти при туберкульозі значною мірою визначаються захисними реакціями організму у відповідь на наявність МБТ у тканинах. Для виживання МБТ повинні стимулювати свій захват макрофагами. У фагосомі альвеолярного макрофага МБТ починають розмножуватися, внаслідок чого повністю руйнується клітина макроорганізму. У результаті продукції АТФ-позитивних протонів і мікобактеріальних сульфатидів бактерії запобігають злиттю фагосоми з лізосомою і мають можливість уникнути руйнування макрофагами. МБТ розмножуються повільно (протягом 15 - 18 годин). Проте неконтрольоване розмноження може призвести до появи великої кількості МБТ, більше, ніж 500 млн протягом 20 днів. У тих випадках, коли процес перетравлювання МБТ блокується, відбувається руйнування макрофагів і вихід МБТ із клітин. Макрофаги виділяють у позаклітинний простір фрагменти зруйнованих мікобактерій, протеолітичні ферменти, медіатори, які активують Т-лімфоцити. Таким чином, формується імунна відповідь, яка виконує важливу роль у патогенезі туберкульозного процесу.
Локальні зміни у місці проникнення МБТ обумовлені, перш за все, реакцією полінуклеарних клітин, яка змінюється більш досконалою формою захисної реакції за участю макрофагів. Вони здійснюють фагоцитоз і руйнують МБТ. Результат взаємодії макрофагів і МБТ визначається станом імунітету, а також іншими факторами, у тому числі і тими, які обумовлюють перетравлюючу здатність макрофагів. З макрофагів МБТ потрапляють у лімфатичні судини, що дренують легеню, і утворюють окремі фокуси у лімфатичних вузлах кореня легені, далі через грудну протоку можуть поширюватися судинами кровообігу у різні органи. Фаза бактеріємії безсимптомна. Через 3 - 6 тижні в інфікованої людини розвивається гіперчутливість до збудника, а у вогнищах розташування МБТ виникає гранулематозне запалення з розвитком туберкульозної гранульоми, у центрі якої розташована ділянка казеозного некрозу (казеозу), оточеного епітеліоїдними і багатоядерними (гігантськими) клітинами Пирогова - Лангханса.
Внаслідок першої зустрічі збудника з макроорганізмом формується первинний туберкульоз – 7 - 10 % інфікованих, не здатних створити повноцінну імунну відповідь. Інші реагують на первинну туберкульозну інфекцію без клінічних проявів, визначають її тільки зміною туберкулінових реакцій. Період з моменту проникнення МБТ до появи позитивної реакції на туберкулін називається періодом «латентного мікробізму». Він триває у середньому 4 - 6 тижнів.
Первинний туберкульоз характеризується лімфотропністю, недосконалістю імунної відповіді, загальними і параспецифічними реакціями, схильністю до генералізації процесу, надалі, при формуванні достатньої імунної відповіді - самовилікуванням. Наслідок первинного туберкульозу - вогнище Гона - звапнений легеневий компонент первинного туберкульозного комплексу і кальциновані лімфатичні вузли, що не мають епідеміологічного значення.
Після первинного туберкульозу можлива гематогенна чи лімфогенна дисемінація з виявленням у легенях вогнищ продуктивного запалення.
При повторних зустрічах макроорганізму з МБТ, що супроводжуються ендогенною реактивацією старих вогнищ, формується вторинний туберкульоз, що носить органний характер і проявляється утворенням вогнища, інфільтрату або каверни без залучення до процесу лімфатичних вузлів. Основою реактивації є прогресуюче розмноження бактеріальної популяції і збільшення кількості мікобактерій. Проте досі залишається невідомим, що конкретно і які умови сприяють реверсії збудника туберкульозу, який знаходився у стані персистенції. Встановлено, що реактивація туберкульозу і розвиток різних його клінічних форм частіше спостерігається в осіб із залишковими змінами за наявності факторів, які знижують імунітет. Можливий і інший шлях розвитку вторинного туберкульозу - екзогенний, пов’язаний з новим (повторним) зараженням МБТ (суперінфекція). Проте і при екзогенному шляху розвитку вторинного туберкульозу недостатньо проникнення мікобактерій у вже інфікований організм, навіть при масивній повторній суперінфекції. Необхідна сукупність умов і факторів ризику, які знижують імунітет. Вторинний туберкульоз характеризується великою різноманітністю клінічних форм.
Основні різновиди патоморфологічних змін у легенях та інших органах характеризуються:
1) вогнищами з переважно продуктивною тканинною реакцією, сприятливим хронічним перебігом і тенденцією до загоєння;
2) інфільтративно-пневмонічними змінами з переважно ексудативною тканинною реакцією і тенденцією до розвитку казеозного некрозу або розсмоктування запальної реакції;
3) туберкульозною каверною, яка утворюється внаслідок відторгнення казеозних мас через дренажні бронхи.
Вищевказані прояви обумовлені патоморфологічними змінами, які розвиваються внаслідок недосконалої захисної відповіді. Замість того, щоб поглинути МБТ, більшість макрофагів і полінуклеарних лейкоцитів руйнуються і звільняють велику кількість високоактивних протеолітичних ферментів. Це призводить до руйнування тканин макроорганізму і тромбозу локальних кровоносних судин. Наслідком цього є «розрідження», яке стає живильним середовищем для прогресивного і стійкого росту позаклітинно розташованих МБТ. Розмноження бактерій призводить до зростання запалення доти, доки не відбудеться руйнування тканини і процес не досягне бронхів. Розріджені маси проникають у дихальні шляхи, у легенях формується порожнина.
Розмаїття патоморфологічних проявів при туберкульозі створює передумови для різноманітних туберкульозних змін, особливо при хронічному перебігу хвороби із зміною періодів загострення та затухання процесу. До цього треба додати, що із сформованих зон ураження МБТ можуть розповсюджуватися з плином крові або лімфи у неушкоджені ділянки і різні органи. Наслідок хвороби залежить від її перебігу - прогресуючого або регресуючого, ефективності лікування та можливості зворотного розвитку змін, що утворилися у процесі хвороби.
Зменшення популяції мікобактерій під впливом специфічних хіміопрепаратів далеко не завжди призводить до вилікування. Припинення туберкульозного процесу і наступне вилікування залежать не тільки від зменшення популяції МБТ, але й від здатності репаративних процесів організму забезпечити регресію туберкульозного процесу і його припинення.
До факторів, що сприяють реактивації процесу, належать різні захворювання: цукровий діабет, лімфогранулематоз, силікоз, виразкова хвороба шлунка і дванадцятипалої кишки, стан після резекції шлунка і дванадцятипалої кишки, хронічні запальні захворювання легень, психічні захворювання з депресивним синдромом, алкоголізм, стресові ситуації, СНІД, тривале вживання глюкокортикоїдів, цитостатиків та імунодепресантів. Якщо захисних сил недостатньо, то МБТ з течією лімфи і крові з первинного вогнища поширюються у різні органи, зокрема легені, кістки, шкіру тощо.
Профілактика туберкульозу
Ізоляція джерела туберкульозної інфекції - найбільш важливий протиепідемічний захід у колективі чи родині. На період бактеріовиділення припинити контактувати з хворим, тобто він має знаходитися на лікуванні у стаціонарі.
Дорослі, які знаходяться у контакті з хворим, повинні щорічно обстежуватися флюрографічно, а діти та підлітки - за допомогою туберкулінової проби. Обов’язково проводиться профілактичний курс лікування протитуберкульозними хіміопрепаратами протягом 3 місяців. На весь час перебування хворого на туберкульоз у лікарні, квартирі чи санаторії необхідно проводити поточну дезінфекцію.
Складові профілактики туберкульозу:
- Соціальна - оздоровлення умов навколишнього середовища, покращення умов життя населення, його здоров’я, проведення заходів щодо боротьби з алкоголізмом, наркоманією, тютюнокурінням та ін.
- Санітарна - передбачає заходи з попередження інфікування МБТ здорових людей і налагодження безпечного контакту з хворим туберкульозом в активній формі (особливо з бактеріовиділювачем).
- Специфічна - це вакцинація і ревакцинація вакциною БЦЖ. У вакцинованих при народженні дітей імунітет зберігається протягом 5 - 7 років.
- Хіміопрофілактика - це застосування протитуберкульозних препаратів з метою попередження туберкульозу в осіб, які мають великий ризик захворювання на нього. Серед осіб, яким проводилася хіміопрофілактика, число захворювань у 5 - 7 разів менше у порівнянні з людьми, яким вона не проводилась.


про публікацію авторської розробки
Додати розробку
