|
Тема. Поняття про Періодичну систему хімічних елементів Д.І. Менделєєва.
Цілі уроку:
• ознайомити учнів з будовою періодичної системи хімічних елементів Д. І. Менделєєва;
• сформувати початкові навички визначення положення хімічного елемента в періодичній системі;
• продовжити знайомство із символами й назвами елементів за сучасною українською номенклатурою,
• повторити матеріал попередніх уроків.
Тип уроку: комбінований.
Методи і методичні прийоми:
• словесний (бесіда, розповідь, робота з підручником, опорною схемою, періодичною системою хімічних елементів, складання опорних конспектів),
• наочний (демонстрація наочності).
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, схема опорного конспекту.
Базові поняття та терміни: хімічний елемент, період, група, головна підгрупа, побічна підгрупа, малий період, великий період, порядковий номер елемента, протони, нейтрони, електрони.
ХІД УРОКУ
І. Організаційний момент.
ІІ. Актуалізація опорних знань.
• Виконання завдань
Завдання 1
«Вірю, не вірю».
Із запропонованих тверджень виберіть вірні:
1. Хімія – це наука, яка вивчає хімічні речовини.
2. Всі хімічні речовини можуть перебувати у складі чистої речовини чи суміші.
3. Суміш є однорідною, якщо компоненти суміші можна побачити неозброєним оком.
4. Прикладами однорідних сумішей є повітря, молоко, газована вода та суміш олії з водою.
5. До неоднорідних сумішей можна віднести кров, ґрунт, дощову воду, суміш піску з водою
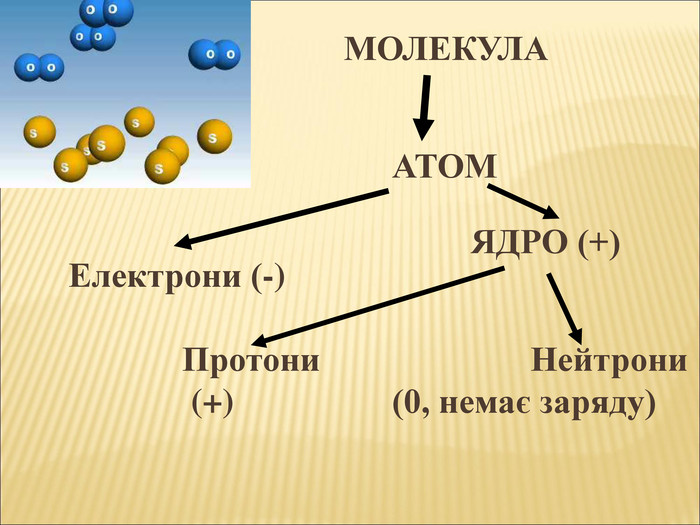
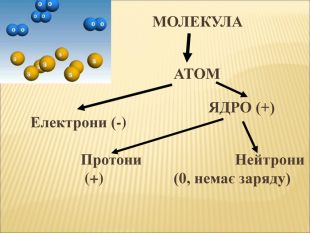
6. Речовина складається з молекул, молекули з атомів.
7. Атоми складаються з ядра та позитивно зарядженої електронної оболонки.
8. До складу ядра входять протони та нейтрони.
9. Протон має позитивний заряд.
10. Атом в цілому електронейтральний.
11. Йони, на відміну від атомів, мають позитивний чи негативний заряд.
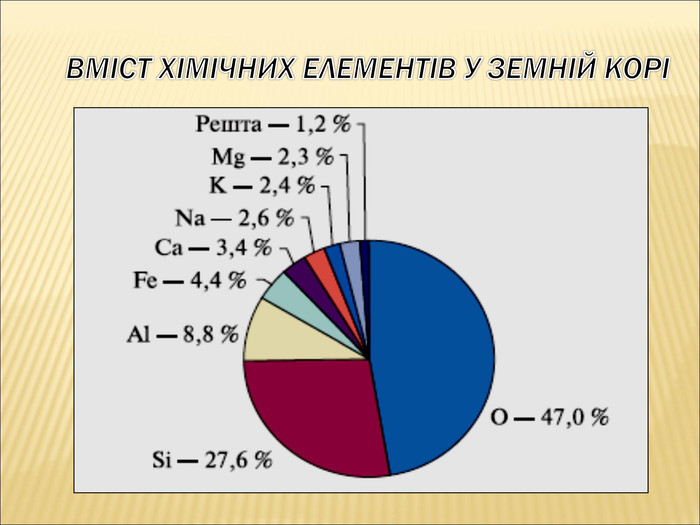
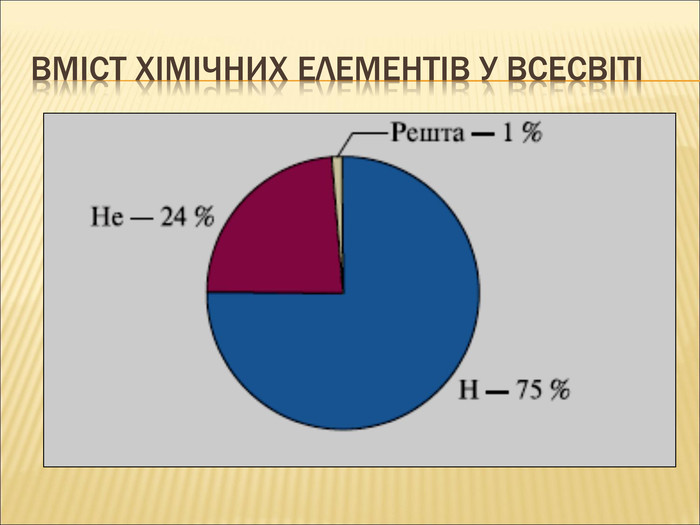
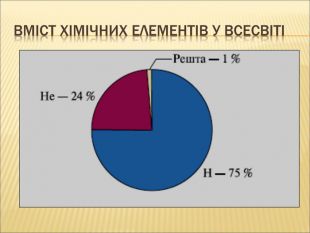
12. Найбільш розповсюдженим елементом у Всесвіті є Карбон.
Завдання 2
«Виправ помилки»
Учням пропонуються речення з помилками. Помилки треба знайти та виправити.
1. Речовина складається з молекул, які в свою чергу з протонів (атомів).
2. Атом складається з протонів та електронної оболонки (ядра).
3. Ядро має негативний заряд, електронна оболонка – позитивний (навпаки).
4. До складу ядра входить два види нуклонів, а саме: протони та електрони (нейтрони).
5. Маса протону дорівнює одиниці, заряд – негативний (позитивний).
6. Маса нейтрону дорівнює одиниці, заряд – позитивний (відсутній).
7. Маса електрону також дорівнює одиниці, а заряд – відсутній (заряд негативний, маса – відсутня).
8. Найбільш розповсюдженим елементом у Всесвіті є Гелій (Гідроген).
9. Йони мають негативний заряд (і позитивний).
10. Найбільш розповсюдженим елементом на землі є Гідроген (Оксиген).
11. Однакові за будовою протони, єднаючись між собою утворюють хімічний елемент (атоми).
12. Заряд ядра атома обумовлюють електрони (протони).
Завдання 3
«Третій зайвий».
1. Сульфур, Нітроген, кисень (Сульфур та Нітроген – хімічні елементи, кисень – речовина).
2. Протони, нейтрони, Гідроген (протони, нейтрони – нуклони ядра, а Гідроген – хімічний елемент).
3. Оксиген, водень, Гідроген (Оксиген, Гідроген – хімічні елементи, водень – речовина).
4. Золото, молоко, повітря (повітря, молоко – суміші, а золото – речовина).
5. Олія з водою, повітря, бульйон (олія з водою, бульйон – неоднорідні суміші, повітря – однорідна суміш).
6. Нітроген, Натрій, азот (Нітроген та Натрій – хімічні елементи, азот — речовина).
Завдання 4
Вказати назву хімічних елементів:
І варіант S, Na, K, Ca, H, C
ІІ варіант O, P, Cl, Mg, Al, He.
(завдання виконується письмово, кожним учнем)
Завдання 5
Усний диктант
(Вчитель вказує назву хімічного елемента, а учні піднімають картку з його символом)
Берилій, Оксиген, Флуор, Кальцій, Магній, Фосфор, Аргон, Бор, Калій, Алюміній.
- завдання виконується в тому випадку, якщо учні підготували картки.
ІІІ. Мотивація навчальної діяльності.
Чи любите ви писати листи? Мабуть так. А що ви вказуєте на конверті? (Прізвище, ім’я, адресу). А навіщо? (Щоб лист дійшов до адресату). Отже, кожна людина має своє прізвище, ім’я, адресу: місто, вулицю, будинок, квартиру.
Чи мають адресу хімічні елементи? Де їх можна знайти, якщо в цьому є потреба? На ці питання ми повинні знайти відповідь сьогодні на уроці.
( Оголошення теми та мети уроку).
ІV. Вивчення нового матеріалу
1. Структура періодичної системи Д.І. Менделєєва .
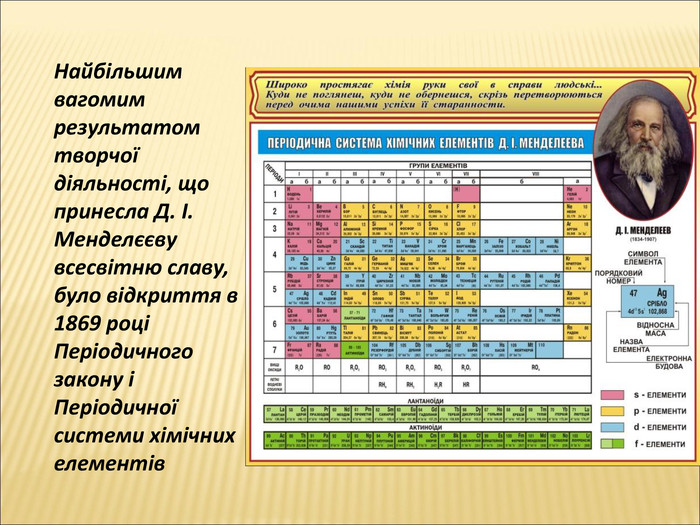
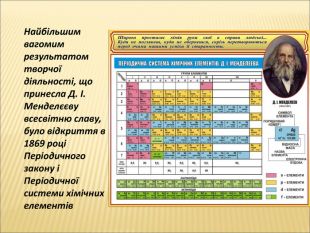
В 1861 році російським вченим Д.І. Менделєєвим була запропонована Періодична система хімічних елементів. Тоді було відомо лише 63 елементи, але всім знову відкритим елементам у ній знайшлося місце.
Ця система хімічних елементів сьогодні відома в усьому світі й використовується ученими всіх країн.
Розглянемо будову періодичної системи хімічних елементів Д.І. Менделєєва.
Основними структурними одиницями системи є періоди і групи.
Період — це горизонтальний ряд хімічних елементів, що починається лужним металом (Li, Na, K, Rb, Cs, Fr) і закінчується інертним газом (He, Ne, Ar, Kr, Xe Rn).
1. Скільки періодів містить періодична система? (Сім ).
2. Чим відрізняються між собою періоди? (Кількістю хімічних елементів, у 1-3 періодах хімічні елементи розташовані в один ряд, в інших – у два ряди).
3. Скільки хімічних елементів містить 1 період? (2).
4. Скільки хімічних елементів містить 2 та 3 періоди? (По 8 елементів).
5. Скільки хімічних елементів містить 4 період? (18 елементів).
Так, дійсно, всього періодів сім. З них перші три — малі періоди, оскільки кожний складається з одного ряду хімічних елементів. Починаючи з четвертого, ідуть великі періоди, бо кожний складається з двох рядів хімічних елементів. Всього рядів десять.
Кожний період містить певне число хімічних елементів:
1-й період (малий) —2 елементи; 2-й період (малий) — 8 елементів; 3-й період (малий) — 8 елементів; 4-й період (великий) — 18 елементів; 5-й період (великий) — 18 елементів; 6-й період (великий) — 32 елементи; 7-й період (великий) —досі ще не завершений, містить 24 елементи.
Група — це вертикальний стовпчик, у якому один під одним розміщені подібні за властивостями хімічні елементи.
6. Скільки груп містить періодична система? ( 8).
Так, дійсно, всього груп вісім. Кожна з них поділяється на дві підгрупи:
а) головну, до складу якої входять елементи малих і великих періодів,
б) побічну, яка складається тільки з елементів великих періодів,
Так, сьома група складається з головної підгрупи — це підгрупа галогенів: Флуор, Хлор, Бром, Іод, Астат, і побічної, до складу якої входять елементи тільки великих періодів — Манган, Технецій, Реній.
-
Завдання 1
До якої підгрупи належать слідуючи хімічні елементи: Сульфур, Фосфор, Хлор, Купрум, Цинк, Алюміній, Селен.
Особливу будову має VIII група. Її головна підгрупа — інертні гази, а побічна складається з трьох тріад, що об'єднуються в природні родини:
Ферум Fе, Кобальт Со, Нікель Ni;
Рутеній Ru, Родій Rh, Паладій Рd;
Осмій Os, Іридій Іr, Платина Рt.
У нижній частині системи винесено два ряди по 14 елементів. Вони об'єднуються в природні родини «лантаноїди» й «актиноїди».
Розміщення елементів по групах і родинах полегшує їх вивчення. Знаючи будову і властивості одного з них, можна передбачити будову і властивості інших, що входять до цієї групи. (Учні складають опорний конспект)
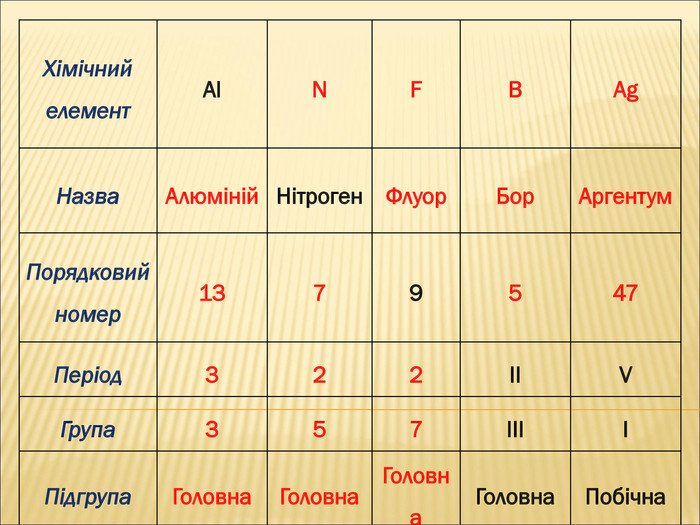
2. Характеристика хімічного елемента
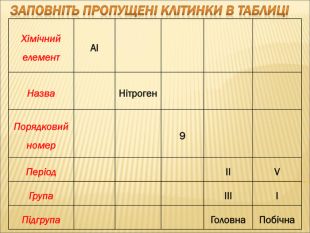
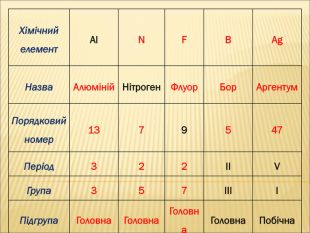
Отже, ми з’ясували, що кожний хімічний елемент має:
• прізвище та ім’я (назва елемента, та його символ).
• адресу: номер групи та номер періоду, на перетинах яких він знаходиться,
Крім того, кожний хімічний елемент має свій порядковий номер, масу атома, яка має назву відносна атомна маса та певну будову (робота з періодичною системою хімічних елементів) .
Завдання 2
Назвіть порядковий номер та масу атома слідуючих хімічних елементів: Гідроген, Літій, Карбон, Флуор, Цинк, Кальцій.
7. Зверніть увагу на порядок розташування хімічних елементів у другому періоді. Яку закономірність ви помітили?
(Маса атома кожного елемента збільшується).
Так, дійсно, у періодах елементи розташовані у порядку збільшення їх атомних мас.
8. Як можна доповнити визначення “періоду”?
Період — це горизонтальний ряд хімічних елементів, розміщених у порядку зростання їхніх відносних атомних мас, що починається лужним металом і закінчується інертним газом.
Велике значення для елемента має його порядковий номер. Оскільки він визначає кількість електронів, які рухаються навколо ядра, кількість протонів, які розташовані всередині ядра.
Завдання 3
Вказати порядковий номер, кількість протонів та електронів для слідуючих хімічних елементів:
Оксиген, Флуор, Алюміній, Силіцій, Магній, Оксиген.
V. Узагальнення та закріплення знань
1. Чи знайшли ми відповіді на запитання, які ми поставили на початку уроку? (Так).
2. Чи мають адресу хімічні елементи? (Так).
Тож спробуємо написати листа хімічному елементу, але перш за все підпишемо конверт.
3. Що вказують на конверті?
1. Країна (періодична система хімічних елементів Д.І.Менделєєва).
-
Область (номер періоду)
-
Місто (номер групи)
-
Будинок (підгрупа)
-
Квартира (порядковий номер)
-
Прізвище (назва хімічного елементу)
-
Ім’я (символ хімічного елементу)
Завдання
Підпишіть конверт для листа хімічному елементу:
І варіант Сульфуру
ІІ варіант Нітрогену
ІІІ варіант Купруму
VІ. Підведення підсумків уроку.
Сьогодні на уроці ми з вами довідалися багато нового про хімічний елемент.
Зокрема:
• Всі хімічні елементи розташовані в періодичній системі хімічних елементів, яка була створена Д.І. Менделєєвим у 1869 році.
• Періодична система складається з періодів та груп.
• Кожний хімічний елемент крім назви та символу має порядковий номер, атомну масу та певну будову.
• Порядковий номер вказує на кількість протонів та електронів атома хімічного елемента.
Висновок: періодична система хімічних елементів Д.І. Менделєєва – унікальний довідковий посібник хіміка, що містить відповіді на багато питань про будову атомів, властивості елементів та їх сполук.
Чим більше ми з вами будемо користуватися періодичною системою тим більше в цьому будемо переконуватися.
VІІ. Домашнє завдання
• Опрацювати матеріал конспекту.
• Повторити назви та символи наступних 5 хімічних елементів, розташованих у періодичній системі хімічних елементів Д.І.Менделєєва.
• Виготовити картки, де вказати символ хімічного елемента, його назву, порядковий номер, з іншого боку картки – вимову (для наступних 5 хімічних елементів).
• Творче завдання “Підготувати повідомлення про походження назв хімічних елементів”.
|