ПРАКТИЧНА РОБОТА №1 Дослідження якісного складу солей
Про матеріал
ПРАКТИЧНА РОБОТА №1
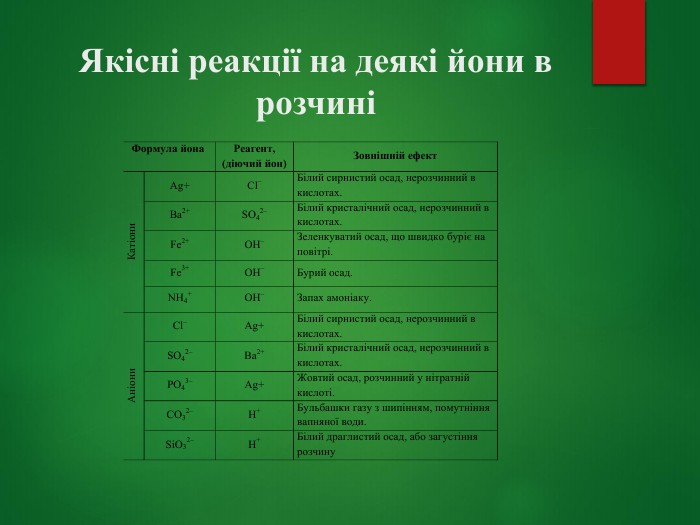
Дослідження якісного складу солей
Мета: дослідити якісний склад солей за допомогою якісних реакцій.
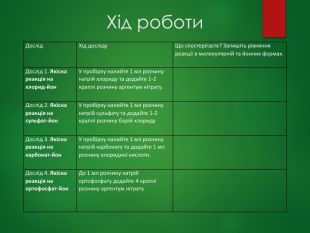
Обладнання: штатив із пробірками, піпетки.
Реактиви: індикаторний папір, розчини: ферум (II) сульфату, ферум (III) хлориду, барій хлориду, лугу, аргентум (I) нітрату, амоній хлориду, амоній сульфату, натрій карбонату, натрій сульфату, натрій силікату та хлоридна кислота.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку