Практична робота №4 "Очислення захімічними рівняннями відносного виходу продукту реакції"
Практична робота №4
Тема: Обчислення за хімічними рівняннями відносного виходу продукту реакції
Теоретична частина
Зазвичай після проведення хімічних реакцій і розрахунків за ними виявляється, що продукту реакції реально виходить менше, ніж було обчислено за рівнянням реакції. Причини різні: наявність домішок у реагентах, не повністю проведена реакція, якась частина реагентів губиться — залишається на стінках хімічного посуду тощо
Кількість речовини (маса, об’єм) продукту, що було обчислено математично за рівнянням реакції, називають «теоретично можливий вихід продукту реакції» або просто «теоретичний вихід». Цю величину прирівнюють до 100 %.
Кількість речовини (маса, об’єм) продукту, що було реально одержано, завжди менша за розраховану теоретично. Її називають «практичний вихід продукту реакції», «практичний вихід» або просто «вихід реакції». Ця величина завжди менша за 100 %.
Якщо в умові задачі сказано, що реакція перебігає кількісно або з кількісним виходом, це означає, що вихід усіх продуктів у даній реакції слід вважати 100 %.
Якщо в задачі взагалі немає вказівок про вихід продуктів реакції, то це означає, що треба вважати вихід реакції таким, що 100%, тобто його не враховувати.
Вихід реакції позначають буквою ŋ («ета») або ω(виходу) та обчислюють за формулами:
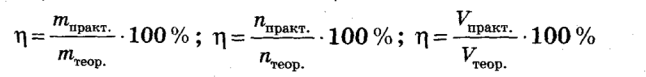
Якщо з умови задачі відома кількість речовини (маса, об’єм) одержаного продукту реакції, то це зазвичай величина, одержана практично, тобто практичний вихід.
Приклади задач. Три основних типи задач
Задача І. При взаємодії розчину етанолу з оцтовою кислотою, маса речовини в якій становить 6г, утворюється етилацетат. Визначте масу естеру, якщо масова частка відносного виходу від теоретично можливого становить 90%.

Задача II. При взаємодії розчину етанолу з оцтовою кислотою, маса речовини в якій становить 6 г, утворюється етилацетат масою 7,92 г. Визначити масову частку виходу естеру від теоретично можливого.
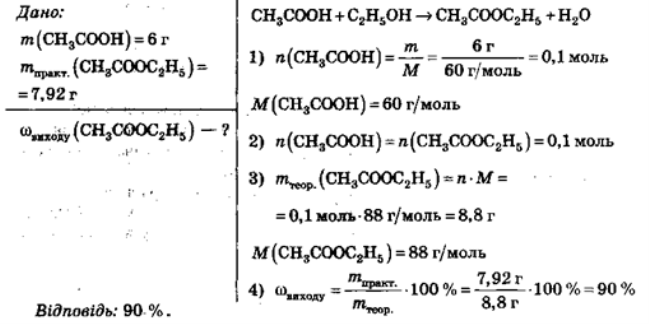
Задача ІІІ. Визначити масу етанолу, яку необхідно взяти для взаємодії з оцтовою кислотою, якщо утворюється 7,92 г естеру, якщо відносний вихід від теоретично можливого становить 90 %.

Це задачі виробничого спрямування. Обчислення які ми здійснюємо за рівнянням реакції - теоретичний вихід. Він дорівнює 100%. Насправді ж у промисловості бувають втрати. Тому практичний вихід менший, ніж теоретичний.
Задача І. Ортофосфатну кислоту в промисловості добувають дією сульфатної кислоти на природну сіль кальцій ортофосфат. Яку масу кислоти можна добути з солі масою 62 кг, якщо масова частка практичного виходу - 0,9?
|
Дано: |
|
|
||||
|
m (Са3(РО4)2)= 62кг |
η |
= |
mпрактична |
М (Са3(РО4)2) = 310 кг/моль |
||
|
ω(вих.) |
= |
0,9(90%) |
mтеоретична |
М (НзРО4) = 98к г/моль |
||
|
η НзРО4 |
mпрактична = η • mтеоретична |
|
||||
|
|
|
|||||
|
mпрактична (НзРО4) = ? |
|
|
||||
|
|
|
|
||||
Розв’язання
1. Складаємо рівняння реакції, визначаємо теоретичний вихід
62кг хкг
Са3(РО4)2 + 3 Н2SО4 = 3СаSО4 + 2 НзРО4
n 1 моль 2 моль
М 310кг/моль 98 кг/моль
m 310кг 196 кг
|
62кг |
= |
хкг |
|
х |
= |
62кг •196кг |
|
310кг |
196кг |
|
310кг |
mтеоретична (НзРО4)= 39,2кг
2. Обчислюємо практичний вихід кислоти
mпрактична (НзРО4) = 39,2кг •0,9= 35,28кг
mпрактична (НзРО4) =35,28кг
Відповідь: Практична маса кислоти становить 35,28 кг
Задача ІІ. При взаємодії сульфатної кислоти з кальцій ортофосфатом масою 62кг отримали ортофосфатну кислоту масою 35,28кг. Визначити масову частку виходу ортофосфатної кислоти від теоретично можливого?
Задача ІІІ. Визначити масу сульфатної кислоти, яку необхідно взяти для взаємодії з кальцій ортофосфатом, якщо добуто 35,28 кг ортофосфатної кислоти, а відносний вихід від теоретично можливого становить 90%?
Задача ІІ. При взаємодії сульфатної кислоти з кальцій ортофосфатом масою 62кг отримали ортофосфатну кислоту масою 35,28кг. Визначити масову частку виходу ортофосфатної кислоти від теоретично можливого?
|
Дано: |
|
|
|
||||
|
m (Са3(РО4)2)= 62кг |
η |
= |
mпрактична |
|
М (Са3(РО4)2) = 310 кг/моль |
||
|
mпрактична (НзРО4) = 35,28 кг |
mтеоретична |
|
М (НзРО4) = 98к г/моль |
||||
|
mпрактична = η • mтеоретична |
|
|
|||||
|
|
|
|
|
||||
|
ω(вих.) -? η НзРО4 |
|
|
|
||||
Розв’язання
1. Складаємо рівняння реакції, визначаємо теоретичний вихід
62кг хкг
Са3(РО4)2 + 3 Н2SО4 = 3СаSО4 + 2 НзРО4
n 1 моль 2 моль
М 310кг/моль 98 кг/моль
m 310кг 196 кг
|
62кг |
= |
хкг |
|
х |
= |
62кг •196кг |
|
310кг |
196кг |
|
310кг |
mтеоретична (НзРО4)= 39,2кг
2. Обчислюємо вихід продукту реакції отрофосфатної кислоти
|
ω(вих.) |
= |
35,28 кг |
= |
0,9 або 90% |
|
η НзРО4 |
39,2 кг |
Відповідь: Масова частка виходу продукту ортофосфатної кислоти 0,9 або 90%.
Задача ІІІ. Визначити масу сульфатної кислоти, яку необхідно взяти для взаємодії з кальцій ортофосфатом, якщо добуто 35,28 кг ортофосфатної кислоти, а відносний вихід від теоретично можливого становить 90%?
|
Дано: |
|
|
||||
|
m (Са3(РО4)2)= 62кг |
η |
= |
mпрактична |
М (Н2SО4) = 98 кг/моль |
||
|
ω(вих.) |
= |
0,9(90%) |
mтеоретична |
М (НзРО4) = 98к г/моль |
||
|
η НзРО4 |
mпрактична = η • mтеоретична |
|
||||
|
|
|
|||||
|
m (Н2SО4) = ? |
|
|
||||
|
|
|
|
||||
Розв’язання
- Визначаємо теоретичну масу ортофосфатної кислоти
|
Mтеоретична (НзРО4) |
= |
35,28 кг |
= |
39,2 кг |
|
0,9 |
2. Складаємо рівняння реакції, визначаємо масу сульфатної кислоти
хкг 39,2 кг
Са3(РО4)2 + 3 Н2SО4 = 3СаSО4 + 2 НзРО4
n 3 моль 2 моль
М 98кг/моль 98кг/моль
m 294кг 196кг
|
хкг |
= |
39,2кг |
|
х |
= |
294кг •196кг |
|
294кг |
196кг |
|
196кг |
m (Н2SО4)= 58,8кг
Відповідь: Маса сульфатної кислоти 58,8 кг
ХІД РОБОТИ
ВАРІАНТ 1
- Яку масу сульфатної кислоти можна одержати із Сульфур (VI) оксиду масою 40г, якщо вихід реакції становить 80% (0,8)?
2. При нейтралізації 294 г сульфатної кислоти гідроксидом натрію утворилося 320 г сульфату натрію. Яка масова доля (у %) виходу солі від теоретично можливого?
3. Визначте масу хлоридної кислоти, яку необхідно взяти для взаємодії з залізом, якщо виділись 4,03л водню, вихід від теоретичного становить 90%?
ВАРІАНТ 2
1. При взаємодії 11,2 г заліза з хлоридною кислотою виділився водень. Визначте об’єм водню, якщо об’ємна частка відносного виходу від теоретичного становить 90%?
2. З 11,2 г азоту отримали 13 г аміаку. Визначте масову долю (у %)) виходу аміака від теоретично можливого.
3. Визначте масу води , яку необхідно взяти для отримання сульфатної кислоти, якщо синтезували 39,2г сульфатної кислоти та відносний вихід від теоретичного становить 80%?
ВАРІАНТ 3
1. При синтезі з простих речовин водню і азоту масою 11,2г синтезували амоніак. Визначте масу амоніаку, якщо масова частка відносного виходу від теоретичного можливого становить 95,5%?
2. При взаємодії 11,2 г заліза з хлоридною кислотою виділився водень об’ємом 4,03 л Визначте об’ємну долю (у %) виходу водню від теоретично можливого?
3. Визначте масу гідроксиду натрію, який необхідний для нейтралізації сульфатної кислоти, якщо утворилася сіль масою натрію сульфату масою 320г, якщо відносний вихід від теоретично можливого становить 75%?
ВАРІАНТ 4
1. При взаємодії гідроксида натрію з сульфатної кислоти масою 294г, утворилася сіль натрію сульфат. Визначте масу солі, якщо масова частка відносного виходу від теоретично можливого становить 75%?
2. З Сульфур (VI) оксиду масою 40г отримали 39,2г сульфатної кислоти. Визначте масову частку виходу сульфатної кислоти (у %) від теоретично можливого?
3. Визначте об’єм водню, який необхідний для взаємодії з азотом, якщо синтезовано 13г амоніаку. Відносний вихід від теоретичного становить 95,5%?


про публікацію авторської розробки
Додати розробку
