Практичне заняття Розв’язування експериментальних завдань з теми «Неметалічні елементи».
Практичне заняття
Розв’язування експериментальних завдань з теми «Неметалічні елементи».
Мета заняття: навчитись розпізнавати сполуки неметалів за допомогою відповідних якісних реакцій виявляти сульфат-іон, карбонат-іон у розчині, писати рівняння реакцій за схемами.
Необхідні устаткування і посібники
- Ярошенко О.Г. Хімія (підручник), 10кл. Перун 2010. 223с.
- Інструктивні карти до практичної роботи.
- Пробірки, спиртівка, штативи.
- Прилади та реактиви: пробірки, піпетка, спиртівка, газовідвідна трубка, хлоридна кислота (роз), лакмус (фіолетовий), купрум(ІІ) сульфат, вапняна вода, натрій гідрокарбонат, натрій сульфат, натрій хлорид, натрій нітрат, барій хлорид.
Основні теоретичні положення
Одне з основних практичних вмінь, які повинні бути сформовані у спеціалістів харчової промисловості – це вміння якісного аналізу, вміння розпізнавати речовини, аналізувати їх вміст, будувати логічні ланцюжки, отримання речовин та розшифровувати їх.
Всі речовини генетично (від грец. genesis – походження) зв’язані між собою. Генетичний зв’язок полягає в тому, що кожна речовина може хімічно взаємодіяти з речовинами інших класів або перетворюватися в речовини інших класів.
Фізичні властивості сульфатної кислоти:
- Безводна, 100 % важка, безбарвна, оліїста речовина.
- Густина 98% кислоти 1,84 г/см3.
- Сильна кислота, нелетка, запаху не має.
- Водопоглинаючий засіб, надзвичайно гігроскопічна.
- Їдка речовина, при розчиненні виділяється велика кількість теплоти.
Сульфатну кислоту застосовують для добування мінеральних добрив(суперфосфату, амоній сульфату), виробництва залізного та мідного купоросів, які використовують для боротьби з шкідниками та хворобами рослин, одержання барвників, пластичних мас, штучного волокна, лікарських та вибухових речовин, летких кислот, для очищення нафтопродуктів, а також поверхонь металів від оксидів, сушіння різних речовин. Сульфатна кислота утворює подвійні солі – галуни K2SO4 ∙AI2(SO4)3 ∙24H2O, або KAI(SO4)2 ∙12H2O, які застосовують у медицині, для фарбування тканини, дублення шкір, проклеювання паперу.
СО2 використовують для одержання соди, синтезу органічних кислот, гасіння пожеж, для приготування газованих напоїв, охолодження продуктів харчування(сухий лід). У сільському господарстві для зниження кислотності грунтів і покращання їх структури застосовують розмелений вапняк СаСО3. Nа2СО3 соду одержують штучно і використовують у виробництві скла, мила, паперу, тканин, у нафтовій промисловості, побуті. NаНСО3 питну соду використовують в медицині, хлібопекарстві та для зарядки вогнегасників. Природні силікати та кремнезем використовують для виготовлення скла, фарфору, фаянсу, керамічних виробів, будівельних та в’яжучих матеріалів.
Методичні рекомендації:
При розв’язуванні вправ необхідно дотримуватись наступного алгоритму:
- скласти прогноз можливих шляхів перетворення речовин, план дій;
- запис схеми перетворення;
- скласти прогноз, вказавши над стрілочками формули речовин які необхідно взяти щоб здійснити перетворення;
- записати рівняння реакцій перетворень;
- вказати можливі варіанти якісного аналізу речовин.
Завдання 1. Виявлення сульфат-йона. Якісна реакція на сульфати.
1.1. Хід роботи
У три пробірки налийте розчини: натрій хлориду, натрій сульфату, натрій нітрату. Додайте у кожну пробірку по краплі розчину барій хлориду.
1.2. Хімізм
____________________________________________________________________________________________________________________________
1.3. Спостереження
____________________________________________________________________________________________________________________________
1.4. Висновок
____________________________________________________________________________________________________________________________
Завдання 2. Виявлення карбонат-іона. Якісна реакція на карбонати.
2.1. Хід роботи
У дві пробірки налийте розчини: натрій гідрогенкарбонату, натрій сульфату. Додайте у кожну пробірку по краплі розчину хлоридної кислоти.
2.2. Хімізм
________________________________________________________________________________________________________________________________
2.3. Спостереження
________________________________________________________________________________________________________________________________
2.4. Висновок
________________________________________________________________________________________________________________________________
Завдання 3.
За допомогою яких реакцій можна здійснити перетворення по такій схемі:
S → SO2 → SO3 → H2SO4 → BaSO4
↓
SO3
2.1. Хімізм
______________________________________________________________________________________________________________________________________________________________________________________________________
2.2. Спостереження
____________________________________________________________________________________________________________________________________
2.3. Висновок
______________________________________________________________________________________________________________________________________________________________________________________________________
Завдання 4
Напишіть рівняння хімічних реакцій, що відповідають таким перетворенням. Визначте речовини А, В, С, D:
Са ![]() A
A ![]() B
B ![]() C
C ![]() D
D
3.1. Хімізм
______________________________________________________________________________________________________________________________________________________________________________________________________3.2. Спостереження
____________________________________________________________________________________________________________________________________
3.3. Висновок
Контрольні завдання
Варіант 1
- У пробірках є речовини: барій нітрат, натрій хлорид, натрій гідроксид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: BaSO4→ SO3 → CaSO4 → BaSO4 →BaO
Варіант 2
- У пробірках є речовини: ферум(ІІ) хлорид, ферум(ІІІ) нітрат, алюміній хлорид. Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: H2 → HCl → Fe Cl3 → Fe(OH)3 → H2O
Варіант 3
- У пробірках є речовини: кальцій оксид, барій гідроксид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: H2 → H2O → NaOH → NaNO3→ Na2SO4
Варіант 4
- У пробірках є речовини: кальцій гідроксид, калій хлорид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: H2O → HNO3 → Mg(NO3)2 → O2
↓
Mg(OH)2
Варіант 5
- У пробірках є речовини: натрій хлорид, амоній сульфат.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: H2O → KOH → K3CO3 → KHCO3 → →KCl
Варіант 6
- У пробірках є речовини: кальцій карбонат, кальцій хлорид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
-
Напишіть рівняння реакції за схемою: Ca
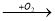 A
A 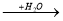 B
B 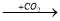 C
C 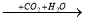 D
D 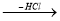 E
E
Варіант 7
- У пробірках є речовини: алюміній нітрат, натрій гідроксид
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
-
Напишіть рівняння реакції за схемою: Ba
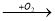 A
A 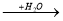 B
B 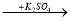 C
C 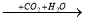 D
D 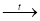
Варіант 8
- У пробірках є речовини: калій гідроксид, натрій хлорид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
-
Напишіть рівняння реакції за схемою: N2
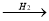 A
A 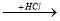 B
B 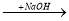 C
C  D
D
Варіант 9
- У пробірках є речовини: кальцій гідроксид, калій хлорид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
-
Напишіть рівняння реакції за схемою: Fe
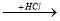 A
A 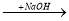 B
B 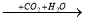 C
C  D
D
Варіант 10
- У пробірках є речовини: барій нітрат, натрій хлорид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: H2O → Ca(OH)2 → CaSO4 → BaSO4 → SO3
Варіант 11
- У пробірках є речовини: натрій гідроксид, хлоридна кислота.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: H2 → HCl → Fe Cl3 → Fe(OH)3 → H2O
Варіант 12
- У пробірках є речовини: ферум(ІІ) хлорид, алюміній хлорид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: H2 → H2O → NaOH → NaNO3
↓
Na2 SO4
Варіант 13
- У пробірках є речовини: кальцій сульфат, барій гідроксид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
- Напишіть рівняння реакції за схемою: Na → Na2O → NaOH → NaNO3
↓
NaAlO2
Варіант 14
- У пробірках є речовини: кальцій гідроксид, натрій гідроксид, калій хлорид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
-
Напишіть рівняння реакції за схемою: Ba
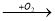 A
A 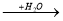 B
B 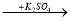 C
C 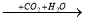 D
D 
Варіант 15
- У пробірках є речовини: кальцій карбонат, кальцій хлорид, кальцій оксид.
Визначити вміст кожної з пробірок. Опишіть хід виконання роботи і складіть рівняння реакції.
-
Напишіть рівняння реакції за схемою: N2
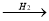 A
A 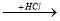 B
B 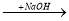 C
C  D
D


про публікацію авторської розробки
Додати розробку
