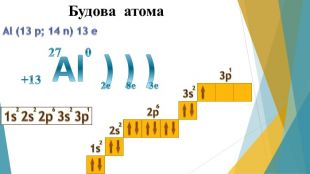
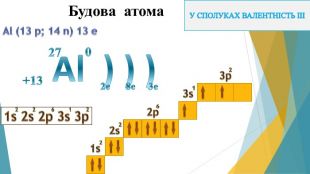
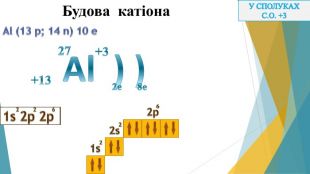
Презентація "Алюміній: будова атома, фізичні та хімічні властивості"
Про матеріал
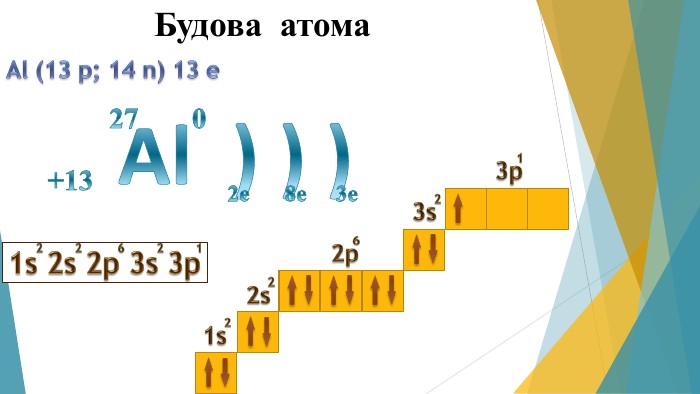
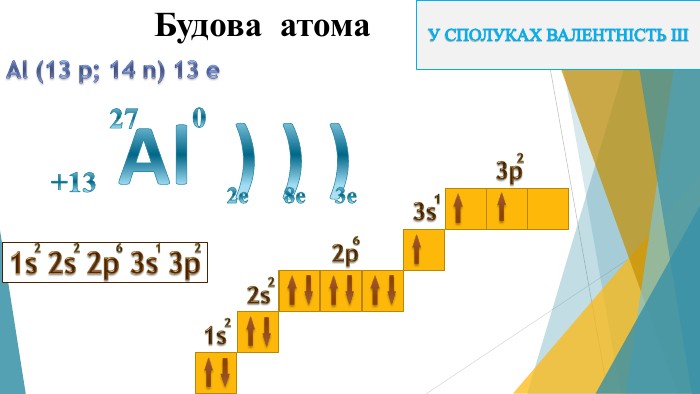
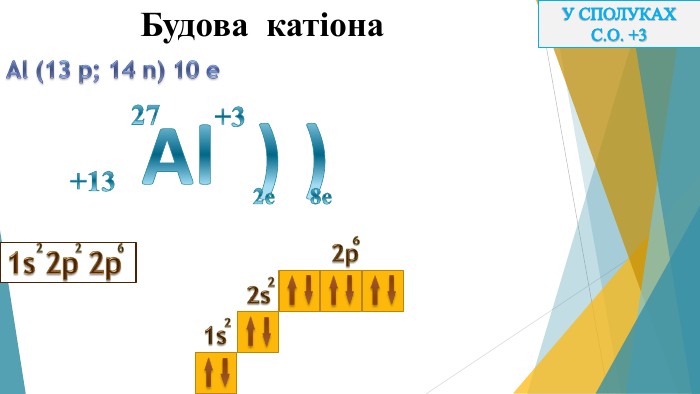
Дана презентація може бути використана на уроці для ознайомлення та вивчення матеріалу. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку