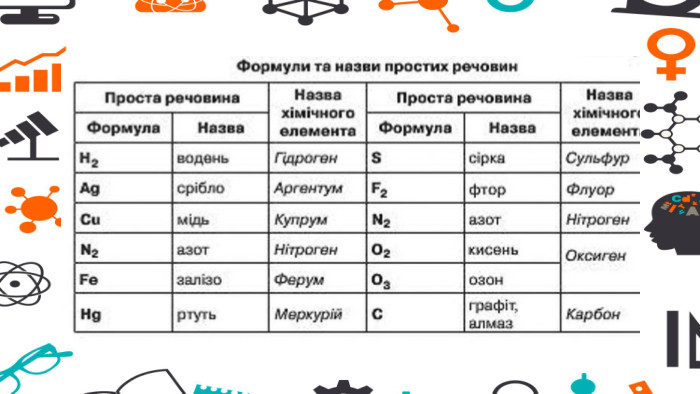
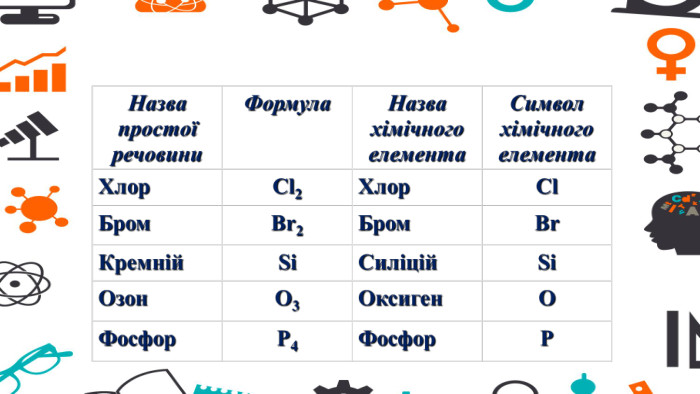
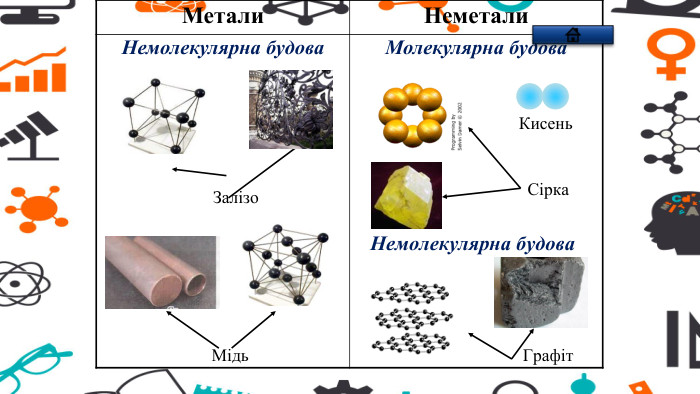
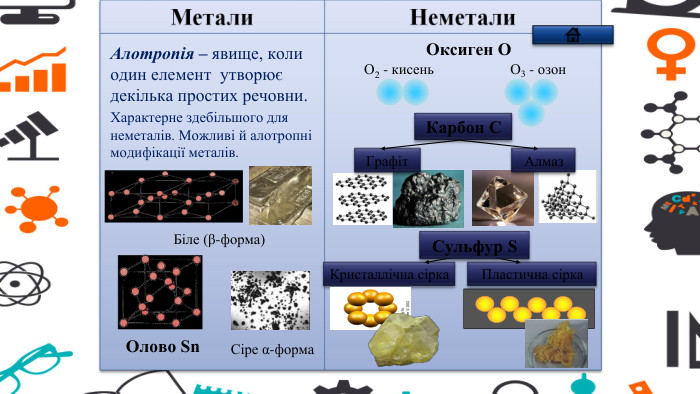
Презентація "Багатоманітність речовин. Метали й неметали. Металічні та неметалічні елементи."
Про матеріал
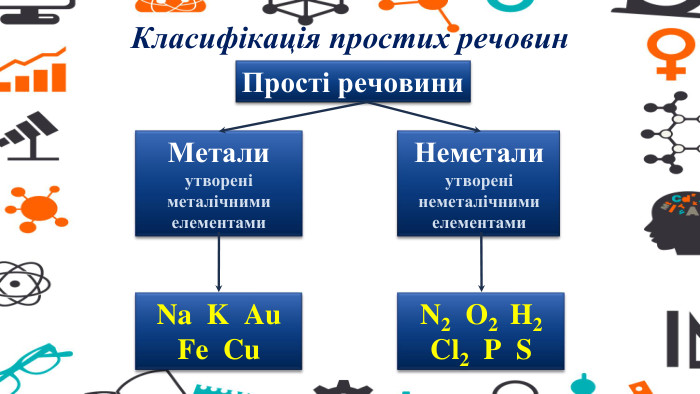
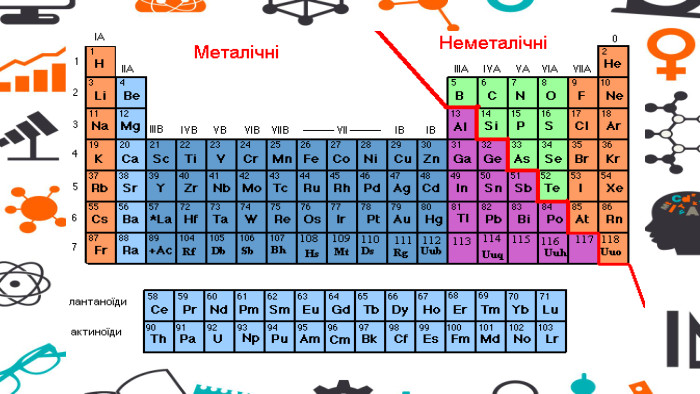
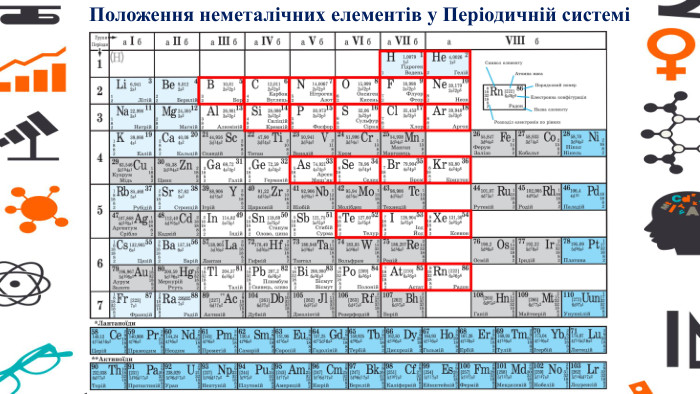
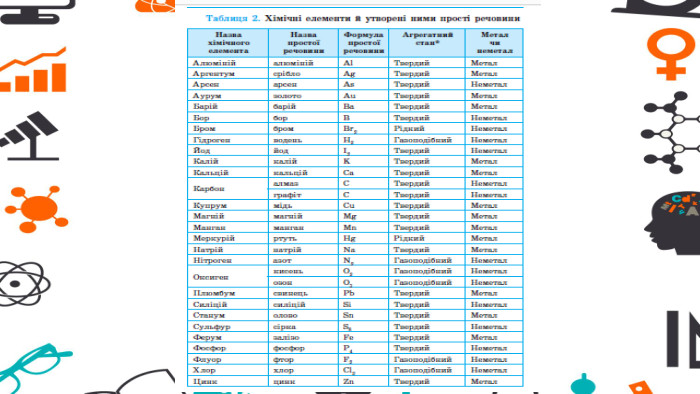
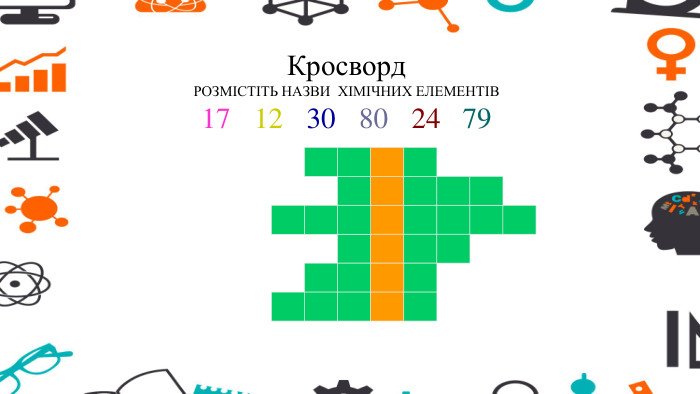
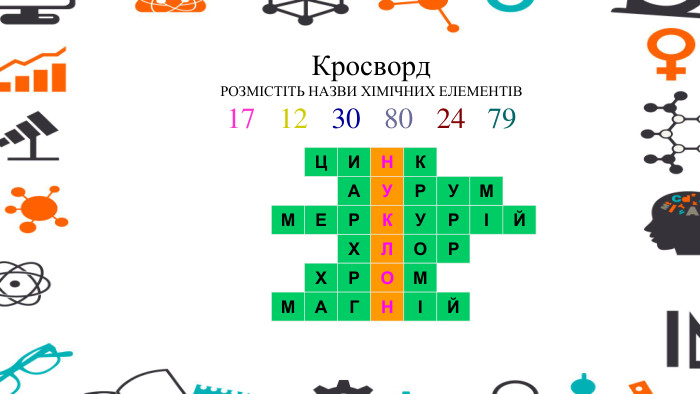
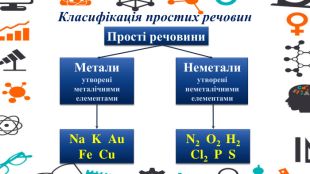
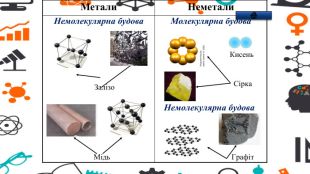
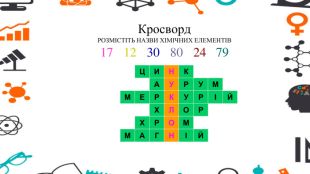
Презентація - розробка уроку за темою "Багатоманітність речовин. Метали й неметали. Металічні та неметалічні елементи", що містить питання для актуалізації, основну частину та завдання на закріплення, гру "Так чи ні". Перегляд файлу
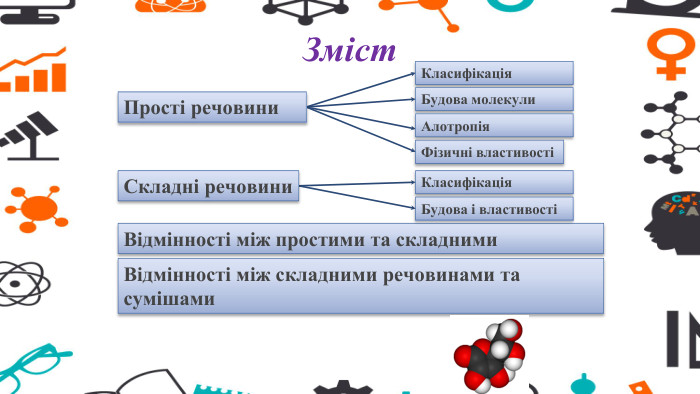
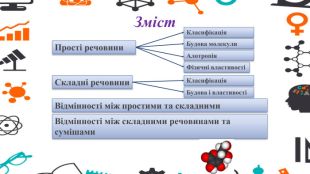
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку