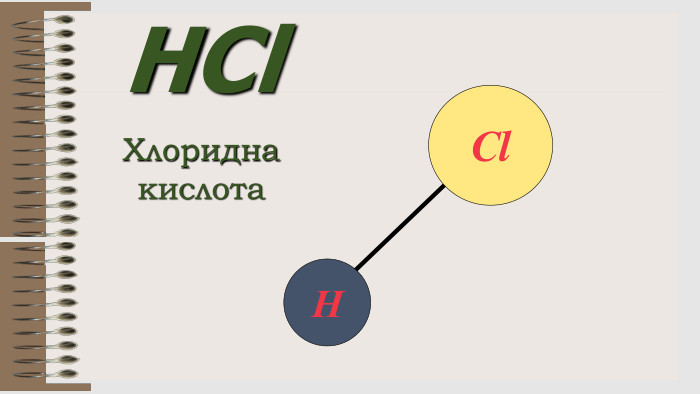
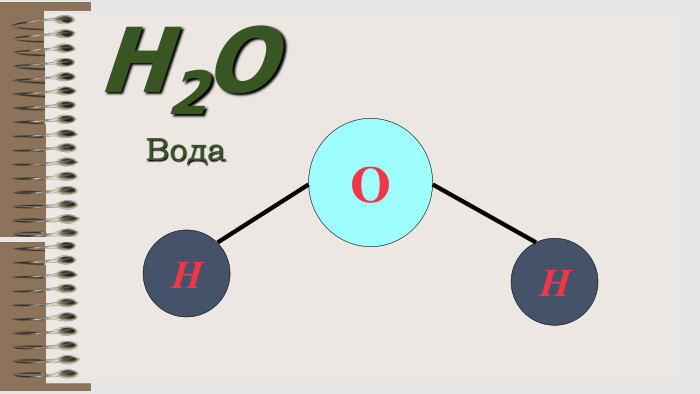
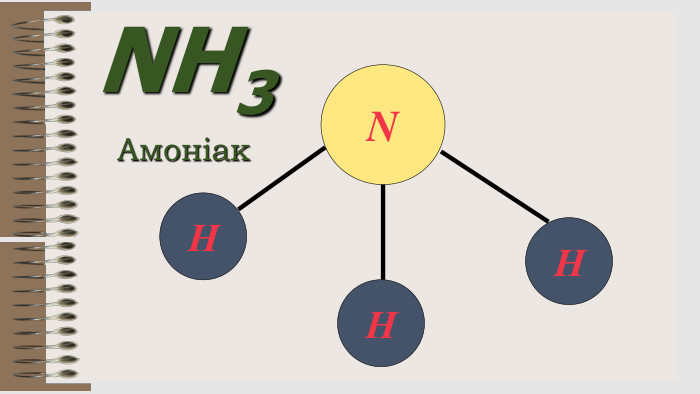
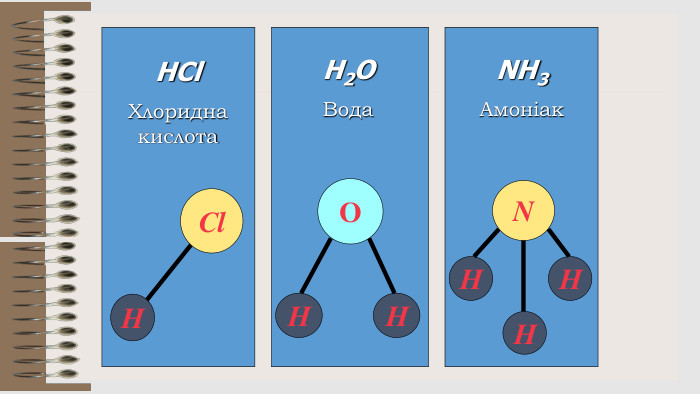
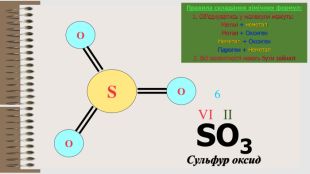
Презентація "Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів."
Про матеріал
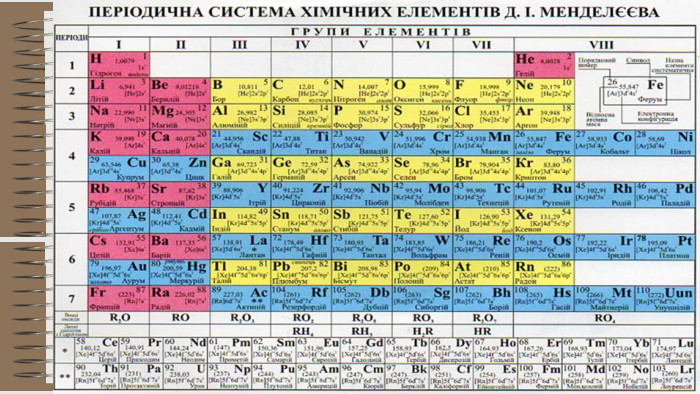
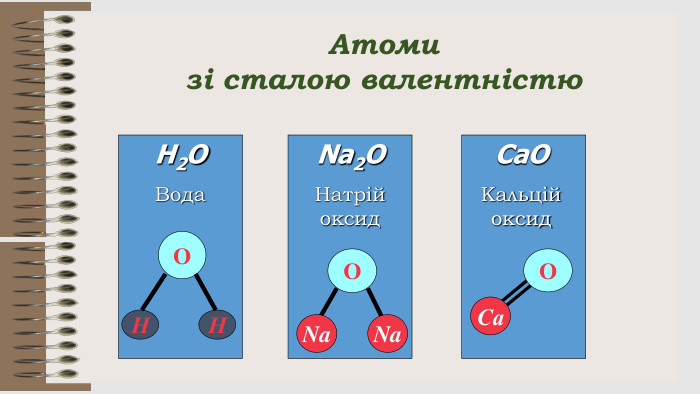
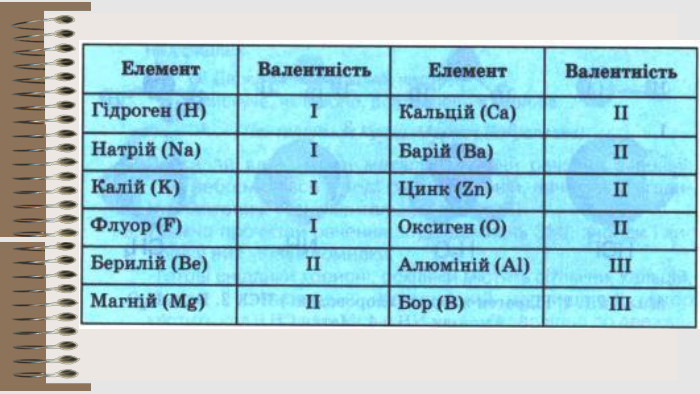
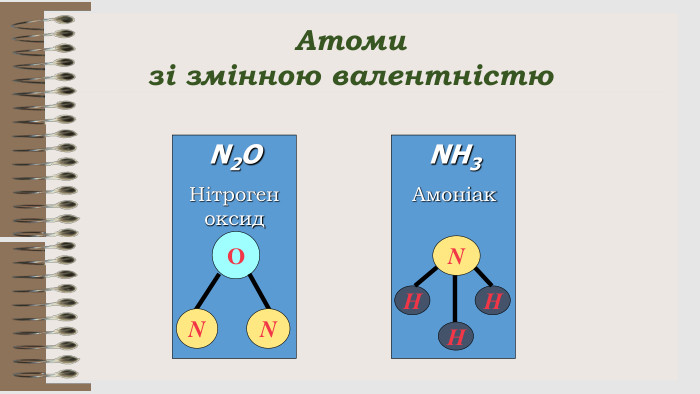
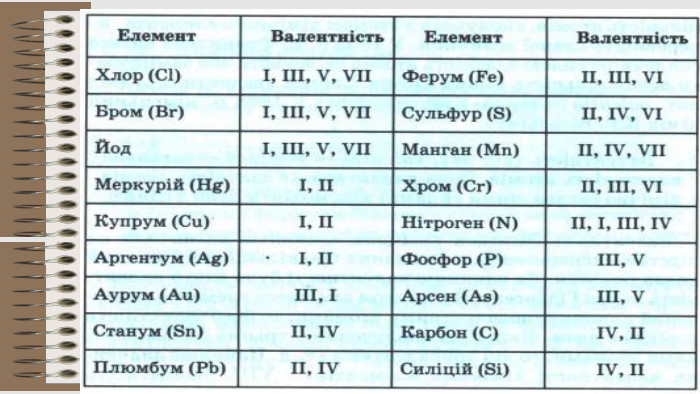
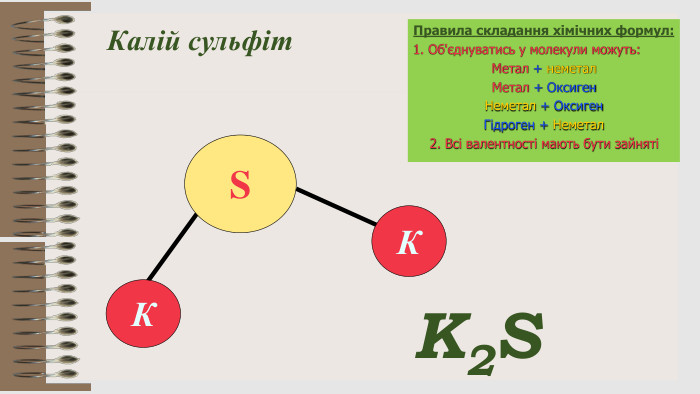
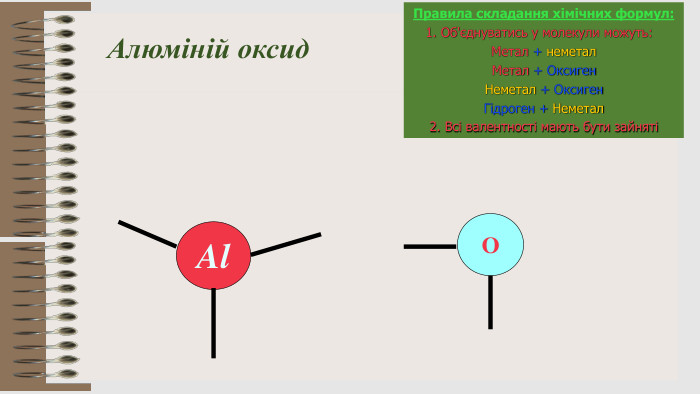
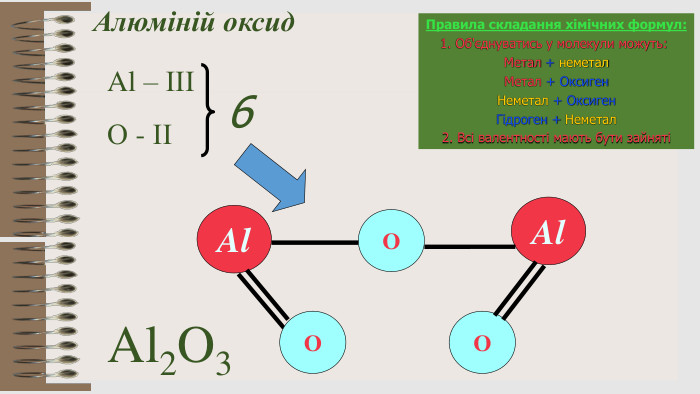
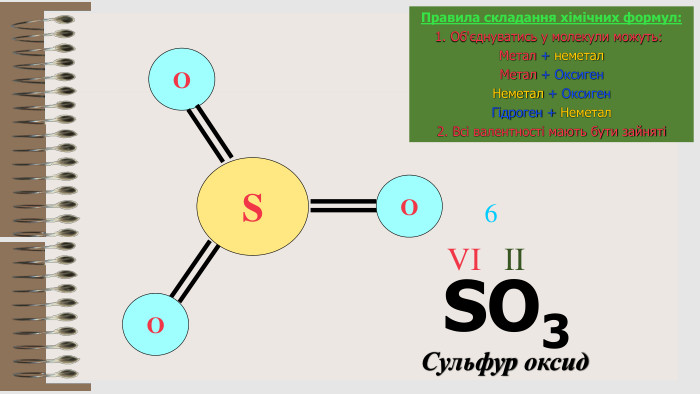
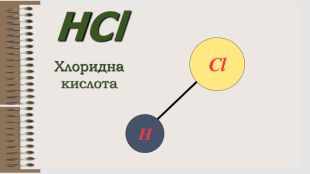
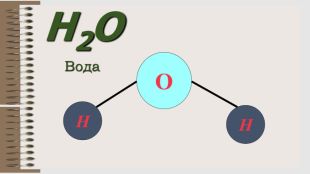
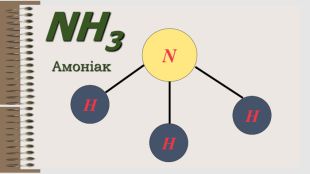
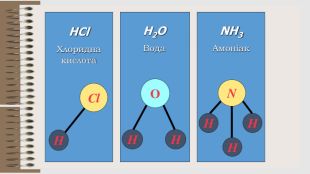
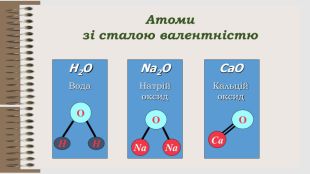
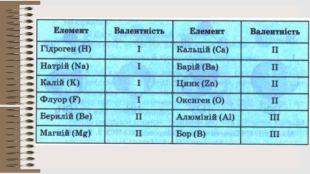
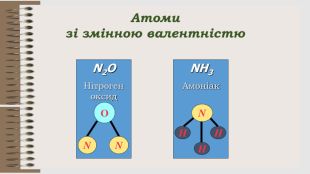
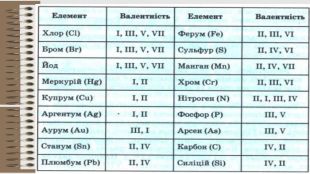
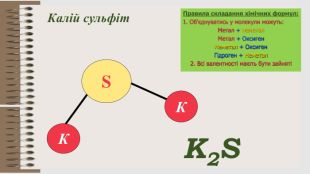
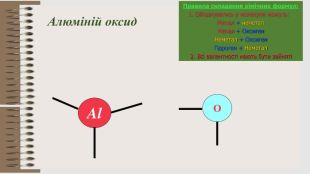
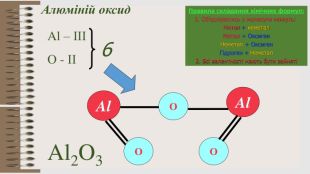
Розробка уроку за темою "Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів." містить завдання для закріплення, алгоритм складання формул. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку