Презентація до курсу "Хімія у побуті" "Кристалогідрати. Квасці. Купороси. Бура"


























































При нагріванні гірських порід галуни спочатку розплавляються у власній кристалізаційній воді, далі втрачають цю воду і перетворюються в так званий палений галун. Утворюються при взаємодії сульфатної кислоти з алюмосилікатами в результаті вулканічної діяльності, при вугільних пожежах, в посушливих місцях тощо. У природі зустрічаються рідко.
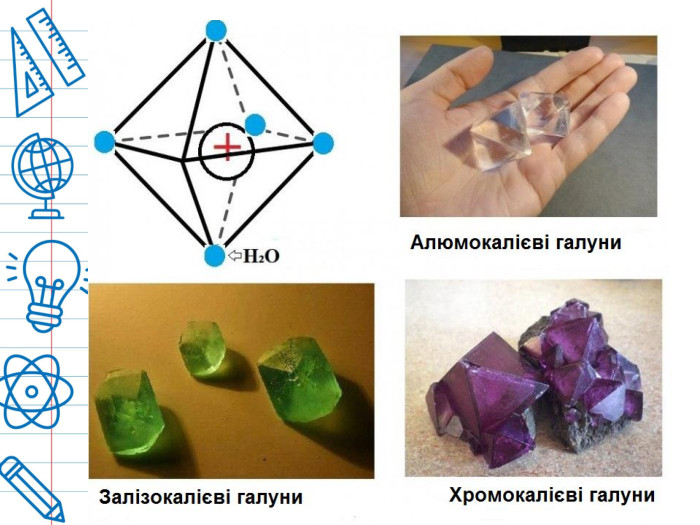
Галуни на основі алюмінію мають ряд загальних хімічних властивостей. Вони розчиняються у воді, мають солодкуватий смак, реагують із кислотою на лакмус і кристалізуються у правильні октаедри. У галунах кожен іон металу оточений шістьма молекулами води. При нагріванні вони розріджуються, і якщо нагрівання продовжується, кристалізаційна вода видаляється, соляна піна спінюється і набухає, і нарешті залишається аморфний порошок. Вони в'яжучі та кислі.
Галуни відомі з давнини, їх описує ще Пліній в «Природній історії» (XXXV, 52). Від латинської назви галун - alumen, "гірка сіль" - походить назва алюмінію в багатьох мовах. Галуни з давніх-давен використовуються як протрава при фарбуванні вовняної і бавовняної пряжі і тканин. Завдяки тому, що солі тривалентних металів викликають денатурацію білків, галун використовують як дублячий засіб у шкіряній промисловості при квасцюванні
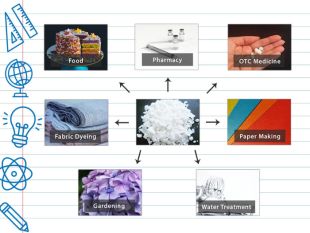
Використання галунів включає очищення питної води. Ви коли-небудь замислювалися, як нам вдається, щоб із наших кранів текла безпечна питна вода? Ви можете подякувати галунам. Муніципальні постачальники води використовують галун для очищення води для споживання людиною. Крім того, технічна вода (непитна вода) також може бути оброблена цим хімікатом для очищення, якщо бактерії / осад можуть спричинити несприятливий ефект. При додаванні у воду алюмокалієвий галун призводить до злипання мікроскопічних домішок у все більші і більші частинки. Ці згустки потім осідають на дно контейнера і можуть бути відфільтровані. Це робить воду безпечнішою для пиття. За таким же принципом галун також іноді використовується в плавальних басейнах для зменшення каламутності води
Фарбування тканин Подивіться вниз на свою сорочку. Ймовірно, це не звичайна біла футболка. Ще одним застосуванням галунів є фарбування та друк на тканині. При розчиненні у великій кількості води з нейтральним або злегка лужним р. Н сполука утворює липку речовину, гідроксид алюмінію. Цей слиз допомагає барвникам прилипати до волокон тканини, роблячи барвник нерозчинним у воді. Отже галун «фіксує» барвник, тобто поєднується з молекулярною структурою барвника та тканини, тому барвник не витікає, коли тканина стає вологою
Виготовлення паперу У минулому галун використовувався для виготовлення паперу, хоча синтетичні речовини в основному замінили його. Він допомагає проклеювати папір. У цьому процесі галун поєднується з каніфоллю, щоб змінити вбиральну здатність паперу. Галун створює кисле середовище, тоді як синтетичні проклеювачі створюють безкислотний папір, який не так легко руйнується. У традиційному японському мистецтві галун і тваринний клей розчиняли у воді, утворюючи рідину, відому як доуса (яп. 礬水), і використовували як грунтовку для проклеювання паперу.
медичне застосування галунів У медицині алюмокалієві галуни застосовують досить широко, адже вони:мають дезінфікуючі та обволікаючі властивості;зменшують запалення;надають в'яжучий і підсушуючий ефект;прискорюють процес згортання крові (мають кровоспинну дію);регулюють виділення потових залоз;вбивають бактерії;допомагають загоїти гнійні рани;здатні усунути неприємний запах з рота;допомагають при стоматиті й гінгівіті.
Розчинення свердл Галуни у вигляді сульфату калію-алюмінію або сульфату алюмінію-амонію в концентрованій ванні з гарячою водою регулярно використовуються ювелірами та машиністами для розчинення свердл із загартованої сталі, що відкололися у виробах з алюмінію, міді, латуні, золота (будь-якої кратності), срібла) та нержавіючої сталі. Це пов'язано з тим, що галуни не вступають у хімічну реакцію в будь-якій значній мірі з будь-яким з цих металів, але викликають корозію вуглецевої сталі. Коли суміш галунів нагрівається, утримуючи деталь, в якій застрягло свердло, якщо втрачене свердло досить мале, його іноді можна розчинити/видалити протягом кількох годин.
Харчова промисловість. Галун використовується для приготування їжі, і, як правило, вважається безпечним, якщо використовувати його відповідно до належної виробничої практики. В основному використовується як загусник і емульгатор. Також за допомогою галунів: Ремінералізуйте та освітлюйте воду для безалкогольних напоїв та пива Контролюйте рівень p. H у буряках, помідорах, а також інших овочах. Контролюйте p. H і колір вина та лікеру Загущуйте сир Діє як розпушувач у суміші для торта (харчова сода)
Садівництво. Оскільки галун надзвичайно кислий, його іноді додають у дуже лужні ґрунти, щоб збалансувати р. Н для рослин. Коли сульфат алюмінію контактує з водою, він утворює гідроксид алюмінію та сильно розбавлений розчин сірчаної кислоти, що змінює кислотність ґрунту. Садівники, які садять гортензії, використовують цю властивість, щоб змінити колір квіток (блакитний або рожевий) гортензій, оскільки ця рослина дуже чутлива до p. H ґрунту
Палені галуни - фармацевтичний препарат, присипка для зовнішнього застосування. Використовується в медицині, переважно в дерматології. Складається з зневоднених алюмінієвих галунів (подвійних сірчанокислих солей алюмінію — зазвичай алюмокалієвих, але іноді алюмонатрієвих і алюмоамонієвих)Галуни (квасці) отримали свою назву в XV столітті від слов'янського слова «кисаті» - киснути - за їх в'яжучий смак. У немедичній практиці алюмокалієві галун застосовуються у вигляді кристалогідрату – K2 SO4⋅Al2(SO4)3⋅24 H2 O. Однак нестійкість алюмокалієвих галунів до вивітрювання (втрати кристалізаційної води при зберіганні на повітрі) незручна для застосування як фармакопейний препарат і вимагає їх зневоднення. При нагріванні галуни зневоднюються і втрачають кристалізаційну воду, що входить до структури кристалічної решітки солі. Зневоднений продукт потім подрібнюється і просівається. Отриманий порошок у фармакології називають паленим галуном. Галуни палені є білим гігроскопічним порошком, погано розчинним у холодній воді.
Завдяки підсушуючій і в’яжучій властивості, палені галуни є неорганічним засобом для боротьби з потовиділенням. На відміну від антиперспірантів з органічними компонентами, палені галуни не закупорюють пори потових залоз і не знижують активність потових залоз, тому що їхня дія заснована на високих абсорбційних властивостях безводного сульфату алюмінію-калію. Внаслідок в'яжучого і підсушуючого впливу вони знерухомлюють мікроорганізми, а алюміній, що входить до складу галунів, має помітну антимікробну дію. Таким чином галуни пригнічують активність бактерій і грибків, продукти життєдіяльності яких і є джерелом неприємного запаху.. Крім описаних властивостей, палені галуни допомагають у лікуванні гострих запальних явищ при попрілості, дерматиті, екземі, мікозі та багатьох інших шкірних захворюваннях. Завдяки знешкодженню різних мікроорганізмів і бактерицидним властивостям сульфату алюмінію, галуни палені мають дезінфікуючу властивість. Тому присипку нерідко використовують як кровоспинний і припікаючий засіб при дрібних порізах і саднах. Палені галуни швидко утворюють «кірочку» на рановій поверхні, що сприяють загоєнню рани. Завдяки протизапальній властивості, розчин препарату також часто використовується в стоматологічних цілях, наприклад при боротьбі з кровоточивістю ясен — полоскання ротової порожнини слабким водним розчином галунів (0,5—1 %) знижує біль, а також зменшує печіння і свербіж при стоматиті, гінгівіті та інших. захворювання порожнини рота. Крім того, палені галун застосовуються для догляду за домашніми тваринами. Препарат схвалений для застосування у ветеринарії: допомагає лікувати у тварин порізи, пітливість у ділянці складок шкіри.
КУПОРОСИ ПРИРОДНІ водні та безводні сульфати Fe, Mg, Cu, Zn, Mn, Ni та ін., переважно двовалентних металів, які утворюють нальоти, кірочки, вицвіти, виповнюють порожнини тріщин, а також зустрічаються у вигляді цементу уламкового матеріалу. Всі К., за винятком епсоміту, є вторинними продуктами окиснення сірчаних сполук. В промисловості і сільському господарстві використовують найпоширенішими купоросами є такі: залізний купорос - (Fe. SO4·7 H2 O);мідний купорос - (Cu. SO4·5 H2 O);цинковий купорос - (Zn. SO4·7 H2 O);ванадієвий купорос (VSO4·7 H2 O);кобальтовий купорос (Co. SO4·7 H2 O);нікелевий купорос (Ni. SO4·7 H2 O);свинцевий купорос (Pb. SO4);хромовий купорос (Cr. SO4·7 H2 O);марганцевий купорос (Mn. SO4·5 H2 O);
Сульфат міді(II) (мідь(II) сірчанокисла), традиційна назва кристалогідрату - мідний купорос) - неорганічна сполука, мідна сіль сірчаної кислоти з формулою Cu. SO4. Нелетка речовина, не має запаху. У безводному вигляді – білий порошок, дуже гігроскопічний. У вигляді кристалогідратів - прозорі негігроскопічні кристали різних відтінків синього. На повітрі поступово вивітрюються (втрачають кристалізаційну воду). Має гіркувато-металевий в'яжучий смак. Сульфат міді(II) добре розчинний у воді. З водних розчинів кристалізується у вигляді блакитного пентагідрату Cu. SO4 5 H2 O (мідний купорос). Токсичність мідного купоросу для теплокровних тварин невисока, водночас він високотоксичний риб. Має дезінфікуючі, антисептичні, в'яжучі властивості. Застосовується в медицині, в рослинництві як антисептик, фунгіцид чи мідно-сірчане добриво.
Сульфат міді(II) - одна з найважливіших солей міді. Часто є вихідною сировиною для отримання інших сполук міді. Безводний сульфат міді - хороший поглинач вологи і може бути використаний для зневоднення (абсолютування) етанолу, осушення газів (у тому числі повітря) і як індикатор вологості. Легкість вирощування кристалів пентагідрату сульфату міді та його різку різницю з безводною формою використовують у шкільній освіті. У машинобудуванні використовується для фарбування металевих деталей перед ручною розміткою. У будівництві водний розчин сульфату міді застосовується для нейтралізації наслідків протікання, ліквідації плям іржі, а також для видалення виділень солей («висолів») з цегляних, бетонних та оштукатурених поверхонь, а також як антисептичний та фунгіцидний засіб для запобігання гниття. У сільському господарстві мідний купорос застосовується як антисептик, фунгіцид та мідно-сірчане добриво.
Проте найчастіше мідний купорос застосовується у складі бордо́сської рідини — основного сульфату міді Cu. SO4·3 Cu(OH)2 проти грибкових захворювань та виноградної філоксери. Для цього сульфат міді(II) є в роздрібній торгівлі. Для боротьби з цвітінням води у водосховищах також використовується хімічна обробка мідним купоросом . Також він застосовується для виготовлення мінеральних фарб, в медицині, як один із компонентів електролітичних ванн для міднення тощо і у складі прядильних розчинів у виробництві ацетатного волокна. У харчовій промисловості зареєстрований як харчова добавка E519. Використовується як фіксатор фарбування та консервант. У побуті застосовують для виведення плям іржі на стелі після затоплень. У пунктах скуповування брухту кольорових металів розчин мідного купоросу застосовується для виявлення цинку, марганцю та магнію в алюмінієвих сплавах та нержавійці. При виявленні цих металів утворюються червоні плями. Кристали пентагідрату сульфату міді(II) Cu. SO4 · 5 H2 O
Залізний купорос. Сульфат заліза(II), залізо(II) сірчанокисле — неорганічна сполука, залізна сіль сірчаної кислоти з формулою Fe. SO4. Нелеткий, не має запаху. Безводна речовина безбарвна, непрозора, дуже гігроскопічна. Кристаллогідрати - гігроскопічні прозорі кристали світлого блакитно-зеленого, тетрагідрат Fe. SO4·4 Н2 О зеленого кольору (розеніт), моногідрат Fe. SO4·Н2 О безбарвний (смольнокіт). Смак сильно-в'яжучий залізистий (металевий). На повітрі поступово вивітрюються (втрачають кристалізаційну воду). Сульфат заліза(II) добре розчинний у воді (26,3 г за 20 °С). З водних розчинів кристалізується блакитно-зелений гептагідрат Fe. SO4·7 Н2 О, який носить тривіальну назву залізний купорос. Токсичність залізного купоросу порівняно низька. Застосовується в текстильній промисловості, сільському господарстві як фунгіцид, для приготування мінеральних фарб. Природний аналог – мінерал мелантерит, зелено-жовтого кольору.
Залізний купорос можна приготувати дією розведеної сірчаної кислоти на залізний лом, обрізки покрівельного заліза і т. д. У промисловості його одержують як побічний продукт при травленні залізних листів, дроту, видаленні окалини та ін. розбавленої H2 SO4.Інший спосіб - окислювальний випал піриту: Лабораторний спосіб
Застосовують у виробництві чорнила, у фарбувальній справі (для фарбування вовни в чорний колір), для консервування дерева. У медицині використовується як лікарський засіб для лікування та профілактики залізодефіцитної анемії. У сільському господарстві застосовується для обприскування садових дерев. Використовується у феросульфатному методі хімічної дозиметрії.
Що таке гідрат в хімії? У хімії гідрат - це сполука, яка поглинає молекули води з навколишнього середовища та включає їх як частину своєї структури. Молекули води або залишаються недоторканими всередині сполуки, або частково розпадаються на свої елементи. Три основні категорії гідратів: неорганічні гідрати, органічні гідрати та газові (або клатратні) гідрати. Молекули води всередині неорганічних гідратів зазвичай вивільняються при нагріванні сполуки. Однак в органічних гідратах вода хімічно реагує з сполукою. «Будівельний блок» газогідрату складається з молекули газу, якою часто є метан, оточеної кліткою з молекул води. Газогідрати знайдені в океанських відкладеннях і в полярних областях. Вони пропонують захоплюючу можливість виступати в якості джерела енергії в найближчому майбутньому. Кристалогідрати
Під час розчинення більшості кристалічних речовин у воді молекули або йони розчинюваної речовини взаємодіють з водою. Відбувається так звана гідратація, а сполуки, що утворюються називаються гідратами. Гідрати – нестійкі сполуки, існують лише в розчинах. Але іноді, навіть після виділення розчиненої речовини з розчину, вода залишається у складі її кристалів. Кристалогідрати – кристалічні речовини, що містять у своєму складі молекули води. Воду, що входить до складу кристалогідратів називають кристалізаційною.
окрім пральної соди,кристалогідратами є гептагідрат сульфату магнію (англійська сіль), декагідрат тетраборату натрію (бура) і декагідрат сульфату натрію (глауберова сіль або sal mirabilis). Сульфат міді та хлорид кобальту також утворюють неорганічні гідрати та мають привабливі кольори у своїх гідратованих формах.
Англійська сіль, бура і глауберова сіль Англійська сіль названа на честь міста Епсом в Англії, де вона була відкрита. Вона використовуються в різних формах як солі для ванн і як добриво для ґрунту. Бура використовується як побутовий миючий засіб і присутня в низьких концентраціях у деяких косметичних засобах. Глауберова сіль названа на честь Йоганна Рудольфа Глаубера, німецько-голландського хіміка та аптекаря, який жив у сімнадцятому столітті. Глаубер відкрив сульфат натрію, а також виявив, що він діє на людей як проносне. Хлорид кобальту (II) у безводній формі небесно-блакитний, а в гідратованій формі (гексагідрат хлориду кобальту (II)) пурпурний. Папір із хлориду кобальту корисний для визначення наявності вологи. Він продається у флаконах, що містять тонкі смужки паперу, покриті хлоридом кобальту. Папір блакитний, коли немає вологи, і стає рожевим за наявності води. Це корисно для визначення відносної вологості.
Процес утворення кристалогідратів використовується в будівництві. Так, порошок цементу в основному складається з суміші безводних кристалів 3 Ca. O*Si. O2 і 2 Ca. O*Si. O2. При змішуванні цементу з водою протікають процеси гідратації та утворення кристалогідратів 3 Ca. O • Si. O2 • 3 H2 O та 2 Ca. O • Si. O2 • 3 H2 O. При цьому пластичний цементний клей, що нагадує по консистенції тісто, твердне і перетворюється на цементний камінь.
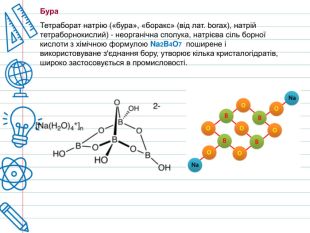
Бура – натрієва сіль борної кислоти. Її емпірична формула Na₂B₄O₇. Речовина має кристалічний тип будови. Широке застосування вперше отримало в Середній Азії, де набуло назву «танкал». Але сучасній назві тетраборат натрію завдячує персам, які прозвали його «бурами», що означало «суміш флюсу з водою». Стародавні Єгиптяни широко застосовували буру при муміфікації. У середньовічній Європі бура застосовувалася для очищення металевих поверхонь посуду та інших предметів побуту.
Існують численні мінерали, які містять тетраборат натрію. До них відносяться: бура (боракс, тинкал) — мінерал Na2 B4 O7∙10 H2 O — декагідрат тетраборату натрію; керніт - тетрагідрат тетраборату натрію - Na2 B4 O7∙4 H2 O; численні мінерали класу боратів, у яких крім оксидів натрію та бору містяться інші метали, - кальцій, магній, залізо та ін; кристалогідрати тетраборату натрію випадають в осад при пересиханні деяких безстічних, сезонно пересихають солоних озер, наприклад, в озері Серлс, розташованому в пустелі Мохаві в США, і деяких озер в Туреччині. Утворює кілька кристалогідратів з різним вмістом води. Ці кристалогідрати і безводний тетраборат натрію Na2 B4 O7 зазвичай називають «бура». Приклади кристалогідратів: пентагідрат Na2 B4 O7∙5 H2 O, так звана «ювелірна бура», використовується при паянні ювелірних виробів; декагідрат Na2 B4 O7∙10 H2 O). Однак найчастіше «бурою» називають декагідрат Na2 B4 O7∙10 H2 O. Ця сіль є прозорими кристалами, що мають хорошу розчинність у теплій воді. При нагріванні понад 400 ° C повністю втрачає кристалізаційну воду. Так як тетраборат натрію є сіллю слабкої кислоти та сильної основи, у воді гідролізується. Водний розчин тетраборату натрію має лужну реакцію. Взаємодіє з сильними кислотами, утворюючи відповідну сіль та борну кислоту:
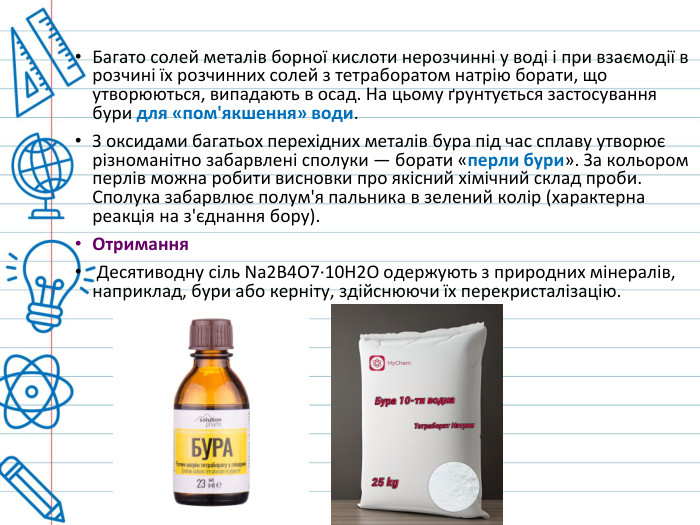
Багато солей металів борної кислоти нерозчинні у воді і при взаємодії в розчині їх розчинних солей з тетраборатом натрію борати, що утворюються, випадають в осад. На цьому ґрунтується застосування бури для «пом'якшення» води. З оксидами багатьох перехідних металів бура під час сплаву утворює різноманітно забарвлені сполуки — борати «перли бури». За кольором перлів можна робити висновки про якісний хімічний склад проби. Сполука забарвлює полум'я пальника в зелений колір (характерна реакція на з'єднання бору). Отримання Десятиводну сіль Na2 B4 O7∙10 H2 O одержують з природних мінералів, наприклад, бури або керніту, здійснюючи їх перекристалізацію.
Застосування - Тетраборат натрію застосовується: як сировина для отримання борної кислоти та різних сполук бору; у виробництві емалей, глазур, оптичних і кольорових стекол, різних керамік; при паянні та плавці металів у складі флюсу; при куванні металів; у паперовій та фармацевтичній промисловості; у виробництві будівельних матеріалів як компонент антисептика для виготовлення целюлозного утеплювача «Ековата» як дезінфікуючий та консервуючий засіб; для приготування буферних розчинів; в аналітичній хімії: як стандартна речовина для визначення концентрації розчинів кислот; для якісного визначення оксидів металів (за кольором перлів); у фотографії - у складі повільно діючих проявників як слабка прискорююча речовина ; як компонент миючих засобів; як компонент косметики; як інсектицид у отруєних приманках для знищення тарганів; використовується у слаймах. Світове виробництво тетраборату натрію складає понад 1,5 млн тонн
Токсичність Речовина малотоксична для теплокровних тварин ЛД50 для щурів 2,66 г/кг. Пил може викликати подразнення слизових оболонок та несприятливо впливає на органи дихання. Є відомості, що речовина знижує фертильність. За нормами Європейського союзу (ЄС) речовини та суміші, що імпортуються до ЄС та містять буру, з липня 2015 року мають бути марковані попередженнями «Може завдати шкоди фертильності» та «Може завдати шкоди ненародженій дитині». Також вказується, що тривале протягом 10-15 років споживання бури у вигляді харчових добавок може провокувати онкологічні захворювання
Аж до середини 19 століття основним місцем видобутку бури була Італія, поки в 1867 Джон А. Вітч не відкрив найбільше родовище в Америці. Масовий видобуток спричинив обвалення цін на мінерал, завдяки чому тетраборат натрію став воістину «народним засобом». До споживача поставляється у двох варіантах: порошку та рідкому розчині. Порошок застосовується у промисловості, насамперед для зварювання металів великої товщини. Рідкий розчин зручний для паяння дрібних деталей – достатньо лише занурити їх у розчин цілком.
Тетраборат натрію знайшов широке застосування як флюс, що використовується в процесі паяння та кування різних металів. Сама собою бура марна, але під впливом високих температур перетворюється на оксид бору, має відмінні антиокислювальні властивості. Також бура здатна: заповнити у металі невеликі тріщини; збільшити зносостійкість та довговічність обробленої деталі; допомогти змінити форму деталі при художньому кованні металу. Під час паяння із застосуванням флюсу з поверхні металу миттєво видаляються окисли, інші речовини розчиняються у ньому. Під час кування на поверхні металу постійно утворюється шар окалини. При неконтрольованому куванні він може перегрітися, що зіпсує виріб. Застосування флюсу дозволяє уникнути цього
Використання в побуті Люди знайшли безліч застосувань цієї простої та недорогої речовини: Тетраборат натрію є хорошим дезінсектором – знищувачем комах та гризунів. Метод із сумішшю картопляного пюре та борної кислоти широко застосовувався ще в СРСР. Порошок розсипався вздовж плінтуса по периметру квартири, що відлякувало гризунів, а комахи поїдали суміш, внаслідок чого гинули. Суміш бури та меду дозволяє ефективно знищувати мурах у будинку
Потужний відбілювач та покращувач прального порошку. Звичайні побутові відбілювачі не справляються з повністю пожовклим білим одягом. Додавання тетраборату натрію збільшить їх ефективність у кілька разів. А у випадку з пральним порошком – варто додати до нього небагато речовини, і він буде добре відпрати речі. Додавши буру в пральний порошок або відбілювач можна значно покращити їх властивості.
Боротьба з пліснявою. Буру змішують з водою для одержання густої суміші, схожої на зубну пасту. Суміш наносять товстим шаром на плісняву і залишають на ніч. Вранці оброблене місце насухо витирають ганчіркою. Єдине обмеження – місце застосування складу не повинно бути пофарбоване, інакше фарба просто «злізе» разом із пліснявою.
Видалення іржі та нальоту з посуду. Іноді вапняний наліт настільки в'їдається в поверхню металу, що з ним перестають давати собі раду навіть дорогі миючі засоби. На допомогу приходить бура. Порошок насипається на місце обробки та залишається на ніч. Вранці наліт зчищається побутовою щіткою. Як правило, достатньо одного застосування, але при необхідності процедуру можна повторити.
Видаляє запахи з пральної машини. Іноді, за незнанням, людина намагається випрати в пральній машині одяг, забруднений розчинником або бензином. Згодом запах цих речовин не йде з барабана і після 10 прань. Суміш відбілювача та бури впорається за 1-2 цикли прання. Економія на миючих засобах. Бура є основним компонентом різних таблеток для посудомийних та пральних машин. Змішайте буру та харчову соду в рівних пропорціях, змочіть водою і заморозьте у формах для льоду.


про публікацію авторської розробки
Додати розробку