Презентація до теми: "Гідроген"






















Історія відкриття водню Ще середньовічний вчений Парацельс помітив, що при дії кислот на залізо виділяються пухирці якогось «повітря». Але що це таке, він пояснити не міг. Тепер відомо, що це був водень. Англійські хіміки 18 ст., Генрі Кавендіш і Джозеф Прістлі, що заново відкрили водень, першими вивчили його властивості. Вони виявили, що це надзвичайно легкий газ - він в 14 разів легший від повітря. Якщо надути ним гумову кульку, вона злетить угору. Цю властивість водню використовували раніше для наповнення повітряних куль і дирижаблів.
Однак після багатьох нещасних випадків водень у повітроплаванні більше не використовують, його заміняють гелієм або гарячим повітрям. При горінні водню утворюється вода - сполука водню й кисню. Це довів наприкінці 18 століття французький хімік Лавуазьє. Звідси й назва газу - «той, що народжує воду». Лавуазьє також зумів одержати водень із води. Він пропускав водяні пари через розпечену залізну трубу із залізними стружками. Кисень із води міцно з'єднувався із залізом, а водень виділявся у вільному вигляді. Зараз водень теж одержують із води, але іншим способом - за допомогою електролізу.
В 1766 році англійським фізик і хімік Генрі Кавендіш (1731–1810) довів у своїй роботі з експериментального дослідження повітря, що в ньому є газ, що різко відрізняється від повітря, і повідомляє про відкриття водню й вуглекислого газу (CO2). Діючи соляною кислотою (HCl) на цинк (Zn) і залізо (Fe), він виявив невідомий безбарвний газ, що не має запаху й смаку. Виявилося, що газ горить, вибухаючи, тому він був названий “горючим повітрям”.
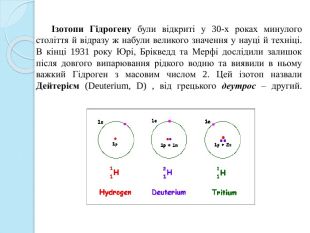
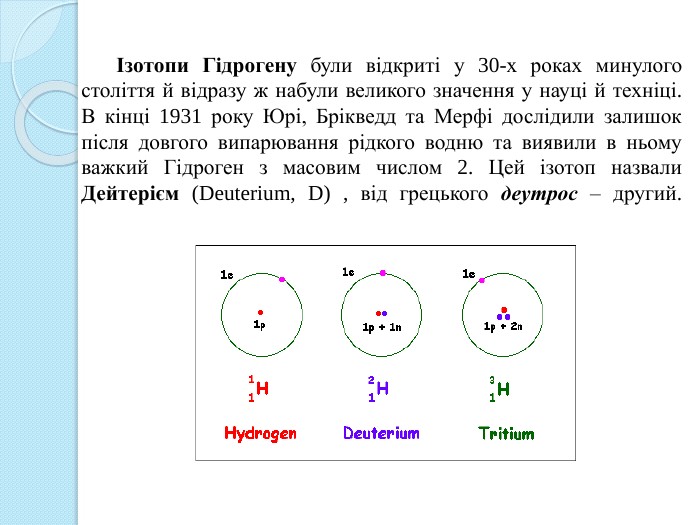
Ізотопи Гідрогену були відкриті у 30-х роках минулого століття й відразу ж набули великого значення у науці й техніці. В кінці 1931 року Юрі, Брікведд та Мерфі дослідили залишок після довгого випарювання рідкого водню та виявили в ньому важкий Гідроген з масовим числом 2. Цей ізотоп назвали Дейтерієм (Deuterium, D) , від грецького деутрос – другий.
Через чотири роки після цього, у воді , яка була піддана довготривалому електролізу, був виявлений ще один більш важкий ізотоп Гідрогену (3 H), який назвали Тритієм, від грецького тритос – третій. Тритій відкритий англійськими вченими Е. Резерфордом, М. Оліфантом і П. Хартеком в 1934 році. Ядро протію містить один протон, дейтерію – два протони, тритію – три, звідси і назви ізотопів Ернест Резерфорд(1871 – 1937)Марк (Маркус Лоренс Елвін) Оліфант(1901 – 2000)Пауль Хартек(1902 – 1985)
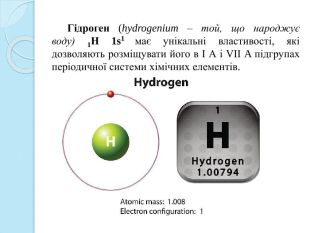
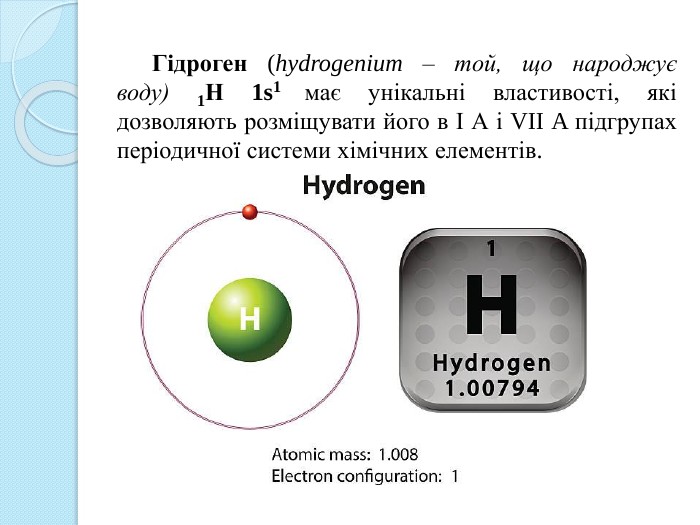
Електронна конфігурація гідрогену 1s1 подібна до електронної конфігурації валентних електронів атомів лужних металів. Як лужні метали, він має відновні властивості, що характеризується ступенем окиснення +1. Проте Гідроген не можна вважати електронним аналогом лужних металів через відсутність в нього внутрішнього електронного шару. Гідроген – типовий неметал. Як і галогенам, атому гідрогену для завершення зовнішнього шару не вистачає одного електрона. Крім того, з елементами підгрупи VІІ А його пов’язує газоподібний стан, двоатомність (Н2 і Сl2), ковалентність зв’язку в молекулі, неелектропровідність у газоподібному, рідкому і твердому стані, а також подібність гідридів з галоґенідами. Таким чином, гідроген займає особливе положення в періодичній системі. Недаремно в її першому варіанті Д.І. Менделєєв розмістив гідроген в окрему графу.
Гідроген — найбільш розповсюджений елемент у Всесвіті. На його долю припадає 88,6% всіх атомів. Таким чином, водень — основна складова частина зірок та міжзоряного газу. Близько половини маси Сонця та зірок припадає на Гідроген. ПОШИРЕННЯ Гідрогену в ПРИРОДІNGC 604, гігантська область іонізованого водню в Галактиці Трикутника. Фотографія Сонця, отримана Обсерваторією сонячної динаміки НАСА.
Гідроген входить до складу вугілля, нафти, природного газу, глини, а також всієї біосфери — рослин та тварин. 16% всіх атомів на Землі припадає на атоми Гідрогену. У вільному вигляді він зустрічається дуже рідко — в вулканічних та інших природних газах. Кам'яне вугілля. Зразок сирої нафти(геологічний музей А. А. Штукенберга)
1) Водень Н2 – безбарвний газ, не має запаху; 2) Молекула Н2 має невеликі розміри (0,074 нм), малу масу і значну рухомість. Саме тому водень має низькі температури кипіння (20,4 К) і плавлення (13,9 К); 3) Водень – найлегший з усіх газів (маса 1 л Н2 за нормальних умов становить 0,089 г) та малорозчинний у воді (2 об’єми у 100 об’ємах води), краще – в органічних розчинниках і добре розчинний в багатьох металах (Ni, Pt, Pd);Фізичні властивості водню:
За звичайних умов водень проявляє низьку хімічну активність, що пояснюється міцністю зв’язку між атомами Гідрогену в молекулі водню. Для підвищення реакційної здатності водню використовують каталізатори, найчастіше, метали: платину, нікель, паладій тощо. Їхня каталітична активність пояснюється тим, що молекули водню адсорбуються деякими металами і розпадаються на атоми, які набагато активніші за молекули. Також атомарний водень утворюється у момент його виділення. Тому деякі реакції проводять безпосередньо в реакційній суміші під час виділення водню. Хімічні властивості водню
Взаємодія водню з неметалами: У реакціях з неметалами водень проявляє відновні властивості. Це пояснюється тим, що у Гідрогену електронегативність менша за електронегативність інших неметалічних елементів, тому в сполуках з неметалічними елементами Гідроген набуває ступінь окиснення + 1. За звичайних умов водень взаємодіє зі фтором: H2 + F2 = 2 HF. При УФ-освітленні або нагріванні водень взаємодіє з хлором: H2 + Cl2 = 2 HCl. Водень реагує з киснем при нагріванні або в присутності каталізатора, наприклад, платини: 2 H2 + О2 = 2 H2 О. При нагріванні відбуваються оборотні реакції водню з сіркою, бромом, йодом і азотом: H2 + S ⇄ H2 S, 3 Н2 + N2 ⇄ 2 NН3.1. Взаємодія водню з простими речовинами
Взаємодія водню з металами: У реакціях з металами водень проявляє окисні властивості. У Гідрогену електронегативність більша за електронегативність металічних елементів, тому у сполуках з металічними елементами Гідроген набуває ступінь окиснення – 1. При нагріванні водень взаємодіє з лужними, лужноземельними та деякими іншими металами. При цьому утворюються гідриди металічних елементів – йонні кристалічні сполуки, наприклад, натрій гідрид:2 Na + H2 = 2 Na. H,Са + H2 = Сa. H2. Більшість гідридів металів – нестійкі і при нагріванні розкладаються ще до досягнення своєї температури плавлення:2 Na. H = 2 Na + H2.
При нагріванні водень здатний реагувати зі складними речовинами,і проявляти при цьому відновні властивості, утворюючи сполуки, у яких його ступінь окиснення дорівнює +1.взаємодія водню з оксидами металічних елементів Водень відновлює малоактивні метали і метали середньої активності з їх оксидів: Сu. O + Н2 = Сu + Н2 O,WO3+ 3 H2 = W + 3 Н2 O.взаємодія водню з карбон(ІІ) оксидом. При 220-300 ° С під тиском 150-600 ат у присутності каталізаторів з водню і карбон(ІІ) оксиду отримують метанол: СO + 2 Н2 ⇄ CH3 OH.взаємодія водню з органічними речовинами. У присутності каталізаторів водень приєднується до ненасичених органічних речовин, наприклад, до етену і етину: СН2=СН2+Н2 → СН3―СН3,СН≡СН +Н2 → СН2=СН22. Взаємодія водню із складними речовинами
Лабораторні і промислові методи одержання водню дуже відрізняються. Так, в малих кількостях газ одержують в основному за допомогою реакцій, в яких беруть участь мінеральні речовини, а великомасштабні виробництва більшою мірою використовують органічний синтез. Основним промисловим методом одержання водню є каталітична конверсія вуглеводневих газів (природний, попутний, нафтовий та ін.) Природний газ містить метан, вищі вуглеводні, деяку кількість азоту і вуглекислоти, а також домішки сірчистих сполук. В процесі конверсії метан окислюється водяною парою, вуглекислотою або киснем: Способи отримання і виділення водню: 1. СН4+ Н2 О СО + 3 Н2 - 206,4 к. Дж (49,3 ккал) 2. СН4 + СО2 2 СО + 2 Н2 - 248,3 к. Дж (8,5 ккал) 3. СН4 + 0,5 О2 СО + 2 Н2 + 35,58 к. Дж (8,5 ккал) 4. СО + Н2 О СО2 + Н2 + 41,02 к. Дж (9,8 ккал)
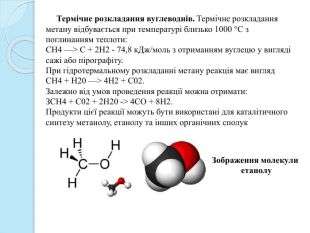
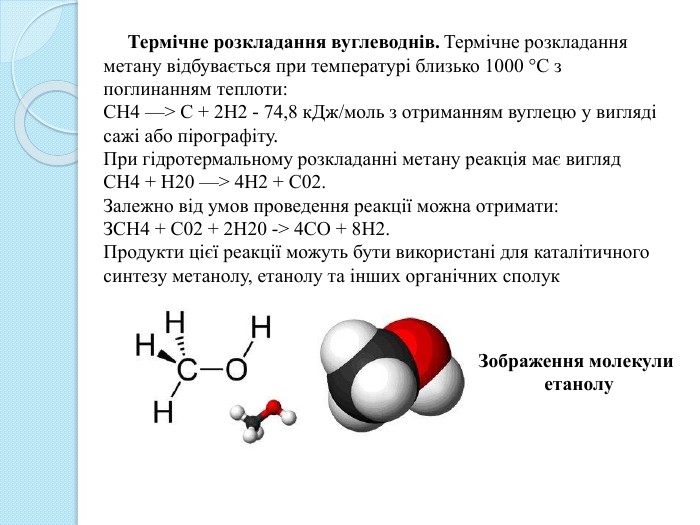
Термічне розкладання вуглеводнів. Термічне розкладання метану відбувається при температурі близько 1000 °С з поглинанням теплоти: СН4 —> С + 2 Н2 - 74,8 к. Дж/моль з отриманням вуглецю у вигляді сажі або пірографіту. При гідротермальному розкладанні метану реакція має вигляд. СН4 + Н20 —> 4 Н2 + С02. Залежно від умов проведення реакції можна отримати: ЗСН4 + С02 + 2 Н20 -> 4 СО + 8 Н2. Продукти цієї реакції можуть бути використані для каталітичного синтезу метанолу, етанолу та інших органічних сполук. Зображення молекули етанолу
Термохімічні цикли. Термохімічні цикли виробництва водню належать до теоретично найбільш перспективних. Із великої кількості циклів найбільш перспективними вважаються цикл Вестингауза і карбонат-галогенідний. H2 S04(koh4.) -> Н20(пл.) + S03 (347 - 400° С); S03 -> 0,502 + S02 (780 - 920° С); Н20(п. п.) Нг. О(р.) (100° С); S02 + H20^H2 S04 + H2. Сумарна реакція 3 H20 = ЗН2 +1,502. Витрати на отримання їм Н2 становлять близько 8 к. Вт-год, що значно більше, ніж при електролізі води, розрахунковий ККД процесу дорівнює 44 %. Парофазна конверсія водню з кам’яного, бурого вугілля, торфу. Цей процес, який має назву процесу Боша, відбувається у дві стадії. На першій - водяна пара пропускається над розжареними до температури 1000 - 1100 °С коксом, вугіллям тощо, в результаті чого відбуваються реакції: С + Н20 —> Н2 + СО -118,82 к. Дж/моль; С + 2 Н20 —> 2 Н2 + СО2 - 75,31 к. Дж/моль; С + С02 —> 2 СО -162,33 к. Дж/моль. На другій стадії проводиться конверсія оксиду вуглецю за реакцією. СО + Н20 —> Н2 + С02 +130,3 к. Дж/моль, додаючи воду і перетворюючи її в пару при оптимальній температурі 450 °С з додаванням каталізатора. Відділяють із газової суміші СО2 різними способами, наприклад обробкою підігрітим розчином карбонату калію.
Залізопарофазний метод. Отримують водень залізопарофазним методом у дві стадії при температурі 650-900 °С. На першій стадії залізо окиснюється парами води до магнетиту за ендотермічними реакціями: Fe + Н20 = Н2 + Fe - 23,0 к. Дж/моль; 3 Fe. O + Н20 = Н2 + Fe304 - 80,9 к. Дж/моль. На другій стадії магнетит й оксид заліза відновлюються синтез - газом при тих же температурах: Fe304 + CO = 3 Fe. O + С02 - 25,73 к. Дж/моль; Fe. O + СО = Fe + C02 +17,74 к. Дж/моль; Fe304 + H2 = 3 Fe. O + H20 - 80,9 к. Дж/моль; Fe. O + H2 = Fe + H20 - 23,0 к. Дж/моль. Всі реакції оборотні, реакції окиснення й відновлення заліза краще проводити роздільно. До переваг залізопарофазного методу можна віднести високу концентрацію отриманого водню (98 %) і відносну простоту процесу. Магнетит
Електроліз води один із найбільш відомих і добре досліджених методів отримання водню. Суть його полягає в пропусканні через воду постійного струму, в результаті чого на катоді виділяється водень, а на аноді - кисень. Електрохімічний метод отримання водню з води характеризується такими позитивними показниками: - висока чистота одержуваного водню - до 99,99 % і вище; - простота технологічного процесу, його безперервність, відсутність рухомих частин в електролітичному середовищі, можливість повної автоматизації процесу; - можливість отримання цінних побічних продуктів - важкої води і кисню; - загальнодоступна і невичерпна сировина - вода; - гнучкість процесу та можливість отримання водню безпосередньо під тиском; - фізичне розділення водню і кисню в самому процесі електролізу. Електролітичний водень є найбільш доступним, але дорогим продуктом. У промислових і дослідно-промислових установках реалізований ККД електролізера становить 70-80 % при густині струму менше 1 А/см, зокрема для електролізу під тиском. Теоретична витрата електроенергії на виробництво 1 м водню становить 2,95, а практична - 4,21-5,0 к. Вт-год/м Н2. Електроліз води та пари
Отримання водню за допомогою енергоакумулюючих речовин. Енергоакумулюючі речовини є специфічною групою речовин, які можна багаторазово окиснювати і відновлювати для отримання енергії на основі водню. Енергоакумулюючі речовини поділяються на дві групи: які виділяють акумульовану енергію при хімічній взаємодії з водою і які виділяють акумульовану енергію в результаті фізичного впливу на них. До першої групи належать гідриди металів (Li. H, Na. H, Mg. H, Са. Н тощо), карбіди, нітриди та інші високоенергетичні сполуки (метанол, аміак тощо), які мають водень. Енергоакумулюючі речовини можна отримувати на основі низькосортового високозольного вугілля Донбасу і Львівсько - Волинського басейнів. При відновлюванні шлаків на теплових електростанціях отримують високореакційні сплави, які при взаємодії з водою виділяють водень із високими швидкостями. Значні перспективи мають енергоакумулюючі речовини на основі алюмінію, бору, кремнію, магнію та інших металів. До другої групи належать спеціальні сплави й деякі метали, які мають властивість при підвищенні тиску водню оборотно поглинати його, а при підвищенні температури виділяти значні об’єми молекулярного водню. До таких речовин належать La. Ni5 H6, Fe. Ni. Hx, La. Pd. Hg і багато інших. Ємність гідридів по водню дуже висока, і тому вони використовуються для гідридних акумуляторів водню
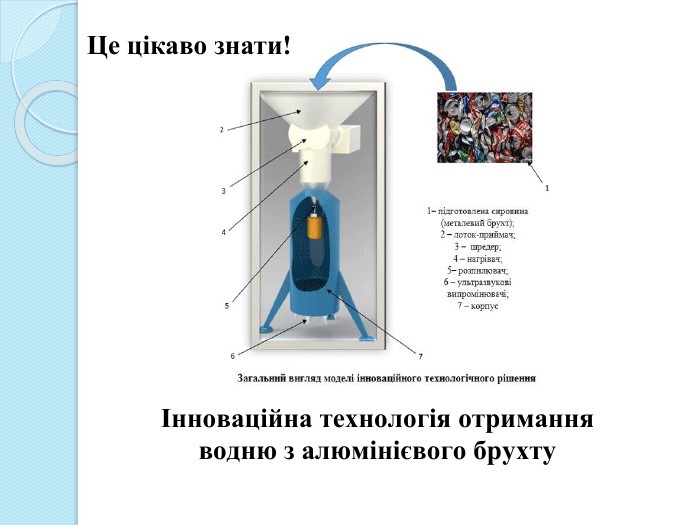
Наведену вище установку розробили працівники Національного технічного університету України "Київський політехнічний інститут імені Ігоря Сікорського“."Ідея даного проєкту полягає в створенні комплексної технології виробництва водню завдяки утилізації відходів, зокрема тих, що містять алюміній, застосовуючи ультразвукові модулі. Запропонований метод є абсолютно безпечним для обслуговуючого персоналу та навколишнього середовища. У секції "Зелена енергетика, воднева економіка, екологія" Фестивалю "Sikorsky Challenge" проєкт було визнано інноваційним та відібрано для проходження акселераційної програми з подальшою фінансовою підтримкою.
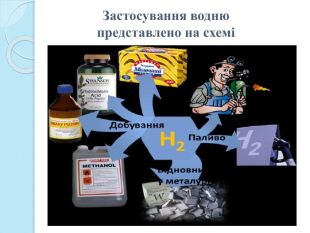
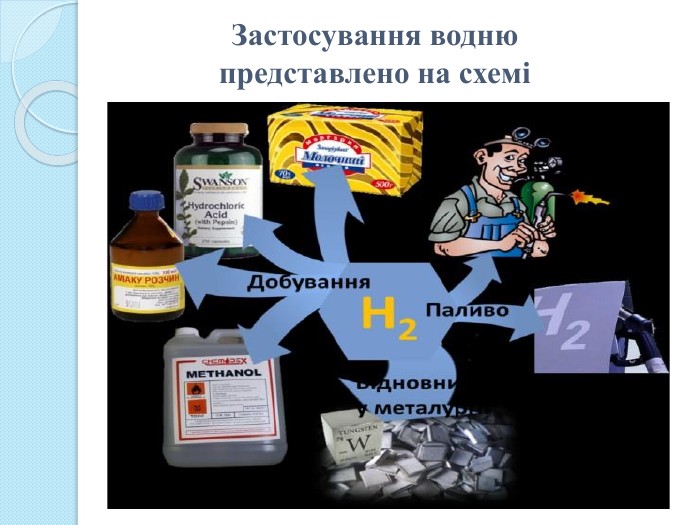
1. Водень використовується при синтезі аміаку NH3, хлороводню HCl, метанолу СН3 ОН, в гідрокрекінгу (крекінг у атмосфері водню) природних вуглеводнів, як відновник при отриманні деяких металів.2. Гідруванням природних рослинних олій отримують твердий жир — маргарин. 3. Рідкий водень застосовується як ракетне паливо та як охолоджувач, оскільки має найвищу теплопровідність з усіх газів. 4. Суміш кисню з воднем використовують при зварюванні металів.5. Дейтерій та тритій застосовують у атомній енергетиці. Дуже перспективним напрямком є використання водню як палива для двигунів нового типу, так званих паливних елементів. У США та в Європі вже існують водневі заправні станції, які забезпечують воднем автомобілі та автобуси, що на ньому працюють. Ця галузь називається воднева енергетика. Застосування водню
-
 Клюй Татьяна 21.12.2025 в 19:10Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Клюй Татьяна 21.12.2025 в 19:10Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Furman Yaroslav 10.11.2023 в 00:25Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Furman Yaroslav 10.11.2023 в 00:25Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку