Презентація до уроку: "Будова електронних оболонок атомів хімічних елементів"
Про матеріал
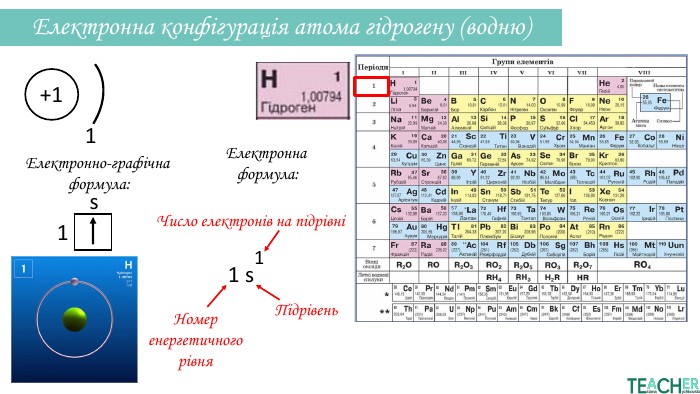
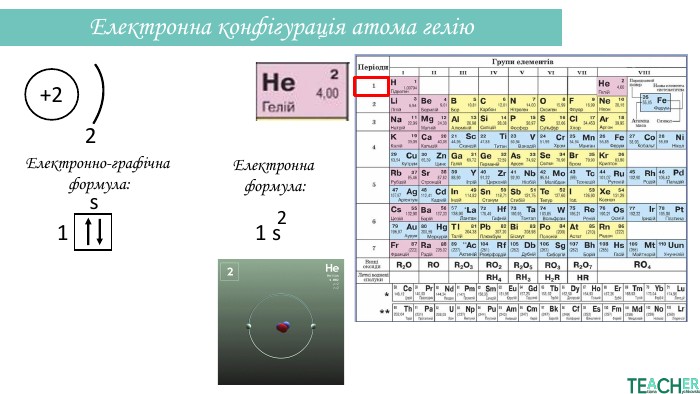
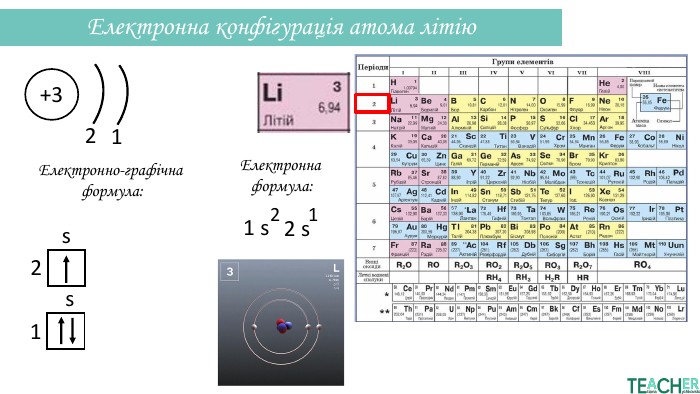
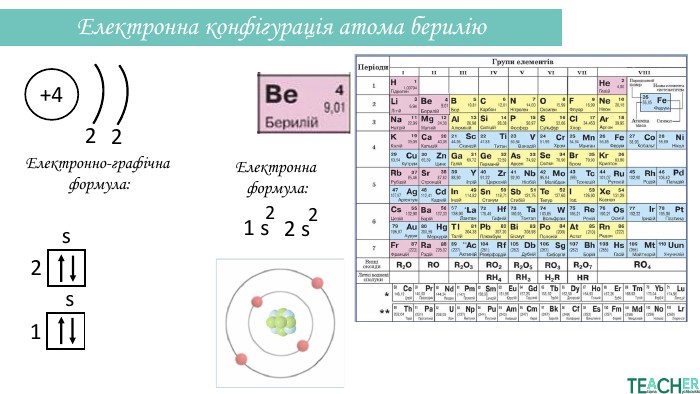
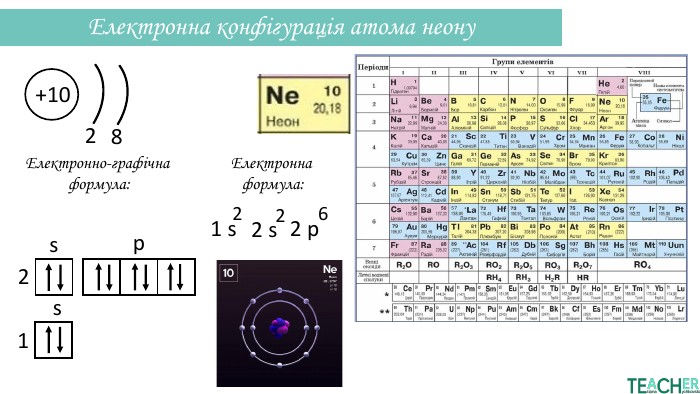
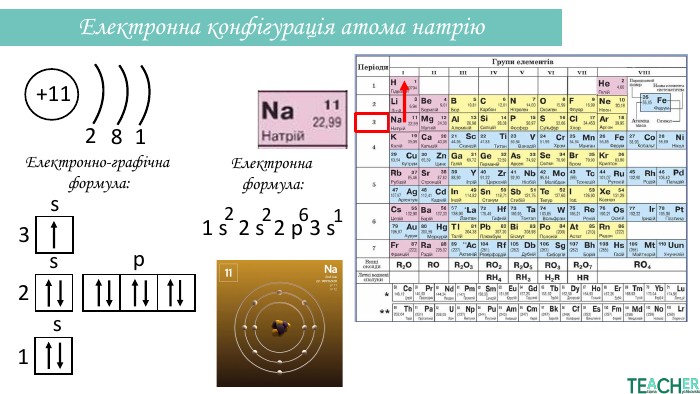
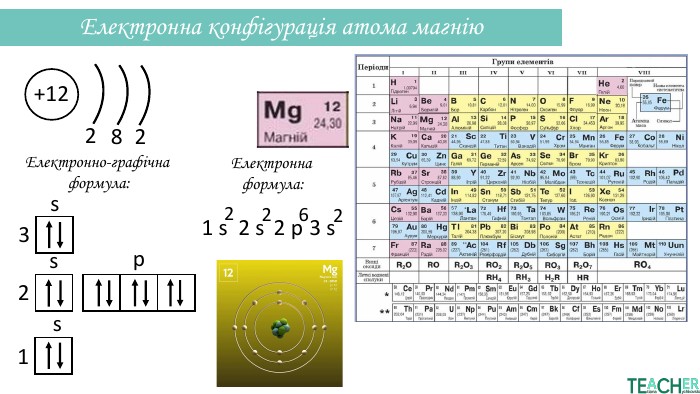
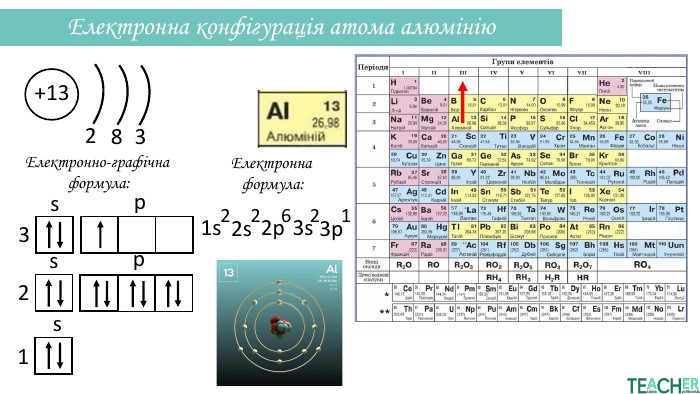
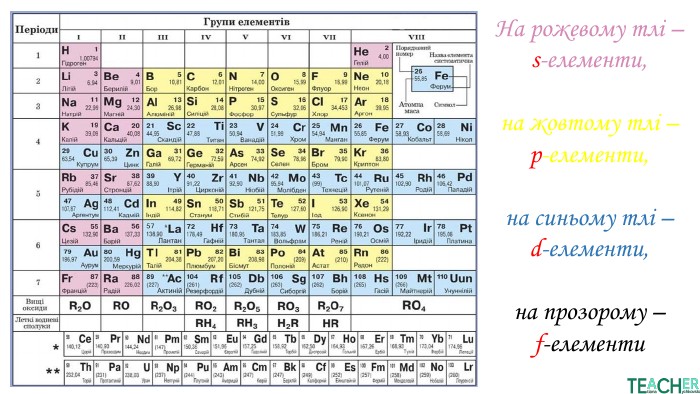
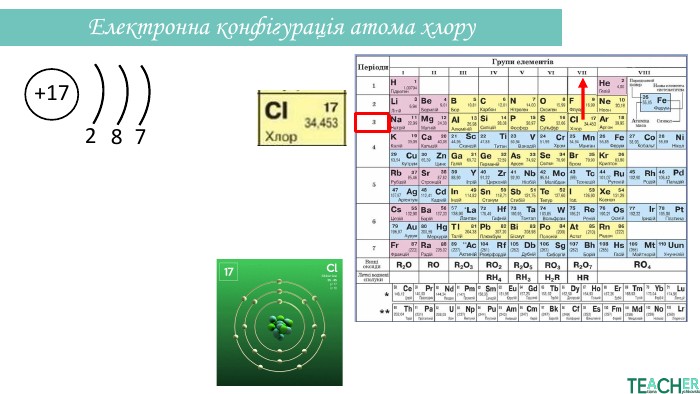
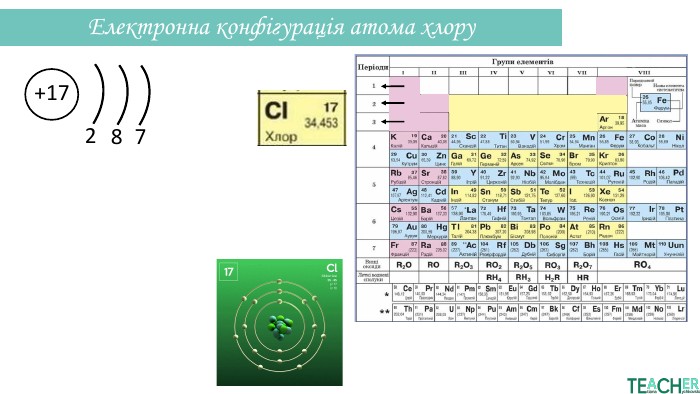
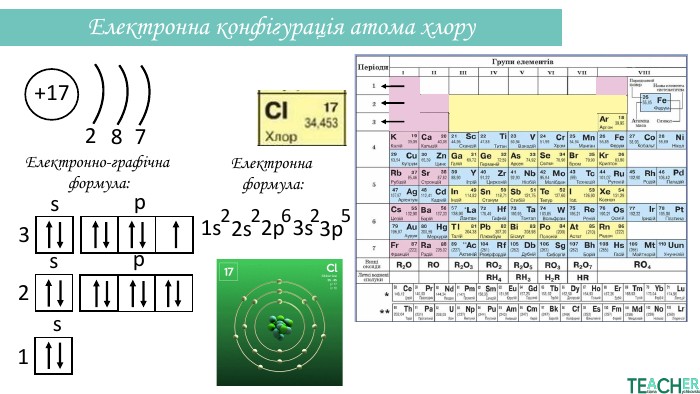
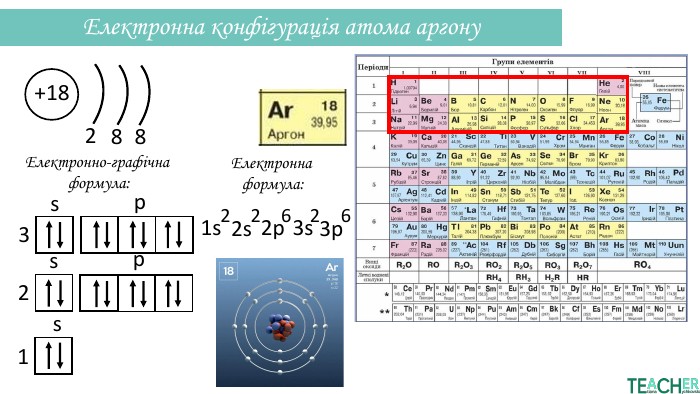
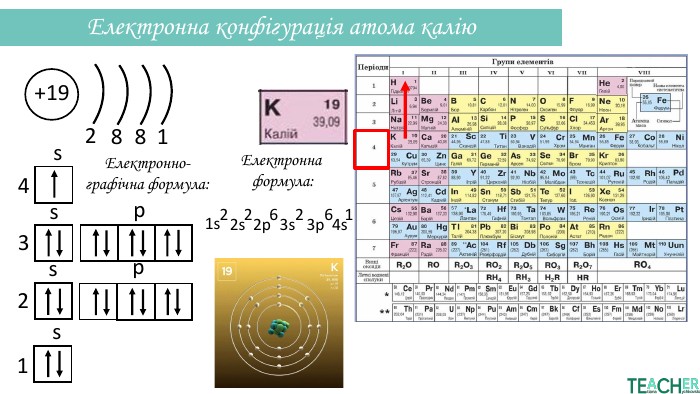
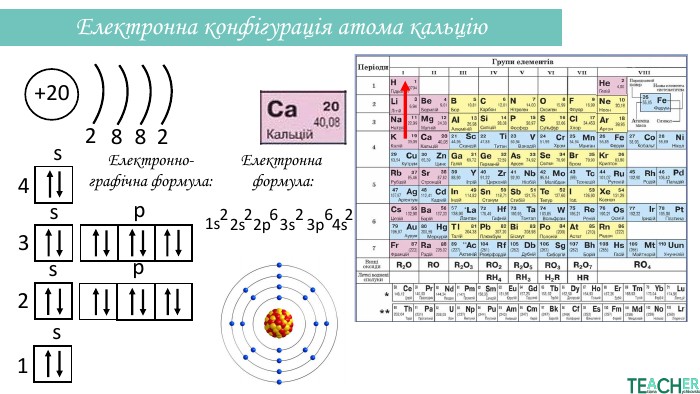
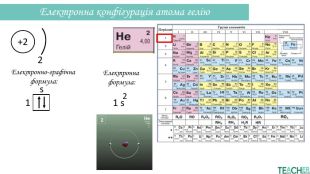
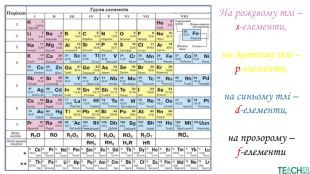
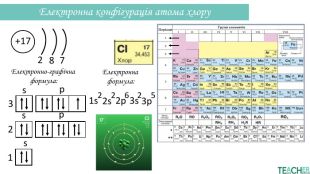
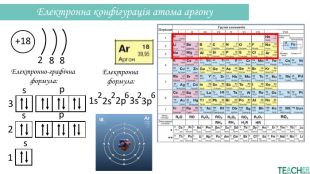
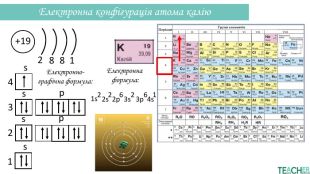
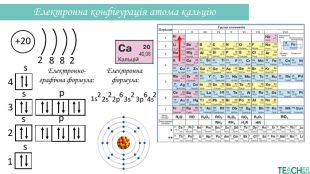
Презентація допоможе проілюструвати тему розподілу електронів за енергетичними рівнями, підрівнями, орбіталями. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку





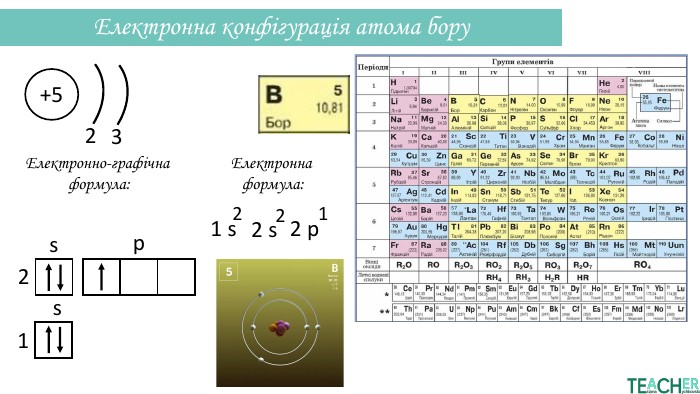
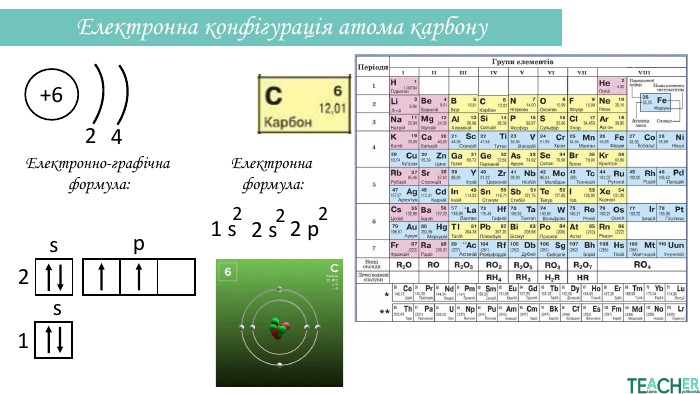
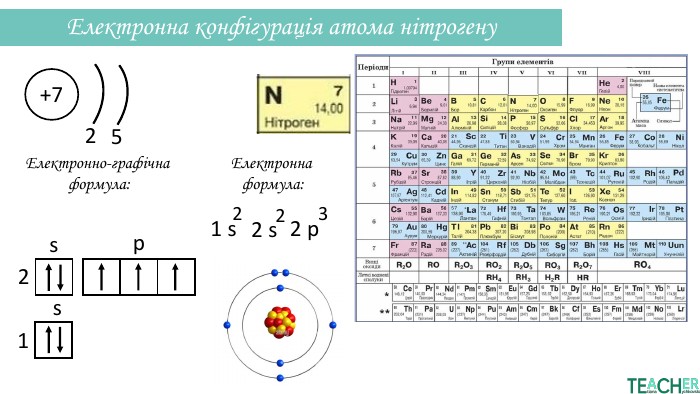
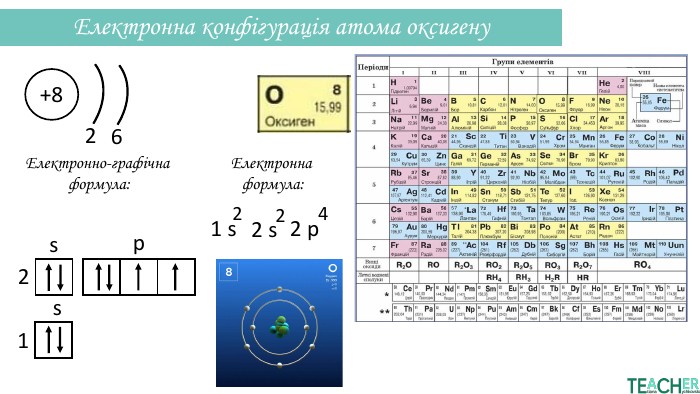






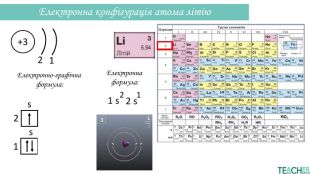
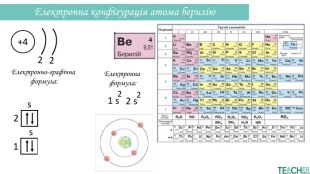
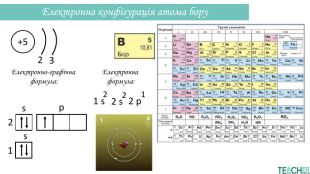
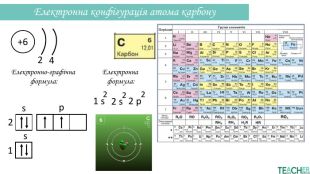

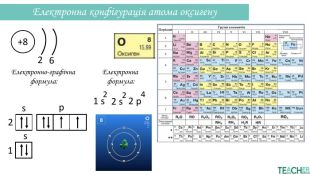
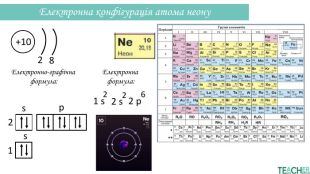
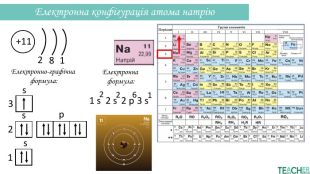
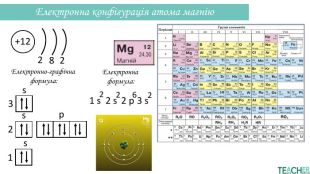




-

Прищенко Тетяна Іванівна
06.11.2024 в 10:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Овчарова Алевтина Вікторівна
27.09.2024 в 11:43
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
26.09.2024 в 23:16
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Виноградова Оксана Михайлівна
30.10.2023 в 21:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Савіна Ольга
03.10.2023 в 13:55
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пашаєва Тетяна Миколаївна
02.10.2023 в 17:36
Щиро дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 3 відгука