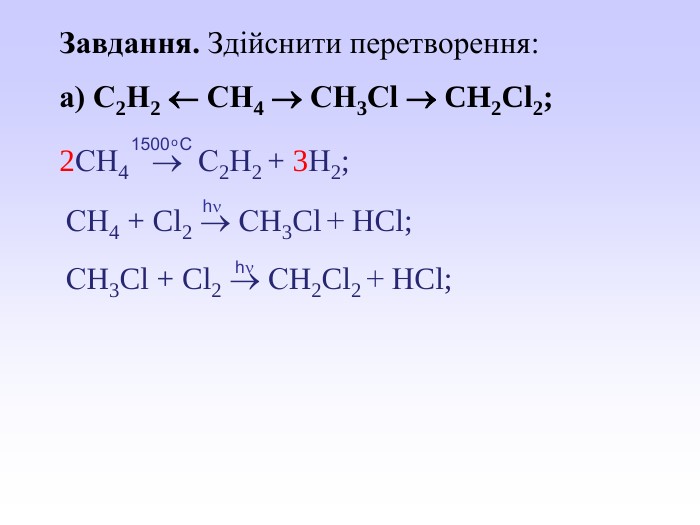
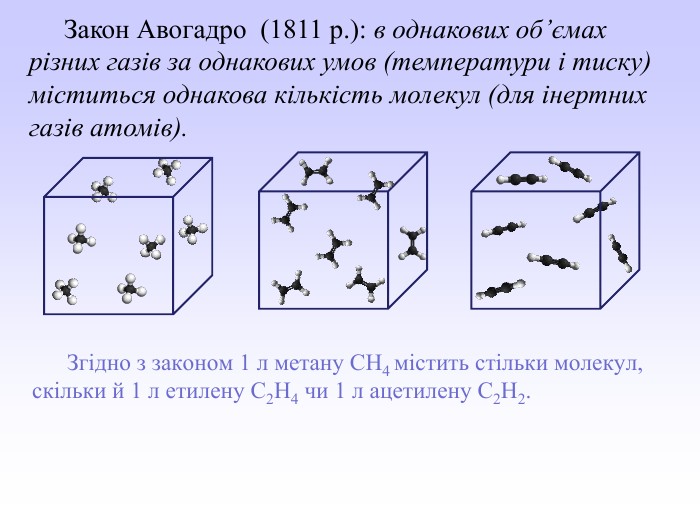
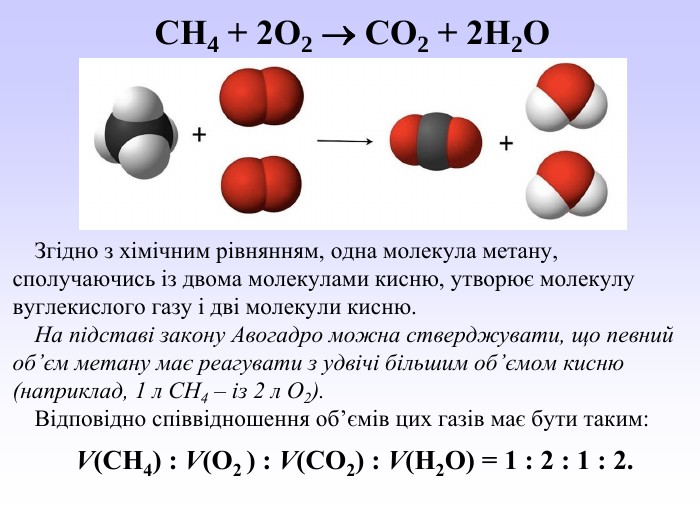
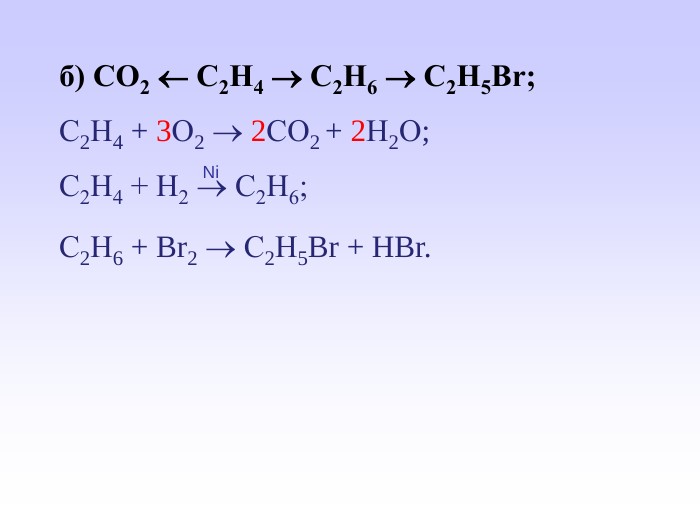Презентація до уроку хімії, 9 клас. Розрахункові задачі. Обчислення об’ємних відношень газів за хімічними рівняннями
Про матеріал
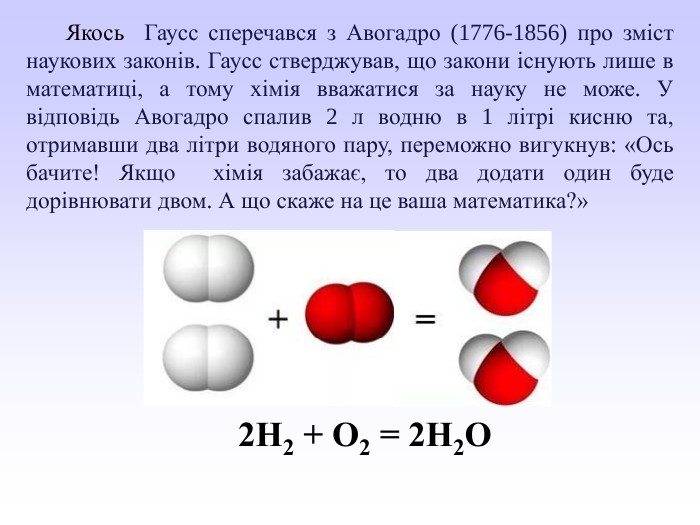
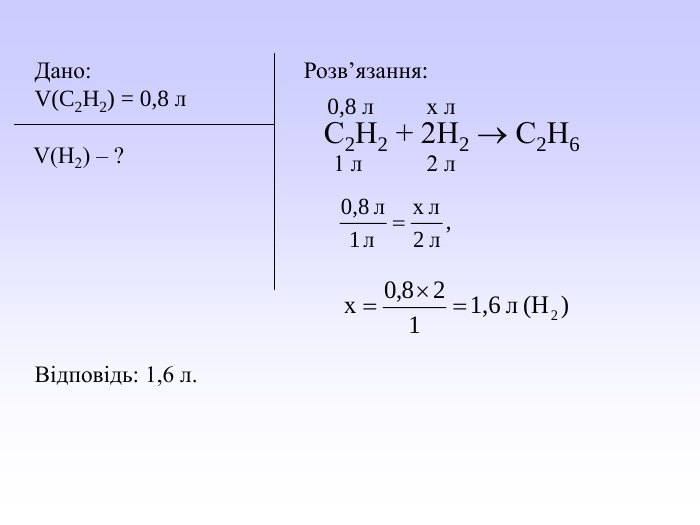
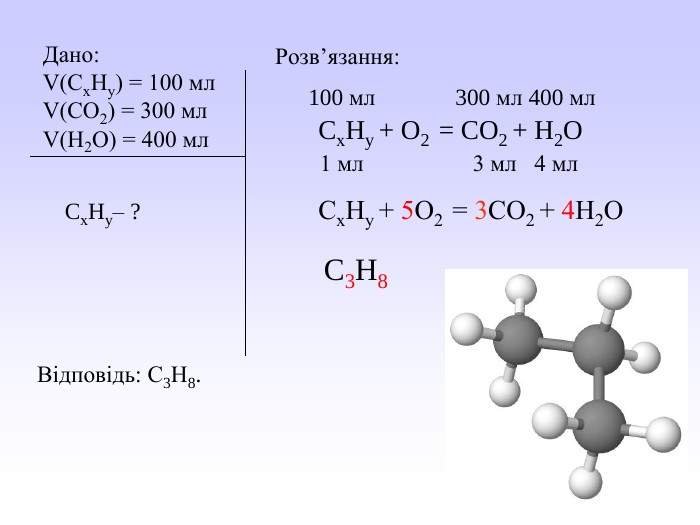
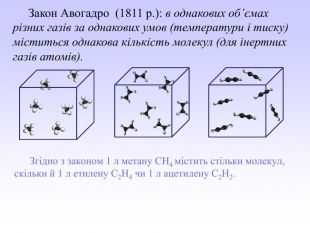
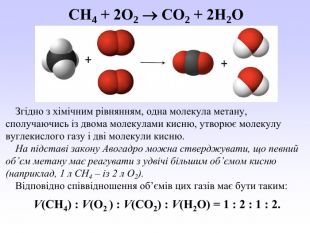
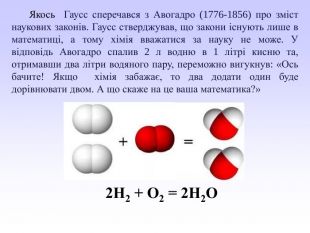
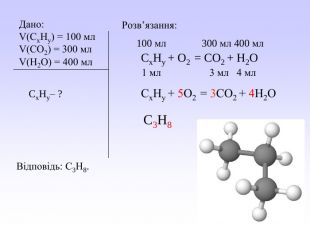
Презентація може бути використана вчителями хімії під час вивчення закону об’ємних відношень газів. У презентації викладений необхідний теоретичний матеріал та розглянуто приклади розв’язування розрахункових задач з використанням цього закону. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
Дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку