Презентація до уроку хімії у 9 класі "Етанова (оцтова) кислота"
Про матеріал
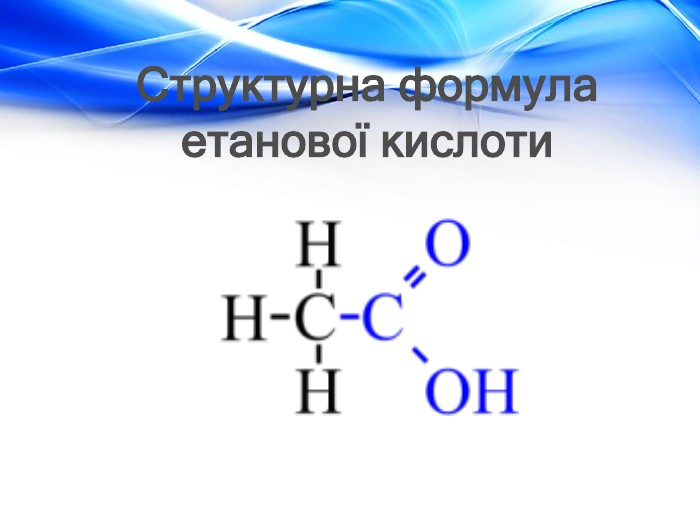
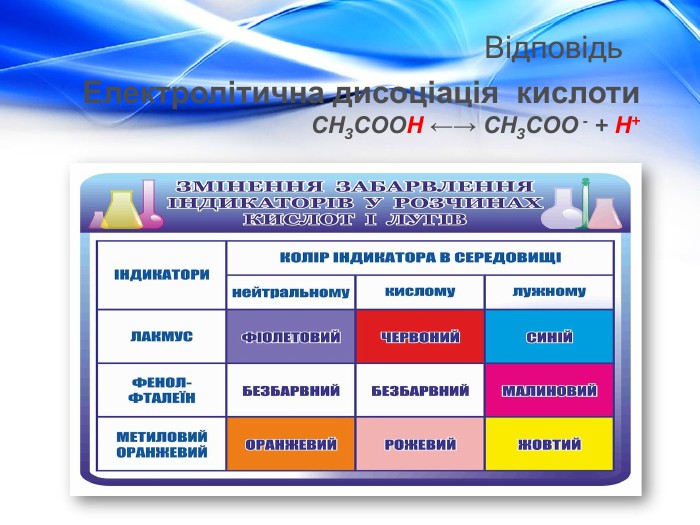
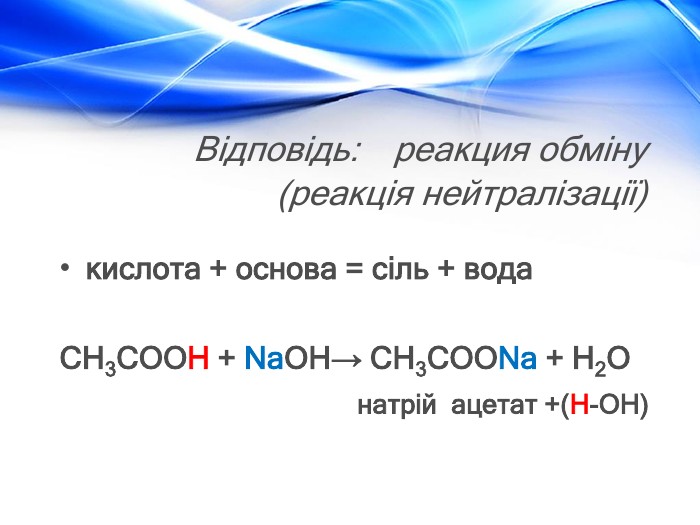
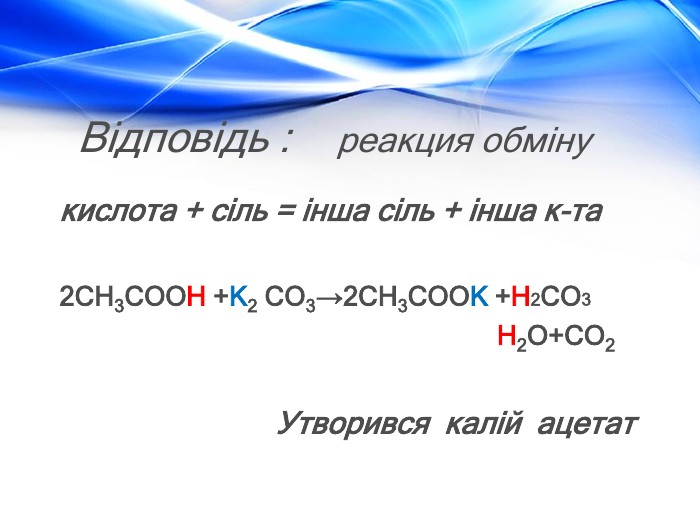
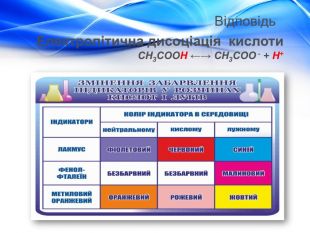
Матеріал містить відомості про молекулярну та структурну формулу етанової (оцтової) кислоти, її фізичні властивості, хімічні властивості (електролітичну дисоціацію, дію на індикатори, взаємодію з металами, лугами, солями) та області застосування. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку

















































-

Костюк Галина Андріївна
26.03.2024 в 21:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дунаєвська Тетяна Іванівна
10.05.2023 в 00:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Білецька Олена Миколаївна
14.03.2023 в 23:45
Круто!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пась Любов Григорівна
12.03.2023 в 18:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук