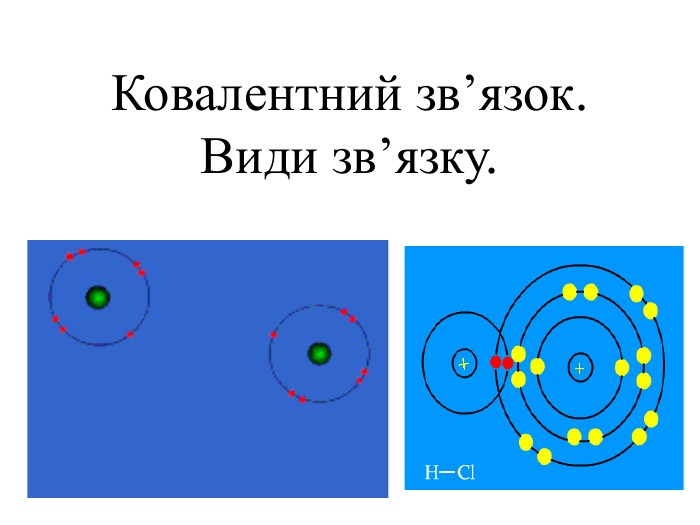
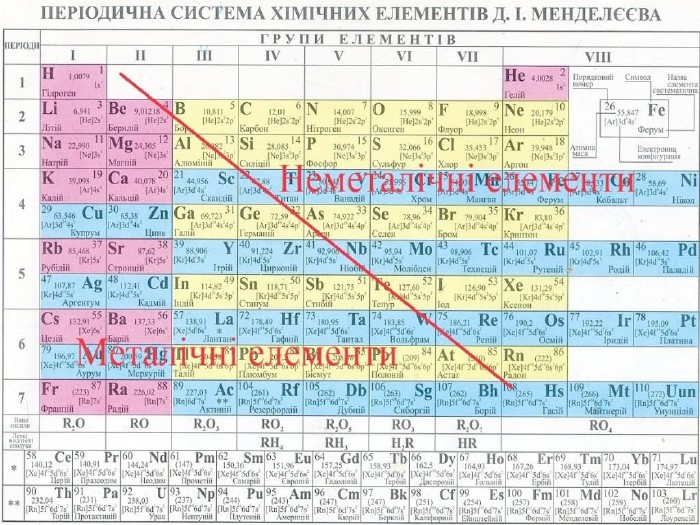
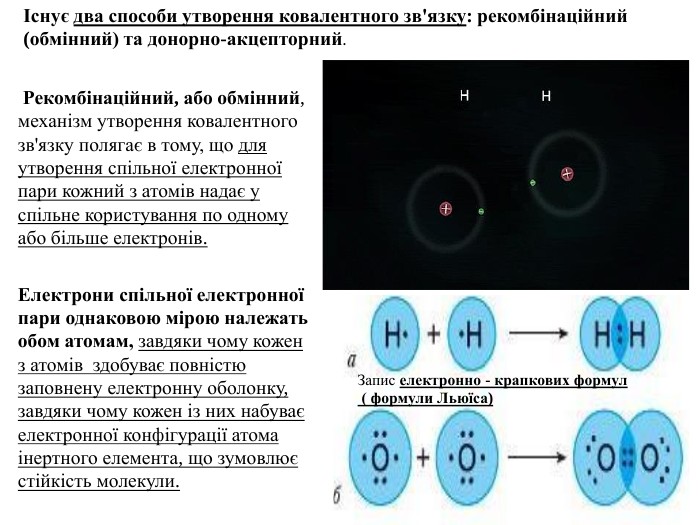
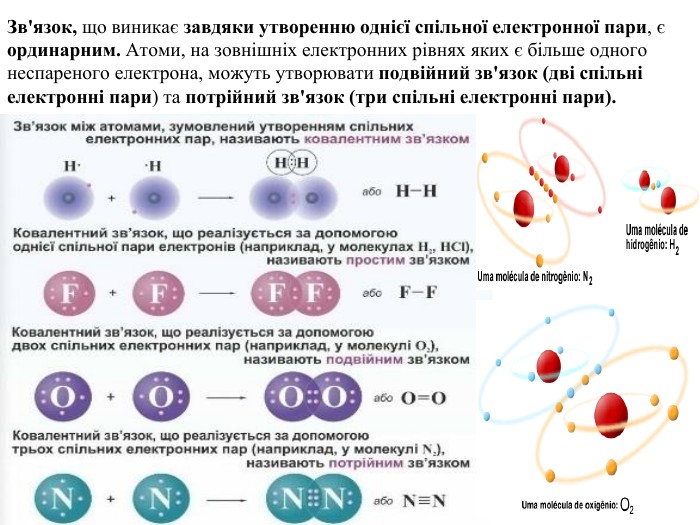
Презентація. Ковалентний зв'язок.
Про матеріал
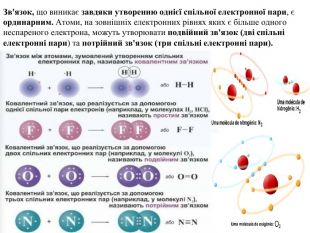
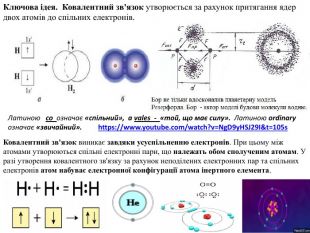
Пропоную презентацію " Ковалентний зв'язок. Види ковалентного зв'язку." Презентація містить добірку навчального матеріала, може бути цікавою для вчителів хімії, може бути використана для підготовки та під час проведення уроків хімії. Презентація містить посилання до цікавих за сутністю та оформленню відео, рухливі зображення - гіфи.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку