Презентація до уроку хімії з поглибленим вивченням для 9 класу з теми "Поняття про еквівалент та молярну концентрацію еквівалентів речовини"
Про матеріал
Презентація до уроку хімії з поглибленим вивченням для 9 класу з теми "Поняття про еквівалент та молярну концентрацію еквівалентів речовини" розроблена для вивчення нового матеріалу з даної теми.
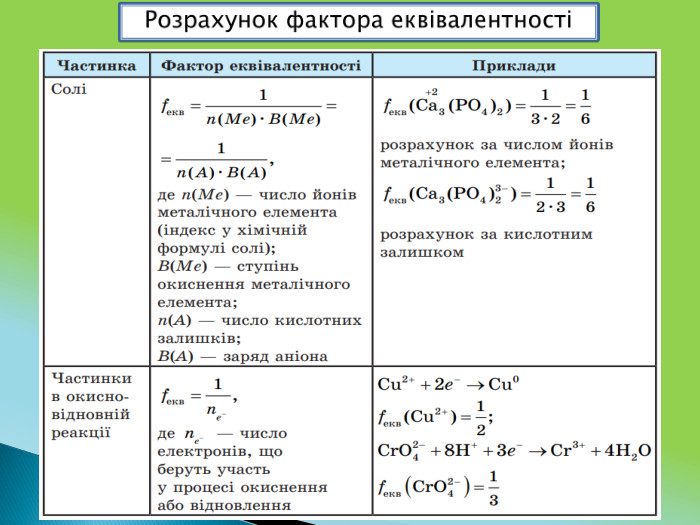
Вона розкриває зміст понять: "еквівалент", "фактор еквівалентності", "молярна маса еквівалента речовини".
У презентації наведено приклади розрахунків фактора еквівалентності елемента, простої речовини, неорганічних речовин основних класів, а також окисника та відновника; молярної маси еквівалента будь-якої речовини. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку